茶叶功能成分预防阿尔茨海默病研究进展
唐静怡,周 方,曾鸿哲,李秀平,欧阳建,黄建安,3, ,刘仲华,3,
(1.湖南农业大学茶学教育部重点实验室,湖南长沙 410128;2.国家植物功能成分利用工程技术研究中心,湖南长沙 410128;3.植物功能成分利用省部共建协同创新中心,湖南长沙 410128)
阿尔茨海默病(Alzheimer disease,AD)是一种与年龄相关的神经系统退行性亚型痴呆疾病,主要临床病征表现为记忆功能衰退、空间和时间识别紊乱、智力下降、行为异常等认知功能变化。AD 患者的发病年龄通常在50 岁以后,且伴随年龄增长其患病风险也不断增加。目前我国人口老龄化问题日渐突出,2020 年我国65 岁及以上老龄人口为1.91 亿,约占总人口13.49%,相较2015 年增幅3.03%[1]。老年人口的增加将会带来阿尔茨海默病患者的数量增长,王英全等[2]预测2050 年中国老年人口达4.49 亿,其中阿尔茨海默病患病人数将达到约3003 万,为2015年患病人数的2.35 倍。AD 作为一种神经退行性疾病,严重影响患者的心理、生理健康与生活质量,给病人及其家庭带来心理、生理负担和经济问题,其患病人数的增长将是当前和未来中国社会需要面对的一个重要问题。
AD 患者在组织病理学上具有老年斑、神经元纤维缠结、颗粒空泡变性和Hirano 小体形成等非特异性特征[3],与正常衰老机体相比,AD 患者脑中的淀粉样斑块和神经原纤维缠结异常大量地存在[4]。AD 致病机制复杂,受到遗传和非遗传因素影响,有β-淀粉样蛋白(β-amyloid,Aβ)假说、Tau 蛋白异常磷酸化假说、神经递质失调及神经元死亡假说和长期炎症损害假说等主流致病假说,表明AD 的成因并非由单一因素造成。基于神经递质失调假说,临床多采用多奈哌齐、他克林和卡巴拉汀等胆碱酯酶抑制剂改善AD 症状,虽然这些药物具有缓解AD 症状的作用,但这些药物均有作用靶点单一和副作用的缺点,不能用于日常预防[5]。AD 是一种退行性疾病,可逆性药物的研究也未见报道,病程进展取决于前期预防和早、中期的缓解治疗,近年来一些研究表明,饮食干预可能在预防阿尔茨海默病中发挥重要作用[6]。
茶叶作为传统的健康饮料植物,具有潜在的神经保护作用。流行病学研究发现饮用绿茶的次数与认知障碍患病率呈负相关[7];另一项日本老年人基线调查及后期的随访调查分析中也发现,饮用绿茶可能有助于降低认知衰退风险[8](表1)。在新加坡纵向老龄化研究中,一组华裔老年人数据分析则表明绿茶、红茶和乌龙茶的饮用量与认知衰退呈负相关[9](表1)。当前研究已经证实茶叶预防阿尔茨海默病的潜力主要来源自茶多酚、茶氨酸和咖啡碱这三类功能成分对β-淀粉样蛋白、神经元纤维缠结等病因的调节[10-15];此外,茶黄素、γ-氨基丁酸和茶皂素等物质也对AD的病因具有调节作用[16-18],表明茶叶不仅含有丰富的神经保护功能成分,并且具有多靶点预防阿尔茨海默病的作用。因此,本文归纳总结茶叶中的主要功能成分在预防阿尔茨海默病方面的研究进展,阐述茶叶功能成分对阿尔茨海默病的多靶点预防机制。
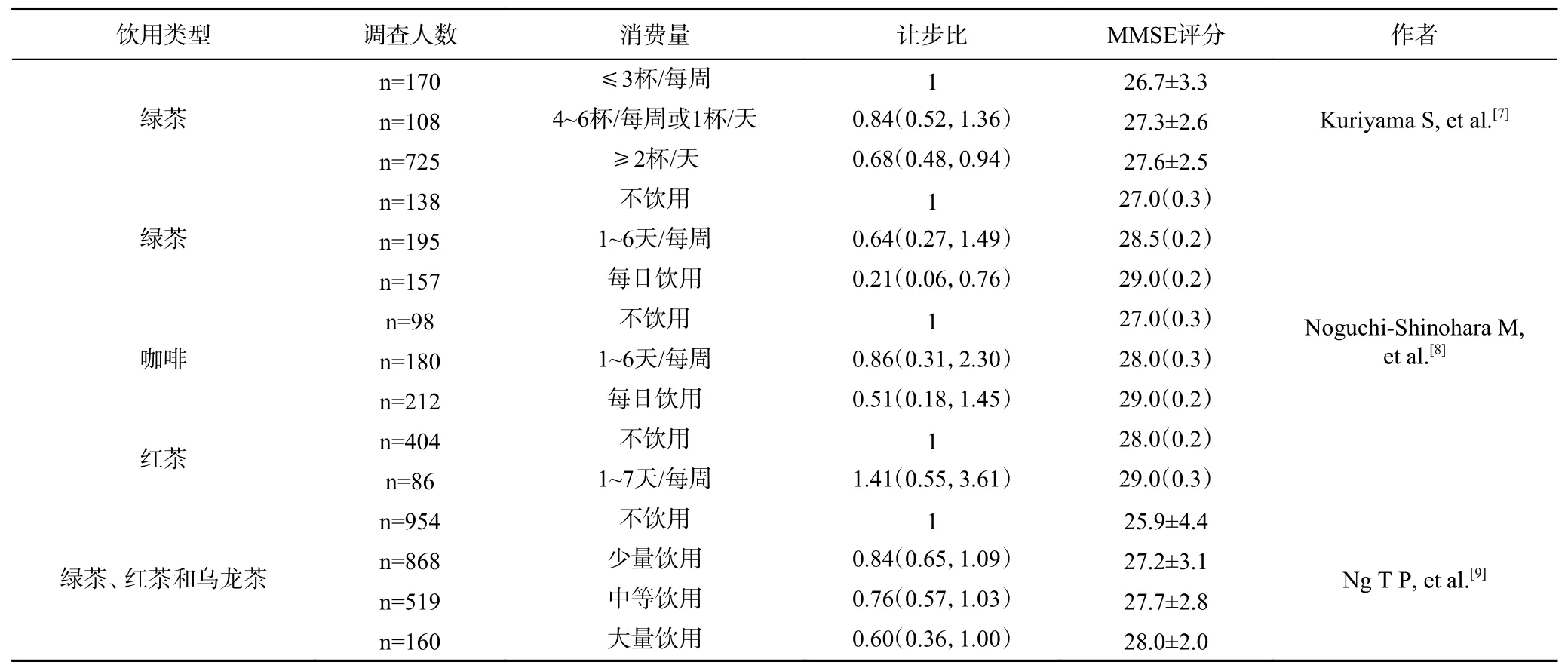
表1 饮茶与阿尔茨海默病患病风险的联系Table 1 The connection between drinking tea and Alzheimer disease
1 茶多酚与阿尔茨海默病
1.1 茶多酚抑制β-淀粉样蛋白的合成
Aβ在脑组织老年斑中大量沉积是AD 形成的分子标志之一[19]。Aβ的沉积也被当前医学界认为是AD 认知功能下降的主要诱因,它启动了一系列下游的神经毒性事件,包括氧化应激、炎症因子表达增强和Tau 的过度磷酸化等,最终导致神经元功能障碍和死亡[20-23]。茶多酚主要通过以儿茶素为主体的黄烷醇类物质影响Aβ的关键生成步骤来限制Aβ的产生(图1)。Aβ是由前体物质β-淀粉样前体蛋白(β-amyloid precursor protein,APP)水解生成,有两个水解通路,第一个是通过β-分泌酶(β-site of APP cleaving enzyme, BACE)切割水解形成分泌型淀粉样蛋白β(Secreted amyloid precursor proteinβ,sAPPβ)和β-C 末 端 片 段(β-C-terminal fragment,βCTF),再由γ-分泌酶切割水解βCTF 生成,其中切割APP 的β-分泌酶主要是BACE1[24-25]。Lee 等[10]研究表明,茶多酚中表没食子儿茶素没食子酸酯((-)-epigallocatechin-3-gallate,EGCG)能够剂量依赖性地降低AD 模型小鼠脑皮层及海马体中β、γ-分泌酶的活性从而降低Aβ水平,并检测到α-分泌酶的活性升高,其可能的机制调节方式为胞外调节激酶(Extracellular signal-regulated kinase,ERK)和核因子激活的B 细胞的κ-轻链增强(Nuclear factor kappa-B,NF-κB)途径。EGCG 对BACE 活性的调节途径也可能为过氧化物酶体增殖物激活受体-γ(Peroxisome proliferator-activated receptor-γ,PPARγ)途径[26]。一项体外试验则表明儿茶素对BACE1的抑制活性与儿茶素骨架C-2 没食子基和C-3 没食子酸酯部分有关[27]。此外,儿茶素能够通过降低AD 模型小鼠γ-分泌酶含量以及改变γ分泌酶组分这两种方式降低γ-分泌酶的活性[28]。
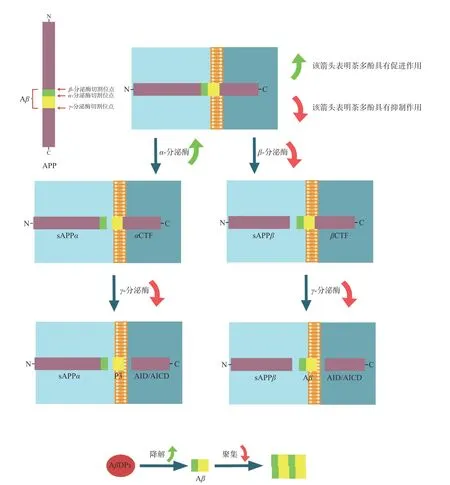
图1 茶多酚影响Aβ 合成、降解和聚集的机制图Fig.1 The mechanism of tea polyphenols affecting the synthesis, degradation and aggregation of Aβ
α-分泌酶是第二个APP 水解通路的关键酶,α-分泌酶能切割Aβ结构域的Lys687 和Leu688(Aβ的第16 和17 残基)之间的APP695 位点,水解生成分泌型淀粉样蛋白α(Secreted amyloid precursor proteinα, sAPPα)和α-C 末 端 片 段(α-C-terminal fragment,αCTF),αCTF 可以被γ-分泌酶切割,产生肽片段P3 和APP 胞内结构域(APP intracellular domain, AID/AICD),从而避免Aβ的生成并且sAPPα具有神经营养功能,能参与突触的可塑性[24-25,29]。研究发现EGCG 能增强α-分泌酶活性,显著增加可溶性sAPPα的释放,其主要介导途径为蛋白激酶C(Protein kinase C, PKC)[30]途径,PKC 作为信号转导主要介质,在介导Tau 蛋白磷酸化和α-突触核蛋白磷酸化方面也具有一定作用[31]。同样,除了增加可溶性sAPPα,EGCG 还能增加神经细胞黏附分子的表达来保护突触可塑性[32]。EGCG 对α-分泌酶活性的提高主要来自于增强其主要功能组分解聚素金属蛋白酶10(A disintegrin and metalloprotease 10,ADAM10)的表达[33]。没食子酸(Gallic acid, GA)同样也可以激活ADAM10,直接抑制BACE1 的活性,但是不影响ADAM10 或BACE1 的转录,并能缓解神经炎症,稳定AD 模型小鼠脑氧化应激[34]。
此外,EGCG 也能降低小鼠海马中APP 的表达从而对D-半乳糖诱导的AD 模型小鼠具有保护作用[35],而EGCG 对APP 蛋白水平的降低归因于对APP 翻译的抑制,而非转录[36]。综上所述,茶多酚在Aβ的上游生成方面具有重要的调节作用,一方面是作用于α、β和γ分泌酶这三类关键的Aβ生成限速酶来降低Aβ的表达水平,另一方面,对于Aβ合成前体物质APP,茶多酚也具有抑制表达的作用。
1.2 茶多酚促进β-淀粉样蛋白的降解
茶多酚能促进Aβ降解,但是在影响Aβ降解的机制方面,可能更为复杂。Aβ在体内降解的过程受到多种肽酶和蛋白酶的影响,它们统称为Aβ降解酶(Aβ-degrading proteases, AβDPs),虽然Aβ降解酶的种类和降解机制并未完全明确,但目前已有中性内肽酶(Neprilysin, NEP)、胰岛素降解酶(Insulin-degrading enzyme, IDE)和血管紧张素转换酶(Angiotensin-converting enzyme, ACE)等物质被发现具有Aβ降解酶的功能[37]。如前文所述,EGCG 能通过影响ERK 通路调节APP 的三类水解酶,同样,EGCG 也能影响星形胶质细胞中ERK 通路以及胞内磷脂酰肌醇激酶(Phosphatidylinositol-3-kinase, PI3K)/蛋白激酶B(Protein kinase B, Akt)介导的信号途径来促进NEP 的分泌,产生Aβ的降解的作用,细胞内另一Aβ降解酶IDE 的表达则不受影响;同时,该研究还发现儿茶素类物质如表儿茶素(Epicatechin, EC)、表没食子儿茶素(epigallocatechin, EGC)、表儿茶素没食子酸酯(Epicatechin gallate, ECG)并不影响星形胶质细胞中NEP 和IDE 表达[38]。但在EGCG 与脂肪肝小鼠胰岛素抵抗的研究中证明EGCG 具有上调IDE 蛋白表达和酶活性的作用[39]。这表明茶叶中EGCG 能对小鼠NEP 进行调节,对小鼠脑中IDE的表达活性调控则可能具有更复杂的机制。此外,绿茶提取物也能特异性诱导SK-N-SH 细胞的NEP 活性,ACE 的活性则没有发生明显变化[40]。与绿茶提取物研究不同,一项体外研究证明儿茶素具有抑制ACE 活性的作用[41];相较于正常人,AD 患者体内ACE 含量较高,该物质同时还与高血压有关[42],儿茶素或许能通过影响AD 患者体内复杂的代偿机制来降低ACE 的活性,保护AD 患者的神经系统与心血管健康。以上研究表明茶多酚对NEP 具有调节作用,对其他AβDPs 的影响机制则有待进一步探究,而茶多酚对AβDPs 的复杂调节作用则源于Aβ降解酶种类较多和AβDPs 参与其他生理机制的影响。
1.3 茶多酚抑制β-淀粉样蛋白的聚集
研究发现茶多酚具有抑制Aβ聚集和沉积的能力[43],主要是通过影响Aβ聚集的两个因素抑制Aβ的聚集和沉积,首先是破坏Aβ分子间的氢键、疏水键,其次是螯合金属离子,最终阻止Aβ聚形成β-片层结构的淀粉样纤维。Wang 等[44]结果表明氢键和疏水键都参与EGCG 与Aβ1-42之间的相互作用,且随着EGCG/Aβ1-42比率的增加,主要相互作用逐渐从氢键转移到疏水相互作用。除EGCG 能破坏氢键阻止Aβ构象变化外,EGC 也能通过插入Aβ疏水核心破坏Aβ纤维聚集,但EGCG 能力强于EGC,表明EGCG 的没食子酰基在破坏Aβ1-42原纤维中具有关键作用[45]。其他儿茶素如没食子儿茶素没食子酸酯(Gallocatechin gallate, GCG)、ECG 也能抑制Aβ生成β片层结构和降解Aβ寡聚物,但其作用弱于EGCG,其中EGCG 分子官能团抑制Aβ1-42聚集和结构重塑的能力排序为没食子酰基>没食子基>同分异构体[46]。以上试验表明EGCG 具有重要的抗Aβ聚集作用,但是在神经母细胞瘤细胞(SH-SY5Y)中则发现与EGCG 相比,儿茶素没食子酸酯(Catechin gallate, CG)和ECG 对SH-SY5Y 细胞抵抗Aβ聚集诱导的细胞毒性具有更强的保护作用[47],这或许是相较于体外试验,细胞中具有更复杂的分子机制所致。
茶多酚抑制Aβ的第二种主要方式是对金属离子进行螯合。金属离子是影响Aβ聚集的另一因素,Aβ作为一种金属蛋白,能通过组氨酸和亲水性氨基末端的酪氨酸残基与金属离子结合,促进β片层结构形成[48]。影响Aβ沉积的氧化还原金属主要是Fe2+、Cu2+和Zn2+,并且这三种金属离子在AD 患者大脑内大量积累[49]。EGC 和ECG 能结合Cu2+和Zn2+,并通过减少ROS 的产生来调节Cu2+、Zn2+和Aβ1-40对小鼠神经母细胞瘤Neuro-2a 细胞的神经毒性,表明EGC 和ECG 能通过螯和金属离子减轻Aβ低聚物和原纤维的毒性[50]。此外,Fe2+能通过调节APP 的翻译来控制APP 的活性水平[51],而Aβ具有金属螯和性,因此Aβ的沉积也是一种代偿性神经保护特性,能通过螯和Fe2+反馈调节APP 的生成[52]。EGCG则能通过铁螯和的方式,剂量依赖地逐渐抑制APP序列基因的翻译,降低APP 的生成[53],并达到与Aβ竞争的作用从而降低Aβ的聚集。在EGCG 结合金属离子后对Aβ结构的影响研究发现,结合Cu2+、Zn2+的Aβ中加入EGCG 能产生游离态Aβ聚集体,而未加入EGCG 的金属结合Aβ中则会产生结构性Aβ聚集体[54],表明EGCG 不仅能螯合游离态金属离子,也能对结合金属后的Aβ聚集进行影响。以上研究表明茶多酚能与Aβ竞争性结合金属离子,阻止Aβ聚集以及降低APP 的生成,并在Aβ结合金属离子后继续抑制Aβ聚集体结合,从而防止Aβ沉积产生神经毒性。
1.4 茶多酚抑制Tau 蛋白磷酸化与聚集
茶多酚对Tau 蛋白的过度磷酸化与聚集的抑制是另一种有效预防阿尔茨海默病机制。Tau 蛋白是一种参与微管形成与稳定的多功能蛋白。在AD 患者大脑中Tau 蛋白被过度磷酸化,这些过磷酸化Tau 寡聚组装成不溶性β-片层结构,再聚合成配对螺旋样(Paired helical filaments, PHFs)结构,最终形成神经原纤维缠结(Neurofibrillary tangles, NFTs)结构,影响神经细胞微管结构的形成与稳定,破坏突触和神经元功能[55-56]。同时,高磷酸化Tau 蛋白具有类似朊病毒传播的特征,诱导神经元和突触毒性[57]。动物试验表明茶多酚能改善冈田酸诱导的阿尔茨海默病大鼠的学习和记忆损伤并减少Tau 蛋白过度磷酸化[58]。同样,在使用SAMP8 小鼠的试验中,也观察到EGCG 可以减少Tau 蛋白过度磷酸化[11]。另一项动物研究表明口服EGCG 不仅可降低Aβ的沉积,并能与腹腔注射的给药方式一同调节小鼠磷酸化Tau 图谱,使EGCG 组呈现出与空白组相似的磷酸化Tau 图谱,从而改善小鼠的认知功能[43]。Lin 等[59]证明EGCG 处理可以通过减少c-Abl 激酶的核易位从而抑制糖原合成酶激酶3β(Glycogen synthase kinase-3β, GSK-3β)的活化,并通过该途径增强APP 的水解从而降低Aβ水平。GSK-3β具有促进Tau 蛋白磷酸化的功能,能与磷酸酶2A(Protein phosphatase-2A, PP-2A)一起对Tau 蛋白进行调节,后者则具有介导Tau 脱磷酸化的能力[60]。也有研究表明EGCG 降低GSK-3β的磷酸化水平方式之一为减弱小鼠的海马肿瘤坏死因子-α(Tumor necrosis factor, TNF-α)/c-Jun 氨基末端激酶(c-Jun N-terminal kinase, c-JNK)信号传导,并伴随海马胰岛素受体底物-1(Insulin receptor substrate-1, IRS-1)Ser636 位点磷酸化水平的减弱,从而减轻AD 患者神经中枢胰岛素抵抗[61]。此外,EGCG 还能改变Tau 的三维结构,并能与假定的磷酸化位点结合,竞争并减少激酶的进入[62]。以上试验证明茶多酚能降低Tau 蛋白磷酸化水平,其途径可能是:通过影响Tau 磷酸化关键蛋白GSK-3β降低Tau 蛋白磷酸化水平;结合并改变Tau 蛋白的结构,竞争性降低激酶磷酸化Tau 蛋白的效果。
茶多酚抑制磷酸化Tau 蛋白形成NFTs 也与神经自噬系统有关。细胞试验表明,EGCG 也能够通过增强两种关键的自噬衔接蛋白NDP52 和p62 的mRNA 表达来增加磷酸化Tau 蛋白的清除,EGCG对自噬诱导的标志物微管相关蛋白1 轻链3(Microtubule associated protein1 light chain 3,LC3)Ⅱ/LC3Ⅰ则没有影响[63]。但在另一项动物试验中则表明P62与自噬活性呈负相关,EGCG 组则降低了P62 的表达;该试验同时表明EGCG 能通过调节自噬功能相关的信号通路mTOR 提高ULK1、LC3Ⅱ/LC3Ⅰ表达,从而改善AD 导致的海马自噬系统障碍,并伴随Aβ沉积减少[64]。提示茶多酚调节神经自噬系统不仅能降解磷酸化Tau 纤维,或许也能加快自噬体对Aβ的吞噬。
与影响Aβ类似,茶多酚也具有抑制过磷酸化Tau 蛋白聚集的作用,一方面是通过与Tau 蛋白结合,抑制聚集;另一方面是降低Tau 蛋白的R3 结构域基因表达。在体外试验中,低浓度EGCG 能抑制片段Tau(His-K18ΔK280)形成β片层结构的有毒低聚物,从而减轻Tau 聚集的神经细胞毒性[65]。EGCG不仅能通过多位点与Tau 蛋白进行结合,抑制Tau蛋白聚集,也能分解和清除成熟的Tau 原纤维,从而干扰Tau 蛋白形成PHFs 结构;同时,在Tau/EGCG浓度为1/10 的情况下无法检测到Tau 的核磁共振信号,证明EGCG 对Tau 蛋白具有较强的结合力[66]。也有研究报道,儿茶素中GA 通过与R3 结构域结合实现抑制Tau 蛋白聚集的功能,而R3 结构与是Tau 聚合过程中产生的PHFs 的核心[67]。EGCG 也可以通过抑制双底物特异性酪氨酸磷酸化调节激酶A(Dual specificity tyrosine-phosphorylation-regulated kinase 1A, DYRK1A)方式来对Tau 外显子10(这是一个调节R3 结构域和R4 结构域的表达的基因)的选择性剪切进行调控,降低R3 结构域的表达水平[68]。
1.5 茶多酚抑制乙酰胆碱降解
AD 的病因之一是由于大脑胆碱能系统失调,乙酰胆碱(Acetylcholine, Ach)水平下降,导致信号传导能力下降[69]。ACh 作为一种神经递质,能特异性地作用于各类胆碱受体,其裂解酶主要是乙酰胆碱酯酶(Acetylcholinesterase, AChE)和丁酰胆碱酯酶(Butyrylcholinesterase, BuChE)[70]。研究表明茶多酚具有改善AD 患者胆碱能缺乏的潜力。Kim 等[71]用东莨菪碱诱导的小鼠模型验证了茶多酚对AChE具有抑制作用。Okello 等[72]从绿茶中分离了四种儿茶素EC、EGC、ECG 和EGCG,发现EGCG 是唯一对AChE(P<0.01)和BuChE(P<0.01)具有统计学意义的竞争性抑制作用的化合物,并测出IC50值分别为0.0148μmol/mL 和0.0251μmol/mL。与EC、EGC、ECG 相比,EGCG 所需的与AChE 和BChE 结合的能量最低,分别约为-14.45 和-13.30 kcal/mol[73]。以上研究表明,儿茶素对胆碱能的调控取决于EGCG的含量。
1.6 茶多酚抑制阿尔茨海默病中氧化应激和长期炎症
氧化应激(Oxidative stress, OS)是阿尔茨海默病不可或缺的病理现象。相较于正常人,AD 患者大脑更易产生大量的活性氧自由基(Reactive oxygen species, ROS),其主要来源之一为Aβ和过量金属离子导致氧化还原体系失衡,从而造成脂质、蛋白质过氧化,损伤神经元[21-22,74]。过量的ROS 不仅破坏大脑正常的生理代谢,其脂质过氧化产物如4-羟基壬烯醛(4-Hydroxynonenal, HNE)可显著提高BACE的水平[75],进一步提高Aβ的表达水平。茶多酚是经典的抗氧化性物质,除了具有金属螯合性以外,Shimmyo 等[76]的研究表明EGCG 可以剂量依赖性地减少Aβ诱导的BACE-1 和ROS 的水平,从而破坏Aβ和OS 之间的负循环,保护神经系统。此外,也有研究报道低浓度的EGCG 能通过海马神经元中的抗氧化反应元件(Antioxidant response element,ARE)/核因子E2 相关因子2(Nuclear factor erythroid 2-related factor 2, Nrf2)途径诱导血红素加氧酶-1 的活性,保护神经元免受不同氧化损伤模式的影响[77]。退化组织和高度不溶性异常物质的沉积是经典的炎症刺激物,同样,在AD 患者的大脑中,高度不可溶性的Aβ沉积、NFTs 和受损的神经元及神经突触为炎症提供了明显的刺激[23]。AD 患者的炎症发生伴随着胶质细胞的活化、炎症细胞因子释放和氧化应激,最终导致神经元变性和损伤,而胶质细胞的活化,炎症因子的释放和氧化应激也将进一步促进Aβ的生成与沉淀[78-79],表明AD 患者体内的炎症机制是高度的相互作用而非孤立发生。茶多酚具有明显的抗炎作用。在脂多糖和Aβ联合诱导的BV2 小胶质细胞炎症反应中发现EGCG 能通过调控半胱氨酸蛋白酶(Caspase-11)降低NLRP3 炎性小体表达,从而降低促炎因子白介素-1β(Interleukin-1β, IL-1β),IL-18 的转录、表达和分泌水平[80]。在另一项试验中,EGCG治疗不仅抑制脂多糖诱导的小鼠Aβ、APP 和BACE表达,还抑制星形胶质细胞活化、细胞因子升高和一些炎症蛋白如诱导型一氧化氮合酶和环氧合酶-2 的增加,同时,在体外培养的星形胶质细胞试验中表明EGCG 还能通过抑制神经炎相关细胞因子的释放来减少Aβ生成[81]。在APP/PS1 小鼠试验中进一步证明了EGCG 明显减轻了小胶质细胞活化水平,降低促炎因子IL-1β和增加抗炎因子IL-10、IL-13,并观察到Aβ斑块减少[82],说明茶多酚的抗炎作用主要表现在对炎症因子的调节方面。
1.7 茶多酚具有修复线粒体和抑制内质网应激的功能
线粒体功能障碍是发生在AD 患者脑内的另一生理状态,而线粒体功能障碍可能是AD 病理生理学级联反应的基本启动者[83]。有研究表明EGCG 具有线粒体修复能力,能使分离自海马、皮质和纹状体的线粒体呼吸频率、线粒体膜电位、ROS 产生和ATP 水平恢复50%到85%[84]。茶多酚和花青素的协同治疗能改善D-半乳糖诱导的大鼠神经细胞线粒体结构破坏,并调控线粒体凋亡途径相关蛋白B 淋巴细胞瘤-2(B-cell lymphoma-2, bcl-2)、bcl 相关蛋白(Bcl associated x protein, Bax)、动力相关蛋白1(Dynamin-related protein 1, DRP1)和视神经萎缩蛋白1(Optic atrophy 1, Opa1)的表达,从而修复神经元损伤,改善记忆[85]。AD 中神经元的死亡原因之一是Aβ沉积诱导的内质网应激,几乎所有的蛋白都在内质网中折叠修饰,应激则会导致蛋白未折叠或错误折叠[86]。而Du 等[87]通过体内外试验,发现EGCG能剂量依赖地降低内质网应激关键蛋白葡萄糖调节蛋 白78(Glucose regulated protein 78, GRP78)、C/EBP 环磷酸腺苷反应元件结合转录因子同源蛋白(C/EBP homologous protein, CHOP)、裂解的半胱氨酸蛋白酶12(Cleaved-caspase-12)和Cleaved-caspase-3的表达,并同时降低了衣霉素和毒胡萝卜素这两种内质网应激激活剂的细胞毒性,表明EGCG 具有抑制内质网异常超微结构肿胀的能力,保护了小鼠神经系统。
1.8 茶多酚的生物利用度开发
如前文所述,茶多酚将是预防阿尔茨海默病的有利候选物质之一,但考虑到人体肠道吸收和血脑屏障等固有的不稳定因素对其生物利用度和有效性的限制,目前对于提高茶多酚功效的开发分为三类:衍生物开发、纳米技术和协同作用。衍生物的开发有利于提高作用靶点精度,儿茶素衍生物具有改善小鼠神经母瘤细胞N2a 细胞的形态和抑制Tau 蛋白聚集的能力,其中,间苯三酚儿茶素效果高于表邻苯三酚儿茶素和邻苯三酚儿茶素[88]。在纳米技术方面,相较于游离EGCG,Cano 等[89]开发出双药负载的聚乙二醇化PLGA 纳米颗粒(EGCG/AA NPs)能在小鼠体内显示出更高的稳定性,降低Aβ活性并促进突触素增加。Smith 等[90]开发的纳米脂质EGCG 颗粒可将SweAPP N2a 细胞的α-分泌酶水平提高91%,效果是口服游离EGCG 的2 倍。杨鹏等[91]则将EGCG应用于纳米递释系统,开发出表面修饰RD2 肽的NP/EGCG(RD2-NP/EGCG),发现RD2-NP/EGCG能浓集于海马和大脑皮质,显著降低AD 模型小鼠脑中炎症因子TNF-α和IL-1β水平,修复神经元损伤,且无器官毒性。协同作用也将在增加茶多酚生物利用度方面发挥作用。除前文所提到的茶多酚与花青素外,EGCG 和阿魏酸的协同作用也增强了对小鼠大脑的Aβ水平、沉积和相关分泌酶的调节效果[92]。EGCG 与运动也能协同提高小鼠记忆能力,降低小鼠皮质层和海马中可溶性Aβ的水平[93]。EGCG 与鱼油的协同作用则表明,与单独使用EGCG 相比,鱼油能改善EGCG 的生物利用度[94]。
2 茶氨酸
2.1 茶氨酸对Aβ、Tau 和胆碱能系统的影响
茶氨酸是茶树中特有的氨基酸,具有神经保护功能,也能对Aβ、Tau 和胆碱能系统进行影响。阳衡[12]的研究中观察到茶氨酸能明显降低SAMP8 小鼠脑组织的Aβ1-42活性,减少皮层和海马Aβ1-42的斑块数量,并检测到茶氨酸能降低BACE1 的基因和蛋白的表达。L-茶氨酸可显著抑制小鼠Tau 蛋白Ser199,Ser202 和Ser396 位点的过度磷酸化,并通过降低GSK-3β的活性抑制Tau 的过度磷酸化和镉诱导的Tau 细胞毒性[13]。在东莨菪碱诱导的小鼠模型中发现,茶氨酸能够抑制AChE 的活性[95]。以上试验表明茶氨酸具有抑制Aβ表达和聚集、Tau 蛋白磷酸化以及调节胆碱能的能力,但与茶多酚相比,更为深入的机制则有待进一步研究。
2.2 茶氨酸抑制氧化应激水平和炎症损伤
在抑制氧化应激方面,Kim 等[96]研究发现L-茶氨酸不仅降低小鼠大脑Aβ的含量,还能抑制Aβ诱导的氧化应激所激活的ERK1/p38、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)和NK-kB 通路,减少蛋白和脂质氧化损伤,从而保护神经系统。活性氮(reactive nitrogen species, RNS)的产生也以类似ROS 的方式参与了氧化应激,一氧化氮(NO)在哺乳动物体内由一氧化氮合酶家族产生,能介导蛋白质转亚硝基化,损害突触和神经元[97]。而L-茶氨酸能在稳定表达的SH-SY5Y 细胞中显著抑制L-谷氨酸诱导的N-甲基-D-天冬氨酸受体活化、c-Jun N 末端激酶和caspase-3 的活化,并减少NO 的产生,这是由于L-茶氨酸降低诱导型一氧化氮合酶和神经元一氧化氮合酶的蛋白水平所致[98]。在木犀草素和茶氨酸的研究中发现两者协同能更好地改善海马体胰岛素抵抗、促进GSK-3β磷酸化和降低Tau 蛋白磷酸化水平,而在炎症因子的调节方面,茶氨酸单独使用更能降低炎症相关因子TNF-α和IL-1β的表达,从而改善记忆功能[99]。
2.3 茶氨酸改善多巴胺功能障碍与线粒体损伤
其他不同程度的多巴胺功能障碍也可能发生在阿尔茨海默病的各个阶段[100]。而L-茶氨酸可促进海马突触传递并减少双脉冲易化,这些作用能被N-甲基-D-天冬氨酸受体和多巴胺D1/5 受体的拮抗剂以及选择性蛋白激酶A(Protein kinase A,PKA)抑制剂阻断,表明L-茶氨酸能通过多巴胺激活D1/5 受体-PKA 途径,改善AD 小鼠的记忆力和海马长时间增强作用(Long-term potentiont, LTP)损伤[101]。此外,L-茶氨酸能显著调控Aβ的积累导致的线粒体融合蛋白1(Mitofusion-1, Mfn1)和Mfn2 异常表达[102],证明茶氨酸具有改善多巴胺功能障碍和保护线粒体的功能。
3 咖啡碱
3.1 咖啡碱抑制Aβ 的合成与聚集
茶叶生物碱包括咖啡碱、可可碱和茶碱。其中,咖啡碱作为一种腺苷A2A 受体拮抗剂,能够预防Aβ引起的记忆功能障碍[103],并且在APPswe 小鼠试验中能剂量依赖性地降低海马中Aβ1-42、早老蛋白-1(Presenilin-1, PS1)和BACE1 的水平,从而保护大脑认知功能[14]。一项绿茶提取物的研究表明,茶叶生物碱、儿茶素和茶氨酸均能增强细胞NEP 活性,其中相较于可可碱、茶碱和茶氨酸,咖啡碱更能增强AβDPs 中NEP 活性,其机制可能与生物碱提高细胞内环磷酸腺苷水平有关[104],而环磷酸腺苷水平的升高具有延缓阿尔茨海默病进展的治疗潜力[105]。在分子动力学模拟试验中,咖啡碱能够破坏Aβ聚集形成的β片层结构[106]。Du 等[107]研究中观察到紫鹃普洱茶提取物中咖啡碱、儿茶素和前花青素能不同程度延缓线虫麻痹,Aβ的聚集会导致线虫麻痹,进一步佐证了咖啡碱具有抑制Aβ聚集的作用。
3.2 咖啡碱降低Tau 蛋白磷酸化、调节氧化应激与炎症损伤
一些体内试验表明咖啡碱能够降低GSK-3β的磷酸化[15],但在一项咖啡碱抑制Tau 蛋白磷酸化的综合性研究表明,长期摄入咖啡碱能够降低小鼠海马Tau 蛋白的磷酸化与水解,其机制可能与咖啡碱提高磷酸酶PP-2A 及其受体腺苷A2A 受体的活性有关,而与GSK-3β无关;此外,该研究的结果还表明咖啡碱能够降低相关的炎性趋化因子(CCl4、CCl5和TNF-α)及一些氧化应激相关蛋白(Nrf2,Mn-SOD和兴奋性氨基酸转运体)的表达[108]。综上,咖啡碱能降低Tau 蛋白磷酸化,并对机体氧化应激、炎症损伤进行调节,保护神经系统。
3.3 咖啡碱与胆碱能系统
咖啡因具有促进乙酰胆碱释放的功能[109]。在胆碱酯酶的影响方面,咖啡碱能直接与胆碱酯酶抑制剂非竞争性的结合AChE 和BuChE,抑制乙酰胆碱的降解,但相对于AChE,咖啡碱抑制BuChE 的作用非常弱,这可能是由于与BuChE 相比,咖啡碱更易与AChE 的Trp86 位点作用,并可以被Tyr337 稳定[110]。此外,对于乙酰胆碱受体(acetylcholinereceptors,AChR),咖啡碱具有低浓度活化AChR 和高浓度阻滞AChR 离子通道的双重作用[111]。
4 其他物质
除了茶多酚、茶氨酸、咖啡碱和花青素外,γ-氨基丁酸(γ-aminobutyric acid, GABA)、茶黄素、茶山奈苷B 和茶皂素等茶中所含物质也能对AD 病因进行干预,保护神经系统。
茶叶因加工工艺的不同,导致成品茶叶功能成分有一定区别,在用金观音茶树品种制成的白茶、绿茶、乌龙茶和红茶对Aβ处理的PC12 细胞进行试验,发现不同类型茶叶对Aβ聚集体的形成均有抑制作用,其中,白茶的EGCG 和ECG 明显低于绿茶,但白茶中γ-氨基丁酸(γ-aminobutyric acid, GABA)和谷氨酰胺的水平远远高于其他茶类[16]。GABA作为一种神经递质,研究表明AD 患者大脑中GABA的含量基本呈减少趋势[112],而茶叶中所含的GABA能对AD 患者的神经递质缺乏具有补充作用。
目前研究中茶黄素、茶山奈苷B 和茶皂素的研究以抑制Aβ的沉积和调节乙酰胆碱水平为主。茶黄素并非茶鲜叶次生代谢物,是红茶加工中茶多酚的氧化产物。研究表明茶黄素能有效下调小鼠大脑中β、γ-分泌酶的活性,升高ADAM10 蛋白表达水平从而提高α-分泌酶活性,以及提高Aβ降解酶NEP 和IDE 的活性水平,最终减少Aβ的产生和低聚沉积[17]。茯砖茶中发现一种新型的多功能化合物,名为茶山奈苷B,不仅能降低β-分泌酶活性,且能与Aβ1-42低聚物结合并阻断Aβ向β折叠的构象转变[113]。近期也有研究报道茶树种子中茶皂素E1 能通过调节β-、γ-和α-分泌酶以及激活NEP 和IDE 活性降低Aβ的浓度,还具有抑制乙酰胆碱酯酶活性的双重作用[18]。除以上单体物质,一项研究表明绿茶能通过抑制APP 裂解、激活胶质细胞和抑制炎症反应,以及减少突触丢失来保护神经系统[114]。茶树种子、种皮和茶籽油也被报道具有胆碱酯酶抑制活性,这与种子、种皮也检出具有咖啡碱,没食子酸和其他酚类等物质有关[115-116]。另外,绿茶香气提取物也被报道能延缓Aβ聚集诱导的线虫麻痹[117]。
5 总结与展望
阿尔茨海默病是并非由单一机制导致的年龄依赖性疾病,致病因素复杂且相互联系、相互促进,涉及多种细胞、物质和分子机制。例如Aβ沉积和磷酸化Tau 蛋白之间相互促进,其间又导致胆碱能损伤、氧化应激、炎症损伤、内质网线粒体功能受损等,而这些下游病因又反馈调节促进Aβ沉积和NFTs 的生成,加重AD 病程。茶叶功能成分来源于茶树次生代谢产物和加工转化产物,能对AD 进行干预,是十分有潜力的AD 预防性植物,综上,其总体作用主要有以下几个方面(图2):降低Aβ的生成水平,主要是通过降低APP 生成、调节α、β和γ分泌酶三类关键酶和AβDPs 来降低Aβ活性水平;抑制Aβ的沉积,一方面具有直接破坏Aβ氢键和疏水键的能力,另一方面能螯合金属离子来抑制Aβ低聚;通过影响Tau 的激酶和磷酸酶从而干扰Tau 磷酸化,直接与磷酸化Tau 进行结合、间接影响相关蛋白从而改变Tau 蛋白结构抑制聚集;结合胆碱酯酶从而降低乙酰胆碱的降解;抵抗氧化应激和炎症;调节多巴胺功能和修复线粒体障碍等,表明茶叶功能成分能关键性地对AD 多种病因进行影响与调节,多靶点综合保护大脑神经系统,从而预防阿尔茨海默病。
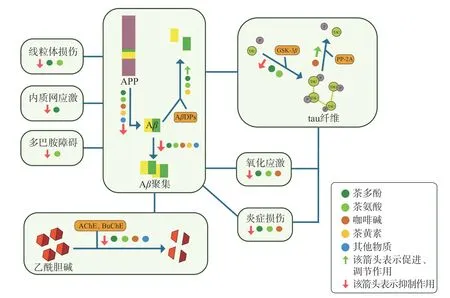
图2 茶叶功能成分调控AD 关键病因机制图Fig.2 Schematic diagram of the tea functional ingredients regulating key pathogenic factor of AD
在调节AD 病因方面,茶叶功能成分多目前多集中于抑制Aβ聚集沉积,其次是NFTs 和神经递质调节。茶叶功能成分与一些AD 相关的次级反应和物质之间的影响也值得研究。最近有试验表明,Aβ能否诱导炎症或许是AD 病情发展中的关键因素之一[120],而茶多酚,茶氨酸和咖啡碱拥有抗炎作用。虽无茶黄素、茶皂素等物质直接抑制Aβ或Tau蛋白等因素导致的神经炎症试验证据,但茶黄素、茶皂素同样具有抵抗炎症的潜力[121-122]。除炎症反应以外,氧化应激、胰岛素抵抗、环磷酸腺苷水平等因素同样促进AD 发展。随着AD 本身研究的深入,研究茶叶功能成分与这些下游因素的关系有利于更深入探明茶叶对AD 的多靶点保护机制。在茶叶功能成分方面,当前研究多集中于茶多酚中的EGCG,其他功能成分与这些关键上下游病因之间则研究不足,需要更多的试验研究。此外,参考当前茶多酚的功能开发,其他单体茶叶功能成分在进一步发掘和探明其对AD 的机制后,也可用于分子衍生技术、纳米技术和协同作用研究。其中,分子衍生和纳米技术将是精确茶叶功能成分作用靶点,提高茶叶功能成分生物利用度的解决方案之一。除茶叶功能成分单体之间协同作用外,研究茶叶及其功能成分和其他物质、行为的协同作用也将进一步证明日常饮茶具有AD预防效果,拓展茶的应用范围。
综上所述,茶叶功能成分丰富,来源于茶树自身次生代谢产物和茶叶加工转化产物,具有预防阿尔茨海默病的潜力,能综合影响AD 关键的病因。AD 又是一种慢性退行性疾病,茶作为一种健康饮品,日常饮用有助于预防阿尔茨海默病,结合当前纳米技术以及阿尔茨海默病研究的深入,茶将具有广阔的应用前景。

