食品中脂肪氧化产生的活泼羰基化合物研究进展
刘 楠,崔柯鑫,2,孙 永,王珊珊,杨 敏,孙国辉,王明丽,王大军,周德庆,
(1.中国水产科学研究院,黄海水产研究所/青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室,山东青岛 266071;2.中国海洋大学,食品科学与工程学院,山东青岛 266005;3.蓬莱汇洋食品有限公司,山东烟台 265609;4.烟台海裕食品有限公司,山东烟台 264000)
活泼羰基化合物(Reactive carbonyl compounds,RCCs)主要由脂类和糖类的非酶氧化反应产生。脂类氧化分解产生的RCCs 从化学角度主要可以被分为三大类:a.α,β-不饱和醛,如4-羟基-反式-2-壬烯醛(HNE)、4-羟基己烯醛(HHE)和壬烯醛和丙烯醛(ACR);b. 酮醛,如丙酮醛(MGO)、4-氧代-壬烯醛(ONE)和异酮类化合物(LGD2);c. 二醛,如乙二醛(GO)和丙二醛(MDA)[1](结构见图1)。RCCs 对蛋白质的氧化修饰已被证明可以在多种疾病中诱导抗体,包括系统性红斑狼疮、酒精性肝病、糖尿病和类风湿性关节炎等[2-3]。当RCCs 由糖形成时,与蛋白质形成的加合物被命名为糖基化终产物(Advanced glycation end products,AGEs),而当RCCs 由脂质形成时,加合物则被命名为晚期脂类氧化终产物ALEs(Advanced lipoxidation end products)[4]。脂质过氧化产物的主要作用是抑制DNA 的合成及细胞分裂和肿瘤生长,诱导细胞凋亡[5]。近几年,RCCs 中的ACR、MDA、HNE、HHE 等活泼的醛类物质已被作为氧化应激损伤、疾病进程的重要生物标志物[6-7]。
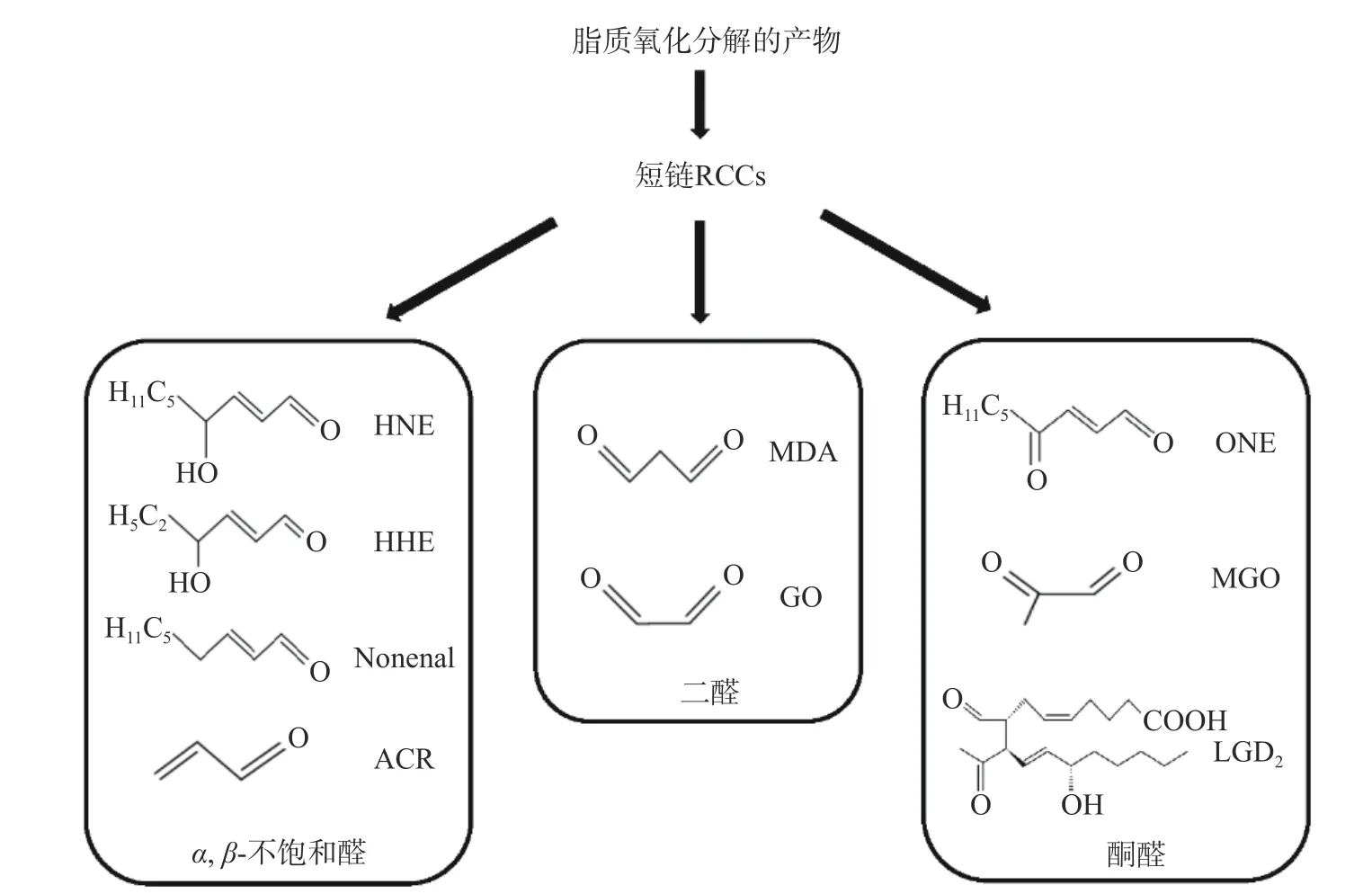
图1 脂类氧化分解产生的最活跃羰基化合物种类Fig.1 The most active carbonyl compounds produced by the oxidation and decomposition of lipids
1 与RCCs 有关的主要生化反应
RCCs 中细胞毒性较强的HHE、HNE 等α,β-不饱和醛主要由脂质过氧化产生,ω-6 PUFA(18:2,20:4)脂质过氧化的产物主要是HNE 和己醛,ω-3 PUFA(22:6)的产物则是HHE 和丙醛,有3 个及以上亚甲基中断双键(20:4,22:6)的PUFA 会生成MDA[8-9]。生成的RCCs 会与一些氨基酸发生反应也会发生羰基化,修饰后形成蛋白质羰基,从而导致蛋白质功能障碍,引起“羰基应激”,进而引发一系列炎症反应或加快疾病进程。
1.1 RCCs 的产生与脂肪氧化的关系
当食物中含有大量多不饱和脂肪酸、光、热、金属离子和自由基等促氧化剂存在时,则会引发脂肪氧化,在鱼类中会引起鱼体肌肉酸败,产生不愉快的气味及有害物质[10-11]。促使脂肪自氧化过程的自由基可由光、高能辐射等因子诱导产生,也可由其他自由基诱导产生,自由基反应的最大特点是倾向于进行链式反应。
脂质过氧化的启动可以由活性物种(Reactive species,RS)的添加引起,或者更常见的是由RS 从亚甲基(-CH2-)基团中提取氢原子引起的;在这两种情况下,都会产生碳自由基[12]。例如,羟基·OH 可以通过H·抽提进行反应,如图2 的引发阶段。过氧化氢自由基HOO·可以从PUFA 中提取H·,在有氧条件下,碳自由基很容易与O2结合,生成过氧基,过氧基还可以从相邻的脂肪酸侧链中提取H。如图2 的传递阶段,这是脂质过氧化的传播期。它形成新的碳自由基,可以与O2反应形成新的过氧化物自由基,因此脂质过氧化的连锁反应继续进行(图2)。ROO 与其提取的H·结合,形成脂质过氧化氢(ROOH)。因此,单个的引发有可能通过连锁反应产生多个过氧化物分子。
ROOH 在高温或金属存在下会发生水解或热裂,容易分解为低分子量的次生产物,产生许多挥发物和非挥发物,挥发物如醛、短链碳氢化合物、醇、酯、酸和酮[13],这时就会形成如MDA、HNE 等一些有害的RCCs,过氧化总过程如图3。
1.2 RCCs 与蛋白质的进一步氧化
蛋白质中没有天然存在的羰基,主要由氧化机制生成[14]。羰基通过各种氧化途径引入蛋白质。蛋白质可以通过许多不同的方式进行氧化修饰,一是通过氨基酸侧链和蛋白质骨架的直接氧化;二是通过与PUFA 和碳水化合物的氧化产物结合而发生间接氧化[15]。活性氧(ROS)可以直接与蛋白质反应,也可以与糖和脂质等分子反应,生成RCCs 后与蛋白质反应[16]。如RCCs 中的HNE 能够通过与大量靶点的Michael 加成形成蛋白质加合物。HNE 优先与含硫醇蛋白的半胱氨酸残基形成加合物,其中一些是参与氧化还原信号的蛋白质[17],如图4。在大多数情况下,蛋白质的功能会因HNE 加合物的形成而受损。HNE 在蛋白质中形成具有三个不同侧链的加合物,即半胱氨酸(Cys)、组氨酸(His)和赖氨酸(Lys)[12]。在合成的多氨基酸模型化合物中,研究了这些氨基酸(AA)残基与HNE 形成加合物的反应活性。结果表明,半胱氨酸残基的活性最高,HNE/AA 摩尔比的大小顺序为:Cys>His>Lys。对ONE 也得到了类似的结果,Arg 是ONE 的目标,但一般不是HNE 的目标[18]。
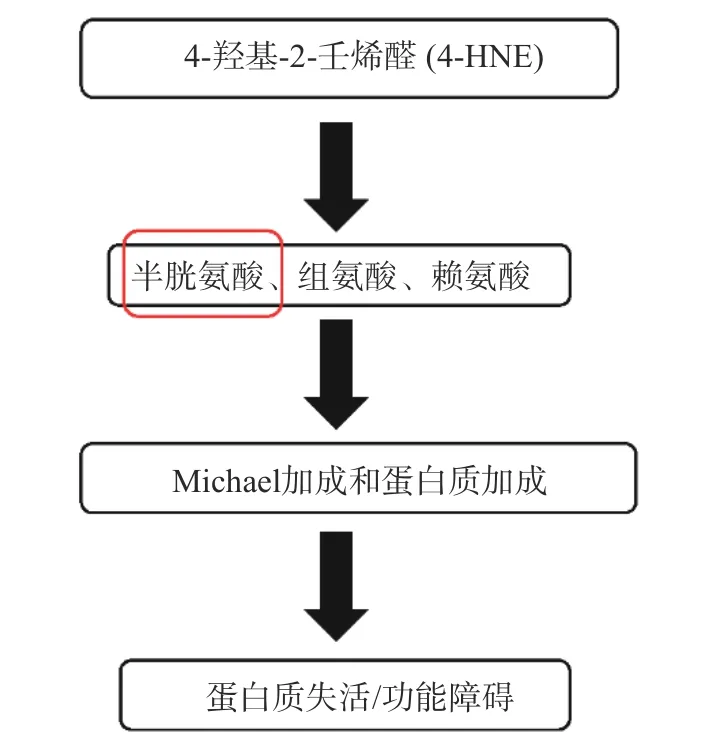
图4 RCCs 与AA 的反应Fig.4 Reaction of active carbonyl compounds with amino acids
在活性氧(ROS)存在时,自由基与蛋白质的反应会引起蛋白质骨架和氨基酸侧链的变化。这些变化包括肽键的断裂、氨基酸侧链的修饰和共价分子间交联蛋白衍生物的形成。其中最常见的氨基酸修饰是形成蛋白质羰基和蛋白质氢过氧化物[19]。通常把蛋白质羰基化定义为一种不可逆的翻译后修饰(PTM),会在蛋白质中产生活泼的羰基部分,如醛、酮等[20],蛋白质羰基通常被用作衰老和疾病中蛋白质氧化的指示物[21]。一般来说,蛋白质羰基化的途径可以分为直接氧化、金属催化氧化与游离糖的反应以及脂质过氧化产物[10]。通过金属催化裂解的蛋白质氧化是鱼体内系统中氧化损伤的主要原因,也是鱼死后肌肉中氧化损伤的主要原因[15]。
2 RCCs 的检测
来源于脂类过氧化的RCCs 中主要的标志性物质是HHE、HNE 和MDA。其中,MDA 是国标中对食品已经有所要求的重要检测指标,而国标中暂时还没有与HHE 和HNE 相关的检测和限量标准。RCCs的检测是一个复杂的过程,由于其化学结构的特殊性需要先衍生化,然后再检测。
2.1 衍生化与纯化
由于RCCs 具有较强的极性在色谱柱中没有保留,且生物反应活性强,稳定性较差,无紫外或荧光吸收的官能团,因此提取前需先采用衍生化。目前常用的衍生化试剂有2,4-二硝基苯肼(DNPH)[22]、O-2,3,4,5,6-(五氟苄基)羟胺(PFBHA)[23]、双(三甲基硅烷基)三氟乙酰胺(BSTFA)[24]和1-(4-肼基-4-氧代丁基)吡啶-1-溴化物(HPB)[25]等。其中,2,4-二硝基苯肼(DNPH)最为常用,在酸性条件下可将RCCs 衍生成为一种稳定可测的物质—2,4-二硝基苯腙,具有紫外吸收[25-27]。
食品体系较为复杂,为了减少各种杂质对羰基化合物分析的影响,分析前需要对样品进行纯化处理,最常用的方法是固相微萃取(SPME)[28]。SPME是集取样、萃取、预浓缩于一体的绿色无溶剂萃取技术,是一种便捷、低成本、通用、易于自动化的样品高通量检测方法,常用作对于挥发性有机物质的分析,并有良好的重现性[29-31]。
2.2 检测方法
针对食品中的MDA 以及有机化学试剂中的羰基化合物总量国标规定了检测方法,而针对于HHE、HNE 这两种物质的检测主要是利用先色谱法分离后与质谱法结合来进行检测。
2.2.1 国标中羰基化合物总量的测定 国标对于有机化学试剂中微量羰基化合物总量的测定是利用2,4-二硝基苯肼将羰基转化成2,4-二硝基苯腙并用比色法进行测定,反应式如图5。由于比色法存在一定的误差,也没有明确具体的提取方法,且不能提供羰基化合物的特定种类信息,因此存在一定的局限性。
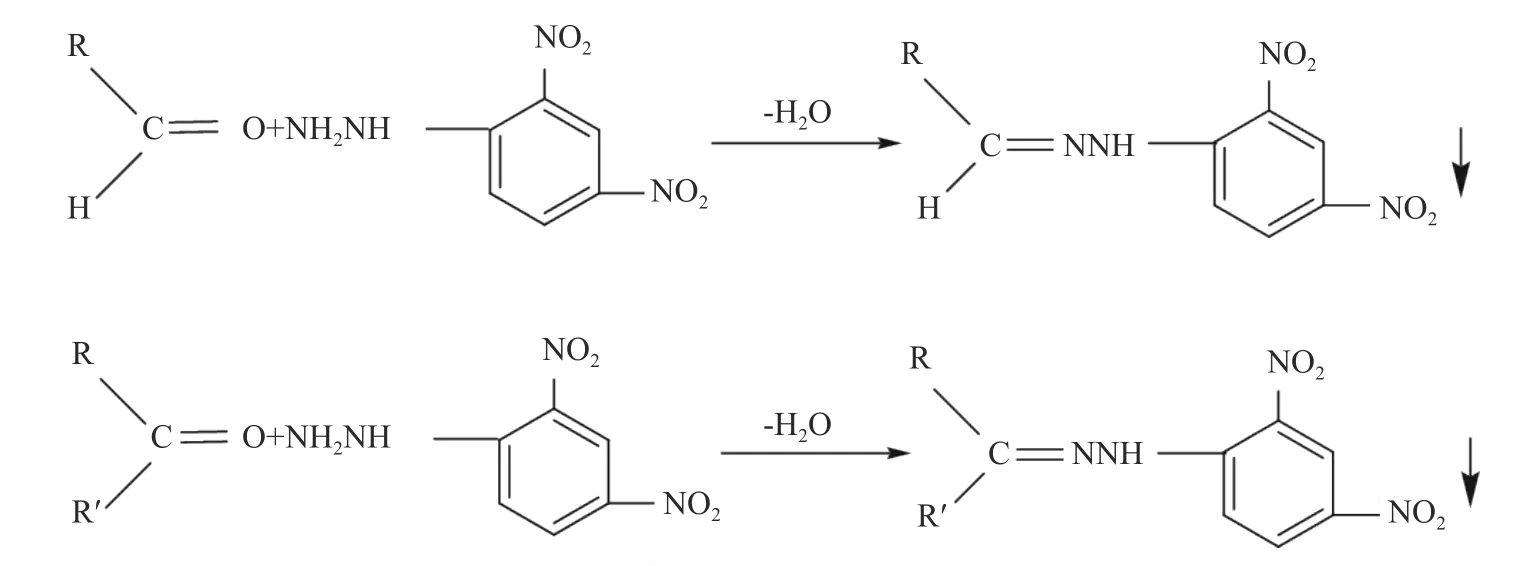
图5 羰基化合物与2,4-二硝基苯肼的反应Fig.5 Reaction of carbonyl compounds with DNPH
2.2.2 MDA 的测定 国标中规定了食品中MDA 的两种测定方法:第一种为高效液相色谱法:试样先用酸液提取,再将提取液与硫代巴比妥酸(TBA)作用生成有色化合物,采用高效液相色谱二极管阵列检测器测定,外标法定量;第二种为分光光度法:MDA 经三氯乙酸溶液提取后,与硫代巴比妥酸(TBA)作用生成粉红色化合物,测定其在532 nm 波长处的吸光度值,与标准系列比较定量。
2.2.3 HHE 和HNE 的检测方法 国内外科研工作者对HHE、HNE 的检测进行了较多的研究。一般采用气相色谱法(GC)、气相色谱质谱联用(GC-MC)、高效液相色谱法(HPLC)或液相色谱质谱联用(LCMS)进行检测。
2.2.3.1 LC-MS 用酶系统形成的脂质过氧化产物的分析一般使用带有紫外检测的HPLC。高效液相色谱法操作简单,定量准确,在HHE 和HNE 的检测中应用较为广泛。Uchida 等[27]用SPME 纤维从样品溶液中提取HNE 或HNE 与DNPH 反应生成的衍生物,用HPLC 测定HNE 的含量[32]。Johnston 等[33]用1-甲基-2-苯基吲哚比色法检测植物中的MDA和HNE,这项研究表明,1-甲基-2-苯基吲哚比色法对植物组织中的MDA 和HNE 不是特异的,特别是对于含有高浓度单糖的样品,HPLC 被推荐为测量植物组织中MDA 和HNE 最可靠的方法。但由于食品体系的复杂性,单纯利用保留时间定性准确度不高,对于较准确的测定需要利用液相色谱分离后与质谱联合来分析[28]。Douny 等[26]用DNPH 衍生后,建立了LC-MS 的分析方法测定植物油样中的MDA、HNE、HHE 和2,4-癸二烯(2,4-DECA),验证表明可以在同一次运行中分析油样中的MDA、HHE、HNE 和2,4-DECA,对MDA 有很好的准确度,对其他3 种醛在指定浓度下有一定的准确度。
2.2.3.2 GC-MS GC-MS 能够比较准确地对羰基化合物进行定性定量分析,允许在多种情况下指定结构。Surh 等[34]采用选择性离子监测GC-MS 测定了56 种市售PUFA 强化食品中HHE 和HNE 的含量。Pstergiadis 等[23]建立了高效、安全的GC-MS 检测方法,适用于食品中HHE 和HNE 的检测。付湘晋等[35]以五氟苯肼为衍生化试剂,采用固相微萃取-气相/质谱法(SPME-GC/MS)检测鱼糜中的RCCs 包括MDA、HHE、HNE。然而,高分子量和极性化合物的鉴定困难以及分子离子的缺失限制了GC-MS的应用,且分析时间较长,对于同时检测多种羰基化合物并不适用[28,32]。
2.2.3.3 试剂盒快速检测 市场上检测鱼组织中4-HHE 和4-HNE 的试剂盒的出现满足了人们对HHE和HNE 检测的需求。该方法采用双抗体夹心法测定标本中4-HNE 或4-HHE 的含量。该方法的原理为将4-HNE 或4-HHE 抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入经过匀浆离心后的鱼组织上清液标本,再与HRP 标记的4-HNE 或4-HHE 抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。TMB 在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中4-HNE 或4-HHE 的含量具有正相关关系。用酶标仪在450 nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中鱼组织中的4-HNE 或4-HHE 浓度。试剂盒与传统的检测方法相比,检测速度更快,操作更简便,在应对突发事件时,试剂盒这种快速检测技术高效性的优势得到充分体现。然而试剂盒的弊端也很明显,其检测范围在2~65 ng·L-1之间,对于含量过高或过低以及需要准确定量分析的样品,还是要利用液相分离与质谱检测相结合的方法进行准确地分析测定。
综上,国标中虽然规定了羰基化合物总量的测定方法,但该方式适用于有机溶剂,不合适化学成分复杂的食品。国标中只规定了食品中活泼羰基化合物MDA 的检测方法,其他的活泼羰基化合物如HHE 和HNE 并未有相关的规定,虽然进行了一些检测方法的研究,但是其准确性和通用性还有待提高。
3 与RCCs 有关的饮食暴露量研究
RCCs 中的醛类衍生物是在脂肪、油和糖的烹调过程中产生的,因此食品是人体RCCs 暴露的重要途径。根据RCCs 的暴露量的研究判断其毒性更为科学可靠。仅根据饮食消耗,估计人体每天的α,β不饱和醛耐受剂量为5 mg·kg-1bw[36]。2006 年WHO的一个工作组通过小鼠实验确定了丙烯醛的容许口服摄入量为7.5 μg·kg-1bw·d-1,但由于分析困难和缺乏可靠的含量测量,无法评估通过食物接触的丙烯醛[37]。
因此,活泼羰基化合物饮食暴露量的调查研究就更为重要,但目前的研究较为有限。2005 年在韩国的一项研究显示,根据2001 年韩国膳食摄入量调查资料,韩国人每天接触4-羟基-2-烯烃(不包括油炸食品)为4.3 μg·d-1,由1.6 μg HHE 和2.7 μg HNE 组成。据计算,韩国人每天可额外接触油炸食品中的4-羟基-2-烯烃11.8 μg 以上。韩国人摄入植物油、鱼、贝类和一些油炸食品中的4-羟基-2-烯烃的综合暴露量为16.1 μg·d-1,相当于60 kg 韩国成年人0.3 μg·kg-1bw·d-1,这种情况下可能不会对人体健康造成风险[13]。对于普遍喜食油炸食品或干腌制水产品的居民而言,RCCs 摄入极易超标,会造成一定的食品安全风险。尽管有研究报告了4-羟基-2-烯烃的毒性,但还没有足够的数据表明RCCs 的实际安全剂量,因此有待进一步研究。
2014 年在比利时的一项研究中,对含有HHE、HNE、MDA 的16 种食品类别进行了分析,结合从比利时人口的国家代表性样本中获得的消费数据,进行了定量暴露评估:84%的分析样品MDA 超标,63%的样品检测到HNE 和16%的HHE,HHE 和HNE的检测率分别为63%和16%。食用干坚果、油炸零食、薯条和腌制肉末产品对MDA 和HNE 的摄入量贡献最大。食用腌制和切碎的生肉产品的人中有一小部分人(3.8%),他们可能处于潜在的风险中。但由于没有可靠的MDA、HNE 和HHE 的毒理学数据,研究者认为应该采取预防措施,防止食品在加工和储存过程中的脂质氧化[38]。
4 羰基化合物的消减与抑制
食品中RCCs 的产生与很多因素相关,比如储藏过程中温度的变化、样品中盐含量、加工方式等,其中,添加抗氧化剂是最有效的控制RCCs 产生与累积的手段[1,35,39]。抗氧化剂是通过清除自由基、氧化前螯合金属、淬灭单线态氧和光敏剂以及灭活脂氧合酶来减缓食物的氧化速率,从而抑制脂肪氧化。酚类化合物、抗坏血酸、氨基酸和其他的一些天然提取物作为重要的天然抗氧化剂被广泛地食用[1,39-43]。抗氧化剂可以与RCCs 直接反应,阻断蛋白质-RCCs的反应,从而起到保护蛋白质的作用。
天然多酚具有较强的延缓脂质过氧化的抗氧化活性,具有清除自由基能力与抑制脂质过氧化诱导的BSA 修饰之间的相关性,可在一定程度上阻断对蛋白质羰基化的不利影响[41]。刘焱等[42]研究发现茶多酚能够通过抑制巯基含量的减少来抑制鱼油氧化而导致的蛋白质变性。苗苗[43]研究发现茶多酚可以降低鱼糜中的POV 值,表明茶多酚可以有效减缓氢过氧化物的积累,但是并未完全抑制其生成;同时研究还发现,贮藏后期鱼糜的TBARS 值也有一定程度的降低。孙涛等[44]研究发现槲皮素和葛根素能促进非酶糖基化早期产物果糖胺和5-HMF 的生成,对反应中期的羰基化合物具有较强的抑制作用。因此有理由认为,酚类化合物清除RCCs 的替代机制可能共同作用于控制蛋白质、脂质过氧化以及一些相关的人类疾病。
维生素C 在体外可以与HNE 形成迈克尔型结合物。反应为抗坏血酸的活化C-H 基团在HNE 的C=C 双键上的Michael 加成,然后环化生成半缩醛[32]。但抗坏血酸性质不稳定,加工过程中的光照高温等因素会使其发生分解,从而变质失效。
抗氧化活性肽与氨基酸也可以与RCCs 反应生成各种加合产物,如Schiffe 碱和Michael 加合产物等,显著降低RCCs 的含量,其中,L-半胱氨酸(Cys)应用较多,效果较好[45-46]。
另外,把各种天然抗氧化剂按一定比例进行复配,研究新型复合抗氧化剂也是近年来抗氧化领域研究的热潮。已有研究发现,相对于单一的抗氧化剂,复合抗氧化剂的抗氧化效果更好[47]。孙逸雯等[48]研究了维生素E 和迷迭香提取物复合的天然抗氧化剂对亚麻籽油氧化稳定性的影响,结果表明复合天然抗氧化剂可有效延缓亚麻籽油的氧化酸败。为提高冻藏大黄花鱼片的品质,卿明民等[49]对茶多酚、维生素E、异抗坏血酸钠进行了优化复配,结果表明复合抗氧化剂能有效抑制其因脂肪氧化引起的组织损失。
RCCs 的消减控制主要通过两条途径,一是通过抑制脂类氧化控制RCCs 的产生;二是通过与RCCs 发生反应,对其起到消减的作用。通过添加抗氧化剂对RCCs 进行消减控制的主要问题是如何提高抗氧化剂的稳定性,因此复合型的抗氧化剂和稳定性更强的抗氧化剂更为有效。
5 结论与展望
本文主要综述了由脂肪氧化产生的以HHE 和HNE 为代表的RCCs 的检测方法、饮食暴露和消减控制。近年来,国内外对于婴儿奶粉[34]、油炸食品[24,50]、肉制品[51-52]、植物油[53]、白酒及其制品[54]中的RCCs均有一定的研究。RCCs 对食品安全有重要影响,但目前的研究存在以下问题:缺少对于水产品中RCCs累积规律的研究以及国家安全标准限量的规定,特别是我国传统特色干腌制品,如腌鱼、咸鱼干等的相关研究非常匮乏;尚未建立出针对于干制水产品中RCCs的有效控制手段。在今后的工作中应从蛋白质氧化、脂肪氧化、RCCs、自由基和抗氧化剂等之间的关系开展研究,解析RCCs 累积机制与脂肪氧化机制,开发能够有效消减控制RCCs 产生和累积的抗氧化剂,提高干制水产品的食用品质及安全性。

