婴儿源鼠李糖乳杆菌的筛选及其促肠道类器官生长的研究
盖赛伦,陈晓洁,凌 涛,张腾勋,耿 萌,齐 威,罗学刚,张同存,王 楠,
(1.天津科技大学生物工程学院,教育部工业发酵微生物学重点实验室,天津 300457;2.天津市微生物代谢与发酵过程控制工程研究中心,天津 300457)
婴儿期是肠道菌群定殖的关键时期,肠道菌群早期定殖模式可以影响肠道生理发育、免疫系统、神经系统等的成熟,影响远期肥胖、过敏性疾病等的发病几率。近年来,国内外大量研究显示肠道微生物参与调控肠道细胞增殖分化,其中,益生菌发挥了极重要的益生作用。益生菌的干预对动物早期肠道形态发育、肠道上皮细胞增殖分化、肠道紧密连接及粘膜屏障形成等肠道发育过程有重要影响。一方面,益生菌可以通过自身组分(如菌毛蛋白、细胞壁成分等)、代谢产物(丁酸等)、分泌蛋白(如鼠李糖乳杆菌LGG 分泌的P40 和P75)等促进肠道上皮细胞的增殖分化、增强肠道粘膜屏障功能;另一方面,益生菌还可以通过调节肠道菌群结构来调节肠道功能,进而促进机体肠道粘膜免疫功能。
鼠李糖乳杆菌()是一种存在于人体肠道中的革兰氏阳性菌。其中,鼠李糖乳杆菌LGG 是目前全球研究最为广泛,应用最多的益生菌之一,主要通过平衡肠道菌群、维护肠道屏障结构完整、调节肠道免疫功能和增强肠道免疫力发挥对肠道的保护作用。LGG 通过促进肠道紧密连接和黏蛋白表达维护肠道屏障结构完整。LGG 的早期定殖(出生后1~5 d)促进了小鼠肠道功能成熟和免疫球蛋白A 的产生,同时降低了其成年后对结肠炎的易感性。然而,目前可用于婴幼儿食品的益生菌菌株十分有限,且大多数为国外菌株,因此,筛选具有促进肠道生长发育潜能的鼠李糖乳杆菌,一方面对于研究益生菌调节肠道发育的功能机制具有重要科学价值;另一方面对于开发具有维护婴幼儿肠道健康以及临床肠道损伤修复作用的益生功能食品具有重要意义。
目前,大量用于研究益生菌在肠道发育和肠道疾病中作用的体外模型主要依赖于永生化的细胞系,但由于肠道不同部位的组织具有独特的结构和生理功能,使用单一的离体细胞模型,很难模拟人体肠道的结构、功能,导致研究结果具有局限性。最近的研究表明,离体的肠道干细胞和隐窝可以在基质胶中经由3D 培养模式形成肠道类器官。这一结构包含特定组织来源的所有终末分化细胞,在形态和细胞组成上与体内肠道极为相似。来自小肠的肠道类器官由于其隐窝丰富通常是体外研究肠道发育和损伤修复的良好工具。目前已有利用小肠类器官研究益生菌对肠道发育影响的相关报道。Wu 等研究证实了罗伊氏乳杆菌()D8 既可以在生理条件下促进来自小肠的肠道类器官生长增殖,也可以改善TNF-诱导的肠道类器官的损伤,促进肠道上皮的修复。Hou 等利用肠道类器官与固有层淋巴细胞的共培养体系,证明了罗伊氏乳杆菌D8 可以通过刺激固有层淋巴细胞分泌IL-22 来促进肠道干细胞及肠上皮细胞增殖,进而修复受损的肠道屏障。
本研究以从1 月龄健康婴儿粪便中分离鉴定的5 株鼠李糖乳杆菌作为实验菌株,比较其耐酸、耐胆盐、表面疏水性、自动聚集能力及黏附性能,筛选出具有优良抗性和黏附性能的鼠李糖乳杆菌SW-02,并进一步利用肠道类器官模型对鼠李糖乳杆菌SW-02 的促进肠道细胞增殖、完善肠道紧密连接及粘膜屏障的作用进行评价。
1 材料与方法
1.1 材料与仪器
实验所用菌株鼠李糖乳杆菌LGG 菌株 中国工业微生物菌种保藏中心,菌种保藏号:ATCC 53103;5 株鼠李糖乳杆菌SW-01、SW-02、SW-03、SW-04、SW-X 和两株副干酪乳杆菌TX-01、TX-02 分离自1 月龄健康婴儿粪便,保藏于天津科技大学工业微生物菌种资源平台;雄性SPF 级C57BL/6 小鼠(4 周龄) 中国军事医学科学院实验动物中心(北京),动物试验均按照天津科技大学试验动物福利伦理委员会(GB/T 35892-2018)批准的方案进行;人结肠癌细胞HT-29(ATCC HTB-38) 保藏于本实验室,用10%胎牛血清(Fetal bovine serum, FBS)的DMEM/F12培养基中,在37 ℃、5% CO的条件下培养。
MRS 培养基、琼脂粉、琼脂糖、盐酸、牛胆盐、青-链霉素、冰杜尔贝科磷酸盐缓冲液(Dulbecco Phosphate-Buffered Saline,DPBS)、M-MLV 逆转录酶(20000~28880 U/mg)、Trizol 试剂、4',6-二脒基-2-苯基吲哚(DAPI) 北京索莱宝科技有限公司;DMEM/F12 培养基 美国Gibco 公司;胎牛血清新西兰Newzerum 公司;温和细胞解离试剂(Gentle Cell Dissociation Reagent,GCDR)、类器官培养基(IntestiCult OGM Mouse Kit) 加拿大干细胞技术有限公司;基质胶(Matrigel Matrix) 美国BD 公司;SYBRGreen qPCR Master mix 德国DBI Bioscience 公司;EdU 检测试剂盒 大连美仑生物技术有限公司;小鼠黏蛋白2(Mucin2,MUC2)检测试剂盒 武汉华美生物工程有限公司;多聚甲醛 天津市江天化工技术股份有限公司;TritonX-100、四甲基偶氮唑盐(MTT) 美国Sigma 公司;胎牛血清(FBS) 澳洲Ausbian 公司。
TUS-200P 振荡型恒温金属浴 中国上海一恒科技有限公司;SW-CJ-1FD 型单人单面净化工作台中国上海沪净医疗器械有限公司;HE-120 多功能水平电泳槽 中国上海天能科技有限公司;SKY-2102C 生化培养箱 中国上海苏坤实业有限公司;311 型CO培养箱 美国赛默飞世尔科技有限公司;ECLIPSE TE2000U 倒置显微镜 日本尼康公司;LDZX-75KBS 立式压力蒸汽灭菌器 中国上海申安有限公司;Hybrid Technology多功能酶标仪美国伯腾仪器有限公司;StepOnePlus实时荧光定量PCR 仪 美国应用生物系统公司;JIDI-18D 离心机 广州吉迪仪器有限公司;TY-80B 脱色摇床常州润华电器有限公司。
1.2 实验方法
1.2.1 菌株的活化和生长曲线测定 从-80 ℃冰箱取出冻存的菌液,在无菌超净台中划线于固体MRS培养基上,挑取单菌落于5 mL 液体MRS 培养基中活化两次,将活化的菌体以1%(v/v)的接种量接种于液体MRS 培养基中,置于37 ℃恒温孵育器24 h,每隔2 h 取样,并在600 nm 波长处测定其光密度值,绘制菌株的生长曲线。
1.2.2 供试菌株耐受性实验
1.2.2.1 耐酸性能力测定 参照郝冉等的方法,将离心洗涤后的菌体分别重悬于经溶解度为36%~37%的盐酸调节后pH 为1、2、3 的液体MRS 培养基中,以正常pH 的菌液作为对照(正常生长状态的乳酸菌),调整菌液浓度为5×10CFU/mL。各组分别取100 μL 接种于96 孔培养板中,37 ℃培养4 h。每孔加入20 μL 5 mg/mL 的MTT 作用4 h,终止培养后每孔加入100 μL 的二甲基亚砜,在室温于转速为100 r/min 的摇床上振荡15 min 以充分溶解结晶物。利用多功能酶标仪测量570 nm 波长处的吸光度(OD)值,存活率按以下公式计算:
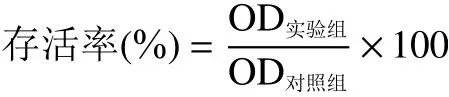
1.2.2.2 耐胆盐能力测定 参照Liu 等的方法,将活化的菌体以10CFU/mL 分别接种在空白对照MRS 液体培养基、含有0.1%、0.2%、0.3%胆盐的MRS 液体培养基中,以不含胆盐的菌液作为对照(正常生长状态的乳酸菌)。37 ℃培养4 h,采用同1.2.2.1 的MTT 方法进行检测和计算存活率。
1.2.2.3 菌株疏水率测定 参照杜兰兰等的方法,将活化的菌体以2%(v/v)接种量接种于MRS 液体培养基中,37 ℃培养箱中过夜培养。菌液以5000 r/min离心10 min 收集菌体,用磷酸盐缓冲液(Phosphate Buffered Saline,PBS,pH7.2)洗涤2 次后重悬。利用多功能酶标仪在600 nm 处检测其吸光度即初始吸光度值OD,之后将3 mL 细菌悬浮液与600 μL 的二甲苯(5:1)混合,漩涡振荡2 min。室温孵育1 h,弃去有机相,取水相于600 nm 波长处测定其吸光度值OD,表面疏水性按以下公式计算:
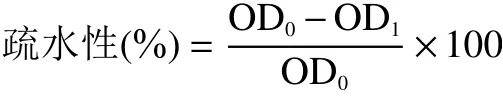
1.2.2.4 菌株自动聚集率测定 参照杜兰兰等的方法,将活化的菌体以2%(v/v)接种量接种于MRS 液体培养基中,37 ℃培养箱中过夜培养。将菌悬液漩涡振荡10 min 后在600 nm 波长下测定其吸光值作为整个细菌悬液的吸光值(OD),后放于37 ℃静置孵育。分别在30、60、90、120、150 min时取上层样品,测定其吸光度(OD)。自动聚集率按以下公式计算:
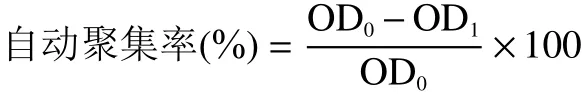
1.2.2.5 对肠道细胞的黏附能力评价 参照Li 等的方法评价细菌对结肠癌细胞HT-29 的黏附能力。将HT-29 细胞接种于96 孔板中,待细胞长至单层贴壁状态,1×PBS 清洗细胞两次后加入无抗生素和无血清的DMEM/F12 培养基预孵育37 ℃培养30 min。将活化的菌体以10CFU/mL 悬浮于无抗生素和无血清的DMEM/F12 培养基中以制备细菌悬液,弃去细胞培养板中培养基后每孔加入制备好的细菌悬液100 μL,37 ℃孵育2 h,PBS 洗去未黏附的细菌后于波长570 nm 处测定吸光值(黏附菌组),以未进行PBS 清洗细菌的细胞作为总菌组,以不加细菌悬液的细胞组作为对照组,之后采用同1.2.2.1 的MTT方法进行检测和计算黏附能力。计算公式如下:

1.2.3 供试菌株对肠道类器官生长的影响
1.2.3.1 类器官的提取与分离 参考Sato 等的方法略作修改,在幽门下5 cm 处及距回盲部5 cm 处分别离断小肠。将小肠放入DPBS 中,去除残留的肠系膜及血管,然后用10 mL 注射器吸取冰DPBS从靠近幽门端冲洗肠腔,使肠内容物排出。将洗净的小肠剪成5 mm 左右的片段,转移至50 mL 离心管,冰浴静置至肠片段沉底,弃掉上清,加入25 mL 温和细胞解离试剂置于摇床上以20 r/min 转速室温孵育15 min,用含有0.1% FBS 的PBS 终止消化,反复吹吸,自然静置5min 吸取上清,以70 μm 细胞过滤器过滤收集上清液,沉淀,重复上述吹吸步骤3 次。过滤后的上清液于4 ℃以300 g 的离心速率离心5 min,弃上清液,分别用预冷的添加1%青-链霉素的PBS和DMEM/F-12 培养基重悬沉淀并离心进行清洗。最后加入适当体积类器官生长培养基重悬沉淀,以1:2 比例与Matrigel 混匀,按每孔50 μL 的体积种植到37 ℃预温的24 孔板中,放入培养箱中1 h,待基质胶固化后,加入500 μL 类器官生长培养基进行培养,每2~3 d 换一次培养基,每5~7 d 传代一次。
1.2.3.2 类器官与菌株共培养及出芽率、出芽个数的计数 倒置显微镜下观察类器官的生长情况,将类器官以50 个/孔的密度接种到24 孔板,待1~2 d 后生长到具有一定球形类器官结构时与菌株进行共培养。将菌体用类器官生长培养基进行重悬,以1×10CFU/孔的密度加入到细胞培养板中。实验分为3 组进行,对照组(Control)、LGG 共培养组和SW-02 共培养组。共培养3 d,在光学显微镜下观察类器官生长情况,并计算类器官的出芽率及出芽个数。
1.2.3.3 EdU 染色评估类器官的增殖状态 类器官的增殖情况利用EdU 细胞增殖检测试剂盒进行,实验步骤参考试剂盒说明书进行。首先对处理后的类器官进行EdU 标记,每孔加入200 μL 含有50 μmol/L EdU 的培养基孵育2 h,弃去培养基。用4%多聚甲醛进行固定,然后利用Apollo®荧光染料进行染色,最后用Hoechst33342 对细胞核进行染色以评估总细胞数,并在共聚焦显微镜下观察计数,计算EdU 阳性细胞数的比例。
1.2.3.4 实时荧光定量PCR 测定基因mRNA 的相对表达量 利用Trizol 试剂提取总RNA,取2 μg RNA 用M-MLV 逆转录酶进行逆转录。PCR 扩增体系20 μL:qPCR master mix 10 μL,50×ROX 0.4 μL,上、下游引物各0.5 μL,cDNA 模板1 μL,无菌蒸馏水7.6 μL。PCR 反应条件:95 ℃预变性2 min;95 ℃变性10 s,60 ℃退火和延伸30 s,40 个循环;95 ℃l min,55 ℃ l min,95 ℃ 15 s 绘制熔解曲线。以GAPDH 作为参考基因,2法计算目标基因mRNA的相对表达量。目标基因的引物序列见表1。
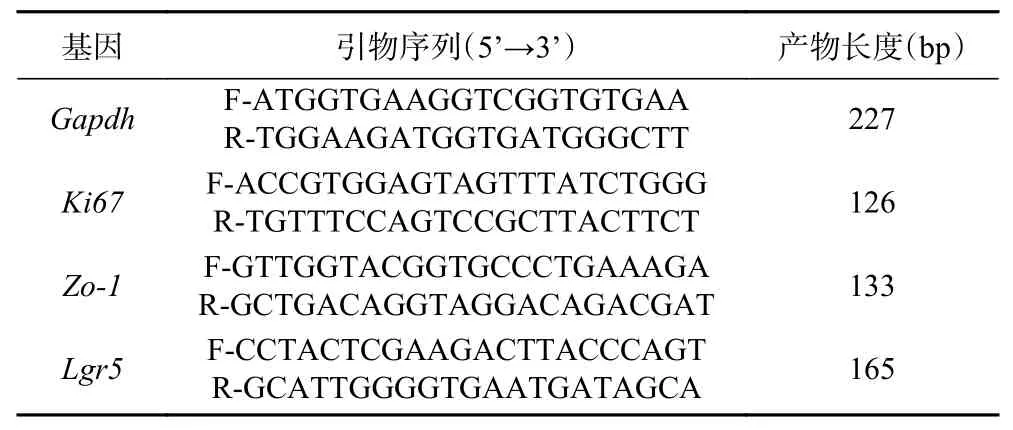
表1 荧光实时定量PCR 引物Table 1 Primers for real-time PCR
1.2.3.5 酶联免疫吸附试验(ELISA)法测定MUC2含量 类器官与菌体共培养后,离心收集培养基上清,采用酶联免疫吸附法检测培养基上清液中MUC2 水平,试剂盒采用小鼠MUC2 的ELISA 检测试剂盒,检测方法参考说明书进行。最后在450 nm波长测定光密度值,同时根据标准品绘制标准曲线并计算样本中MUC2 含量。
1.3 数据处理
数据采用平均值±标准差(mean±SD)表示,每组实验重复3 次。运用SPSS 19.0 软件,通过One-way ANOVA 和Two-way ANOVA 进行数据分析,试验数据使用GraphPad Prism 5.0 软件进行绘图及拟合处理。<0.05 认为具有统计学显著差异。
2 结果与分析
2.1 供试菌株的生长曲线测定
通过生长曲线的测定来评价所筛菌株的差异性,结果如图1 所示:
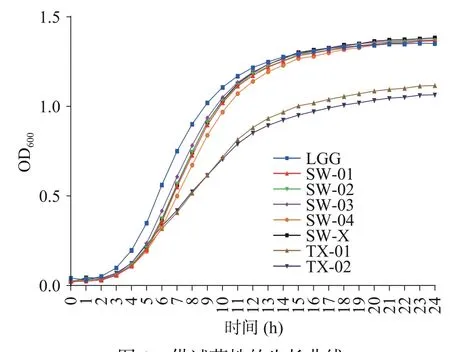
图1 供试菌株的生长曲线Fig.1 Growth curve of the tested strains
由图1 可以看出,所有的鼠李糖乳杆菌菌株在0~4 h 为生长迟滞期,4~12 h 进入对数生长期,OD由0.1 左右迅速提高至1.3 左右,此时生长速度较快。12 h 后进入稳定期,OD基本不变,与对照菌LGG 无明显差异。而两株副干酪乳杆菌TX-01和TX-02 生长较为缓慢,24 h 时OD 值分别为1.11和1.06。
2.2 供试菌株的耐受性
2.2.1 耐酸性能力测试 从图2 可以看出:当pH为1、2 和3 时,鼠李糖乳杆菌SW-02 的存活率显著高于商用菌株LGG(<0.05),存活率分别达到了23.13%±1.75%、30.36%±2.54%和50.73%±2.77%。同时,在pH 为3 时,鼠李糖乳杆菌SW-03 和鼠李糖乳杆菌SW-X 的存活率显著高于除SW-02 与LGG外的其他四组(<0.05),存活率分别达到了35.17%±1.49%和33.51%±1.88%,也有较强的耐酸性。这表明SW-02、SW-03 和SW-X 具有更优的耐酸性,能在高浓度的胃液中存活并进入小肠。郭羽等证实,LGG 在pH1.5 和2 的条件下培养4 h 其存活率分别为25.12%和27.96%。贺珊珊等对5 株益生菌进行耐酸性筛选,其中鼠李糖乳杆菌LR-D 能够短时耐受低pH 环境,在pH2.5 的发酵液中培养2 h的存活率能够达到14.39%。对照本实验结果,SW-02 的耐酸能力与上述菌相比更有优势。
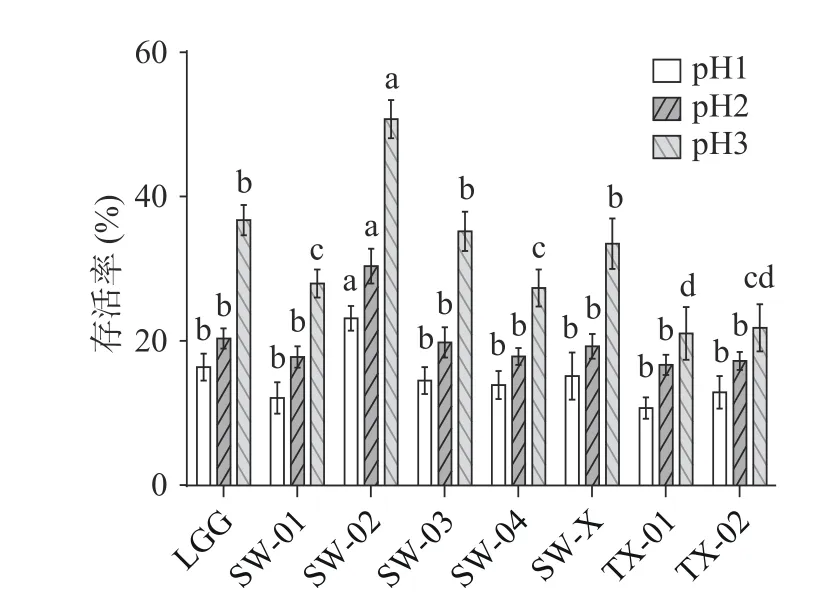
图2 供试菌株的耐酸性能力Fig.2 Acid resistance of the tested strains
2.2.2 耐胆盐能力测试 从图3 可以看出,鼠李糖乳杆菌SW-X、SW-03 和SW-02 的耐胆盐能力最为突出,显著高于对照菌株鼠李糖乳杆菌LGG 和其余菌株(<0.05),在胆盐浓度为0.3%时,存活率分别达到了51.04%±4.61%、47.02%±4.11%和47.35%±4.21%。而SW-01、SW-04、TX-01 和TX-02 的存活率与LGG 相差不大。这表明,SW-X、SW-03 和SW-02具有更优的耐胆盐性。与本文的研究结果相似,吕嘉枥等发现在胆盐浓度为0.1%~0.3%时,LGG 菌落存活率为37%~60%。薛梅等发现鼠李糖乳杆菌LV108 在胆盐浓度为0.3%时,培养2 h 后存活率在45%左右,在胆盐浓度为0.1%时,培养2 h 后存活率大于75%。对照本实验结果,SW-X、SW-03 和SW-02 在相同浓度胆盐处理4 h 时,存活率与鼠李糖乳杆菌LV108 处理2 h 时结果相似,表明本实验筛选菌株SW-X、SW-03 和SW-02 具有更好的耐胆盐能力。
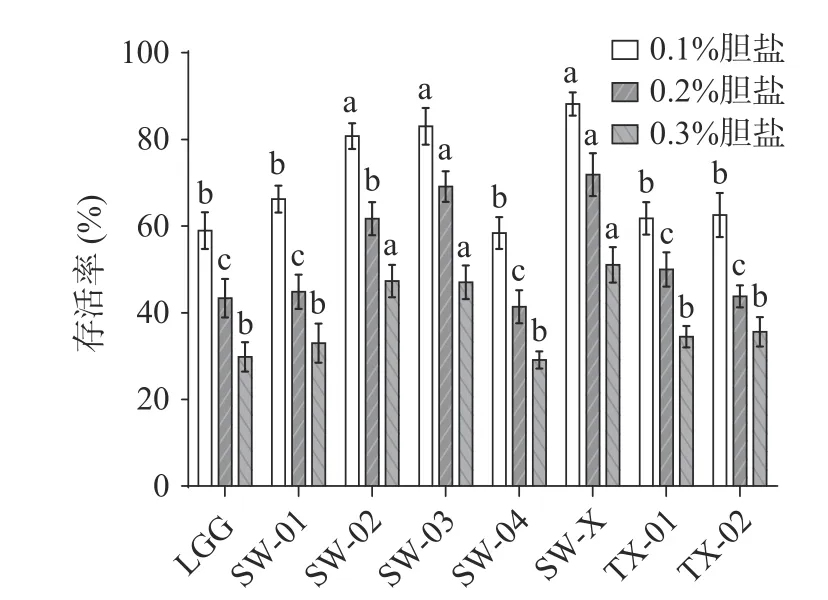
图3 供试菌株的耐胆盐能力Fig.3 Bile salt tolerance of the tested strains
2.2.3 疏水率和自动聚集率测定 研究表明,细菌的疏水性能力、自动聚集能力和细菌的黏附性能存在一定的相关性,疏水性和自动聚集能力越高,其粘附性越好。因此,通过疏水性实验和自动聚集实验,来测定菌株对HT-29 细胞的粘附性,以评价菌株在肠上皮的粘附能力。结果如图4、图5 所示:
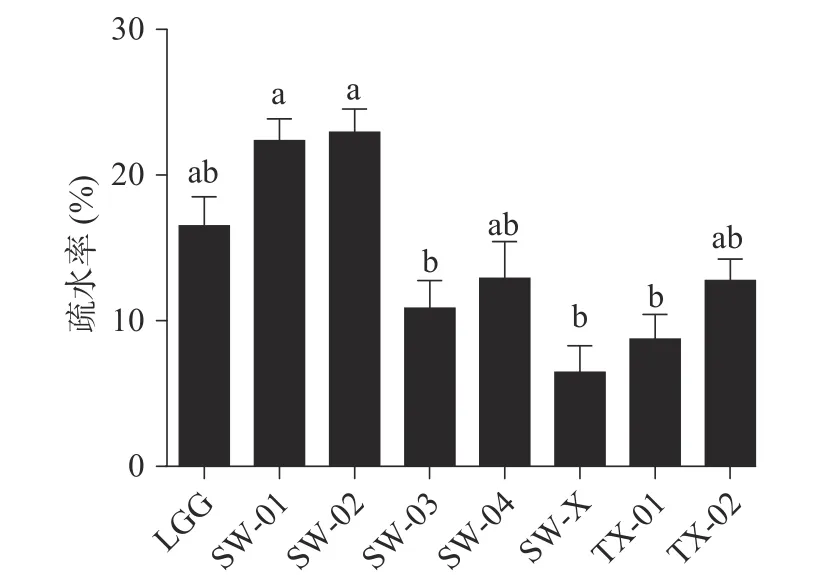
图4 供试菌株的疏水率Fig.4 Hydrophobicity of the tested strains
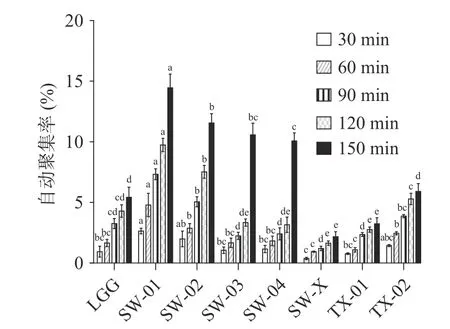
图5 供试菌株的自动聚集率Fig.5 Automatic aggregation rate of the tested strains
从图4 可以看出,细菌表面疏水性实验中,不同菌株的疏水性能力出现出明显的差异,SW-02、SW-01、LGG、SW-04 和TX-02 的疏水率相对较高,分别为22.94%±1.80%、22.36%±1.68%、16.52%±2.10%、12.90%±2.53%和12.76%±1.75%,而SW-03、SWX 和TX-01 的疏水性能力相对较差,分别为10.87%±2.07%、6.46%±1.80%和8.74%±1.69%。杜兰兰等的研究表明,LGG 对二甲苯的疏水率为9.85%±1.25%。李珊珊等的研究表明,鼠李糖乳杆菌ATCC7469对二甲苯的疏水率为15%左右,对照本实验结果,SW-02 和SW-01 的疏水性能力与上述菌相比更有优势。
从图5 可以看出,自动聚集能力实验中,各菌株之间的自动聚集率表现出明显的差异。在2.5 h 时,SW-01 自动聚集率最高,为14.46%±1.20%,SW-02 和SW-03 次之,自动聚集率分别达到了11.55%±0.89%和10.57%±1.04%。龚虹等认为自动聚集能力高的细菌,其表面疏水性也高。本研究中对比表面疏水性能力和自动聚集能力结果发现SW-01 和SW-02的表面疏水性与自动聚集能力均较高。
2.2.4 供试菌株对结肠癌细胞HT-29 黏附能力的测定 为了进一步验证菌株对肠道上皮细胞的黏附能力,利用HT-29 细胞测定了各菌株对细胞的粘附能力。结果如图6 所示:
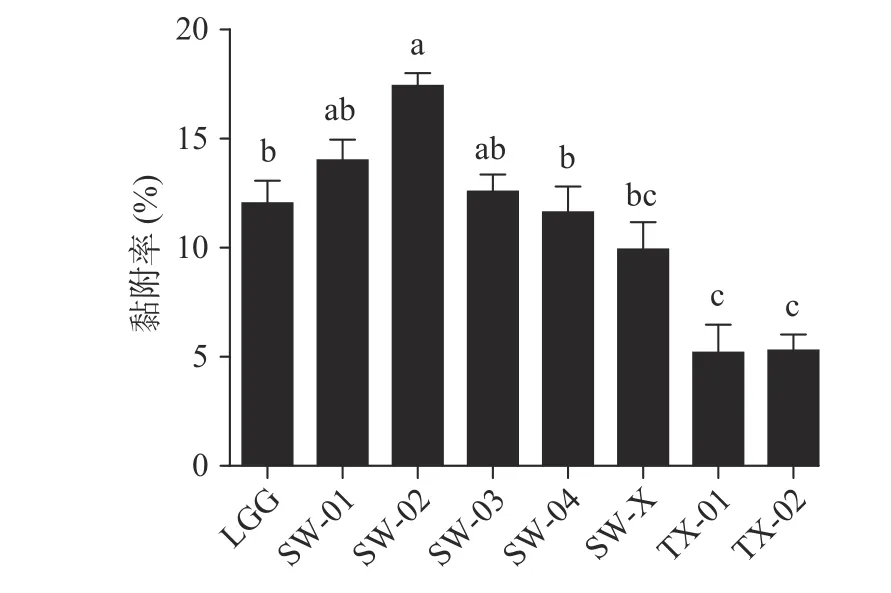
图6 供试菌株对HT-29 细胞的黏附率Fig.6 Adhesion rates of the tested strains to HT-29 cells
从图6 可以看出,与对照菌株LGG 相比,菌株SW-02、SW-01 和SW-03 均表现出较高的黏附能力,黏附率分别为17.42%±1.22%、14.01%±1.82%和12.52%±1.43%。菌株TX-01 和TX-02 的黏附能力最差,黏附率均显著低于对照菌株LGG(<0.05)。与本文的研究结果相似,唐雅茹等测得植物乳杆菌KLDS1.0386 对肠上皮细胞的黏附率为16.65%。在本研究中,通过对菌株生长曲线、耐酸耐胆盐实验、疏水性实验和自动聚集能力实验以及细胞黏附实验的测定,综合判断发现从健康婴儿中分离获得的菌株SW-02 的耐受性较好,因此后续对鼠李糖乳杆菌SW-02 的促肠道类器官生长作用进行评价。
2.3 鼠李糖乳杆菌SW-02 对肠道类器官的影响
2.3.1 鼠李糖乳杆菌SW-02 对肠道类器官生长的影响 从小鼠小肠中分离隐窝,并进行长期传代培养形成肠道类器官,结果如图7 所示。
分离的肠道隐窝数小时至1 d 内闭合构成球形结构(图7A),其中心可见内腔,随着肠道干细胞的自我更新、不断增殖,2~3 d 左右形成出芽结构并向外突出生长(图7B),经6~7 d 培养后类器官最后可形成多个出芽结构,演化成为典型的肠道类器官(图7C)。后续视类器官的生长情况5~7 d 可传代1 次,冻存、复苏后均有活力。
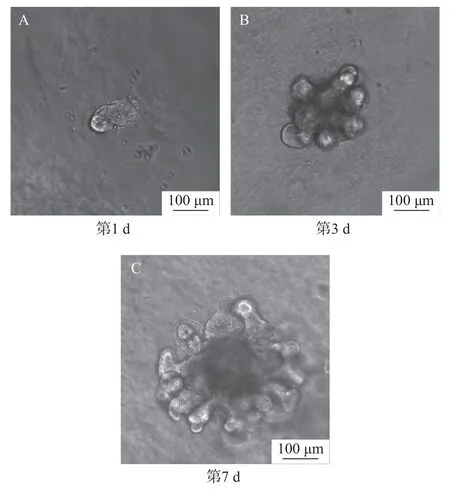
图7 肠道类器官的形态学变化Fig.7 Morphological changes of intestinal organoids
为了进一步评价鼠李糖乳杆菌SW-02 对肠道类器官生长的影响,以LGG 作为对照菌株,将SW-02 与肠道类器官进行共培养,结果如图8 所示。
从图8 可以看出,与对照组相比,与鼠李糖乳杆菌SW-02 共培养的类器官体积明显增大,同时SW-02 显著提高了类器官的出芽率和出芽个数(<0.05)。这说明SW-02 能促进干细胞的增殖和分化,促进了肠道类器官的生长。类器官具有某些与来源器官相似的结构特征和功能特性,而且能够在体外3D 培养体系中稳定扩增,因此在生物学基础研究、构建疾病模型、肿瘤研究、组织再生修复、基因治疗以及药物筛选等方面显示出了广阔的应用前景。Lukovac等利用肠道类器官模型,研究了益生菌的代谢产物短链脂肪酸(Short Chain Fatty Acids,SCFA)及嗜黏蛋白阿克曼菌()和普氏粪杆菌()的代谢产物对肠道类器官中基因转录水平的影响。与本文的研究结果相似,罗伊氏乳杆菌D8 可以促进小鼠肠道类器官生长增殖。Sittipo 等证实热灭活的嗜酸乳杆菌可以使辐射所致损伤的肠道类器官恢复生长,提高出芽率。
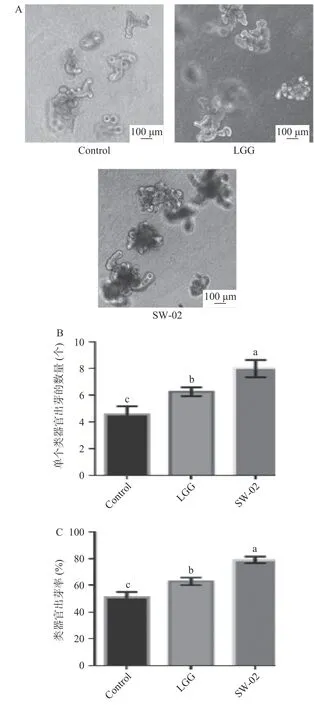
图8 鼠李糖乳杆菌SW-02 对肠道类器官生长的影响Fig.8 Effect of L. rhamnosus SW-02 on the growth of intestinal organoids
2.3.2 EdU 染色检测鼠李糖乳杆菌SW-02 对肠道类器官中细胞增殖的影响 利用EdU 染色评价了鼠李糖乳杆菌SW-02 肠道类器官中细胞增殖的影响,结果如图9 所示。
从图9 可以看出,鼠李糖乳杆菌SW-02 能促进类器官中细胞的增殖,EdU 阳性细胞的百分比为85.2%±2.7%,显著高于对照组的45%±0.9%(<0.05)。与LGG 共培养的类器官中EdU 阳性细胞的百分比为69.9%±5.5%。这说明SW-02 的刺激,能够促进肠上皮细胞的增殖。相似地,Wu 等和Hou 等两个研究工作均证实罗伊氏乳杆菌D8 可以上调肠道类器官中EdU 阳性细胞数。
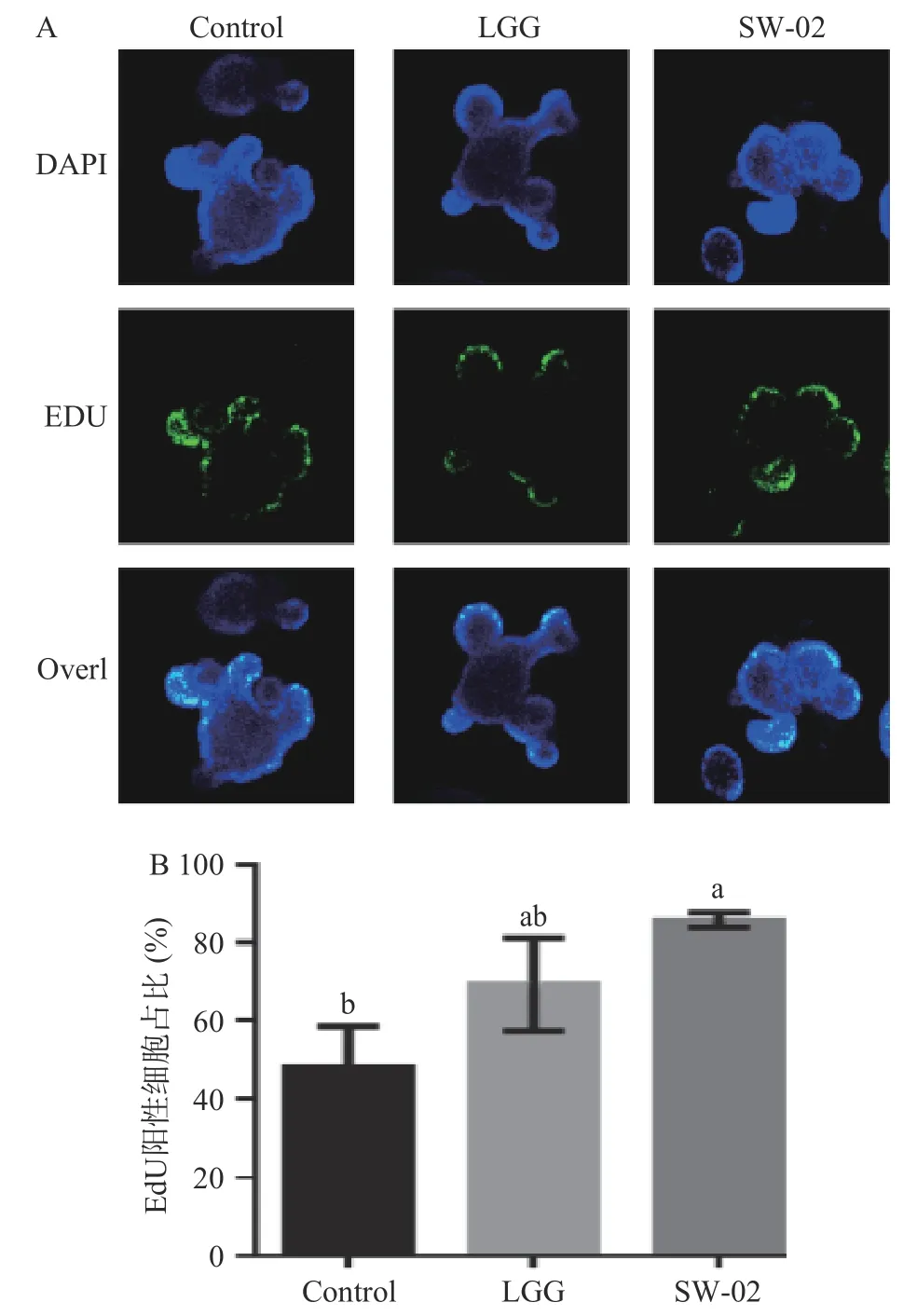
图9 EdU 染色检测鼠李糖乳杆菌SW-02 对肠道类器官增殖的影响Fig.9 Effect of L. rhamnosus SW-02 on the proliferation of intestinal organoids by EdU staining
2.3.3 鼠李糖乳杆菌SW-02 对肠道类器官中相关基因mRNA 水平的影响是肠道干细胞的标记物,阳性细胞能够分化为所有类型的肠道上皮细胞,是一种增殖细胞的相关抗原,其功能与有丝分裂密切相关。紧密连接蛋白Zo-1 对于上调上皮增殖和促进有丝分裂的完成具有至关重要的作用。因此本研究利用Real-time PCR 检测了肠道干细胞标志物、细胞增殖相关基因和紧密连接蛋白的mRNA 水平,结果如图10 所示。
从图10 可以看出,SW-02 的刺激显著促进了的表达(<0.05);同时,的表达出现了明显上调的趋势,这与肠道类器官EdU 染色的结果一致;紧密连接蛋白的mRNA 水平也呈显著上调的趋势(<0.05)。这些结果进一步说明鼠李糖乳杆菌SW-02 可以促进肠道类器官的生长,促进肠道屏障的成熟。Sittipo 等证实热灭活的嗜酸乳杆菌可以上调辐射所致损伤的肠道类器官的的mRNA水平。是肠道上皮细胞增殖能力和肠道发育程度的常用检测指标,已有多项关于益生菌及其蛋白对小肠类器官及乳鼠小肠组织中的影响的相关报道。与本研究结果相似,Wu 等证实罗伊氏乳杆菌D8 增加了小鼠小肠类器官中的mRNA 水平。
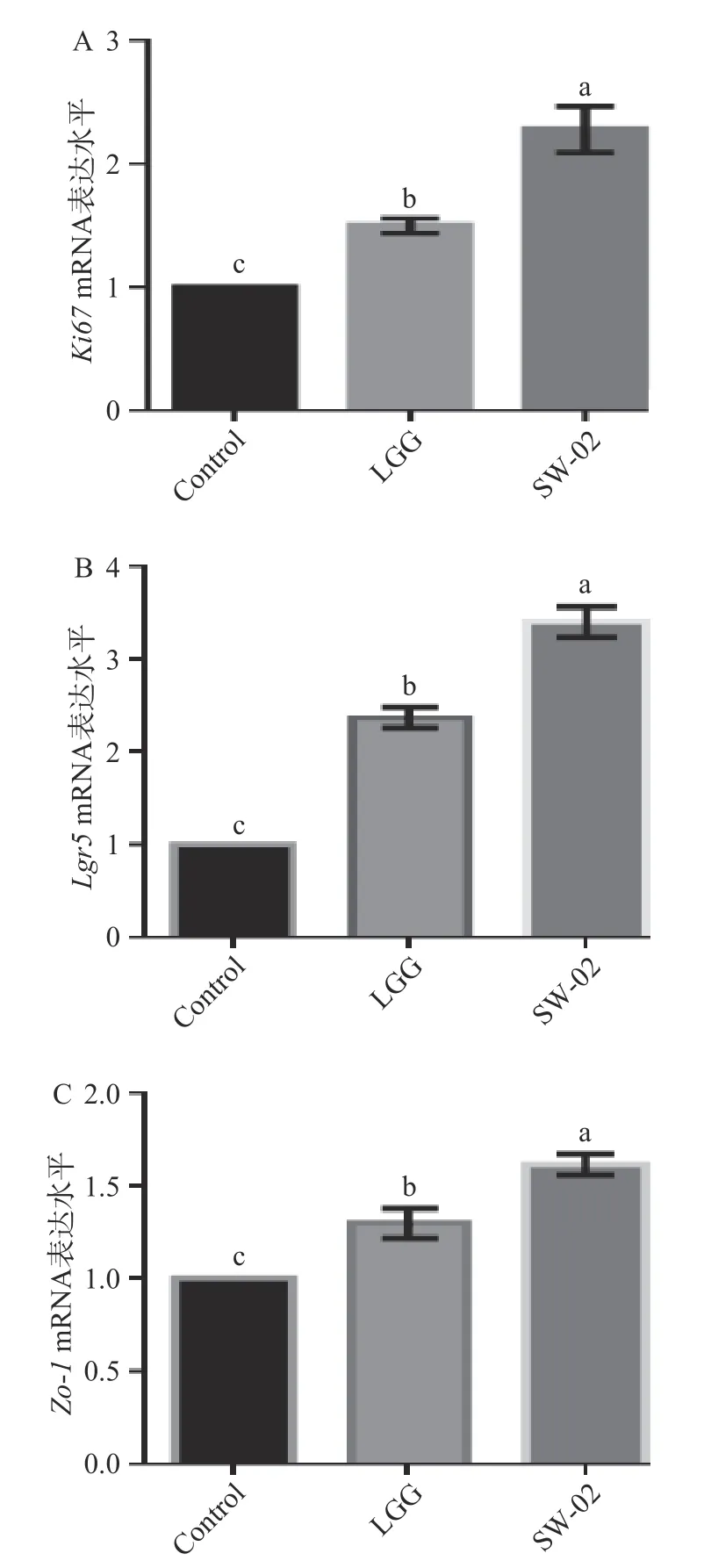
图10 鼠李糖乳杆菌SW-02 对肠道类器官中相关标志基因mRNA 水平的影响Fig.10 Effect of L. rhamnosus SW-02 on the mRNA levels of the related marker genes in intestinal organoids
2.3.4 鼠李糖乳杆菌SW-02 对肠道类器官中黏蛋白MUC2 表达的影响 为了研究鼠李糖乳杆菌SW-02对肠道粘膜屏障的影响,利用ELISA 的方法检测了鼠李糖乳杆菌SW-02 对MUC2 表达的影响,结果如图11 所示。
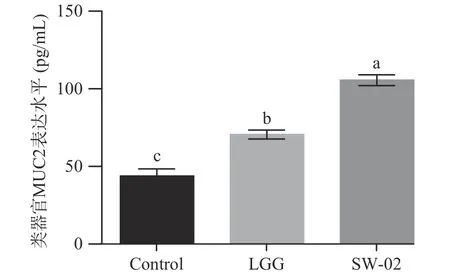
图11 鼠李糖乳杆菌SW-02 对肠道类器官中黏蛋白MUC2 表达的影响Fig.11 Effect of L. rhamnosus SW-02 on the express of MUC2 in intestinal organoids
从图11 可以看出,与对照组相比,SW-02 的处理明显促进了MUC2 的分泌。这些结果说明鼠李糖乳杆菌SW-02 有助于肠道粘膜屏障的完善。研究证实热灭活的嗜酸乳杆菌可以上调辐射所致损伤的肠道类器官中的mRNA 水平。与这些研究相似,本研究中通过建立体外肠道类器官模型,发现鼠李糖乳杆菌SW-02 在肠道类器官的出芽个数、出芽率、增殖情况等方面具有显著促进作用,同时可以上调、、的mRNA 相对表达量和粘蛋白MUC2 分泌。
3 结论
综上所述,本研究以从一月龄健康婴儿粪便中分离的5 株鼠李糖乳杆菌作为实验菌株,以LGG 为对照菌株,通过耐酸、耐胆盐、疏水性、自动聚集和细胞粘附性实验,筛选出具有良好抗性的鼠李糖乳杆菌SW-02。进一步通过构建肠道类器官模型,发现鼠李糖乳杆菌SW-02 能够促进肠道类器官的生长增殖、促进肠道紧密连接蛋白和粘蛋白MUC2 的表达,有利于肠道屏障的完善。以上研究结果表明鼠李糖乳杆菌SW-02 具有潜在的应用价值,有望成为商业开发的备选菌株。

