基于转录组测序研究不同海拔生境神农香菊的基因表达差异*
周春苗,蒋莉萍,董刚强,刘义飞,陈士林,张景景**
(1. 湖北中医药大学药学院 武汉 430065;2. 安利(中国)植物研发中心 无锡 214115;3. 中国中医科学院中药研究所 北京 100700)
神农香菊(Chrysanthemum indicumvar.aromaticum)为菊科菊属野菊的变种,是1982年武汉植物研究所刘启宏等人首次发现并命名的一种新资源植物[1]。与原变种野菊相比,其植株矮小,叶片较厚,头状花序较小,但全株具有浓郁的香气[2],民间常用于清热解毒、清咽利喉、散风降压等[3]。现代研究表明,神农香菊的挥发油中富含α-侧柏酮、β-侧柏酮及龙脑等萜烯类化合物,含量较野菊和其他栽培药菊高[4]。此外,神农香菊还被用来提取精油和浸膏,广泛用于食品、香精香料和化工等领域,是观赏菊和药用菊优良芳香品种改良的重要种质资源,开发利用价值极高,应用前景广泛。
神农香菊的自然分布范围极其狭窄,仅在神农架林区南部靠近巴东、兴山两县的大神农架、小神农架、神农顶等地有野生居群,其中在海拔2,600 -2,700 m的范围内种群密度最大,但资源总体蕴含量有限[5-6],无法满足大量开发利用的需求。自1984年起,研究者开展了大量的神农香菊引种移栽试验,但神农香菊在引种扩繁的过程中其花期、营养生长期及香气成分等均因生境改变而存在明显差异,从而影响其开发应用价值[7-8]。神农香菊引种栽培到低海拔区域,会出现香气发生改变的情况,说明海拔相关的生态因子对其特征代谢产物的形成影响较大。因此,开展神农香菊主要香气特征物质由于海拔变化而发生改变的内在分子调控机制则成为其资源深度开发应用的当务之急。
目前关于神农香菊分子水平的研究较少,仅有萜类合成途径相关的少数基因、转录因子的克隆及功能分析的报道[9-13]。转录组学是一门在整体水平研究基因的转录和表达水平,并以此调查其结构和功能的技术方法。转录组测序因具有高通量和高准确性,且测序的成本较低,时间短等特点[14-15],被广泛应用于研究植物生长发育规律、逆境生理、胁迫响应机制及代谢调控网络,并可基于比较转录组学并联合代谢组学、蛋白组学等多组学技术挖掘关键基因,为开展更深入的研究提供数据基础[16-18]。转录组测序在研究高山植物对环境的适应性方面也有重要意义,例如,基于转录组测序,揭示了高海拔植物钟花报春具有通过转录组变异快速适应气候变化的能力[19]。有研究者在结合转录组学和代谢组学分析的基础上,研究了不同海拔高山杜鹃花属物种不同颜色花的基因表达模式、进化适应和代谢物沿海拔梯度的变化。结果发现,差异表达基因与碳水化合物、脂肪酸、氨基酸和类黄酮的生物合成有关,这表明它们在杜鹃花属物种的海拔适应性中具有重要作用[20]。对不同温度生长下的藏边大黄的转录组进行比较分析,结果显示差异表达基因主要属于信号通路,转运蛋白,次级代谢物,植物激素以及与细胞保护相关的基因,这表明它们在赋予藏边大黄在其生态位中的适应性优势方面的重要性[21]。
作为高海拔野生分布的非模式植物神农香菊,现尚未开展全基因组测序,通过转录组数据的分析与挖掘,能够筛选参与生长发育及代谢的功能基因,并鉴定差异表达基因,解析相关调控网络,这对其高山环境的适应性策略、香气品质形成机制的研究及资源保护利用具有重要意义。本研究对种植在不同海拔高度的神农香菊样品进行转录组测序,调查不同海拔种植区的神农香菊在适应环境过程中基因表达差异,分析相关的代谢网络调控关键基因,阐述神农香菊对不同海拔种植区的环境适应机制,以期为神农香菊由高海拔向低海拔的引种扩繁和资源保护提供理论依据。
1 材料与方法
1.1 材料
用于生态因子分析的神农香菊包括天门垭(2,095 m)和神农顶(2,880 m)两个原生境地方,以及黄龙堰(1,720 m)和宋洛(816 m)两个种植移栽点。用于转录组分析的神农香菊样品取自种植点高海拔的黄龙堰和低海拔的宋洛。两个种植点的神农香菊原始材料具有相同的遗传背景。于盛花期采集神农香菊花(F)、叶(L)、茎(S)样品,高海拔区域标记为H,低海拔区域标记为L,每个组3个生物学重复。用液氮速冻后放于-80℃冰箱保存备用。
1.2 方法
1.2.1 生态因子提取
利用 WheatA(http://www.wheata.cn/)提取神农香菊四个样品点(天门垭、神农顶、黄龙堰、宋洛)2016至2020 年连续5 年的8 个生态因子,主要包括年均温(℃)、年降水量(mm)、平均湿度(%)、年日照时数(h)、最热月平均温度(℃)、最冷月平均温度(℃)、最热月平均降水量(mm)以及最冷月平均降水量(mm),并基于单因素方差分析(ANOVA)对四个地点的生态因子数值进行显著分析。
1.2.2 转录组测序及组装
用RNA 试剂盒提取神农香菊样品花(HF,LF)、叶(HL,LL)和茎(HS,LS)的总RNA,用NanoDrop 超微量分光光度计(Thermo Scientific,美国)测定浓度以及质量,检测合格(OD260/OD280≥2.0)后用于cDNA 文库构建,利用Illumina HiSeq 4000 高通量测序平台进行测序。对原始数据进行处理,去除带接头的,不确定的以及低质量的序列。因为神农香菊缺乏基因组数据,故用 Trinity(http://trinityrnaseq.sourceforge.net/)进行从头拼接,采用Corset 软件[22]将组装好的转录本聚类并形成unigenes。通过聚合冗余转录本从而提高差异表达基因的检出率,最后得到的数据集用于后续分析。
1.2.3 Unigenes 功能注释
利 用 Nr (Non-Redundant Protein Sequence Database)非冗余蛋白数据库(ftp://ftp.ncbi.nih.gov/blast/db/FASTA),KOG(Eukaryotic Orthologous Groups)蛋白质直系同源簇数据库(https://www.ncbi.nlm.nih.gov/research/kog),SwissPro 蛋白质序列数据库(http://www.expasy.ch/sprot),KEGG(Kyoto Encyclopedia of Genes and Genomes)京都基因百科全书数据库(http://www.genome.jp/kegg),GO(Gene Ontology)基因本体数据 库(http://www. geneontology. org/),Nt(Nucleotide Sequence Database)核酸序列数据库(ftp://ftp.ncbi.nih.gov/blast/db/FASTA)和PFAM 蛋白质家族数据库(http://pfam.xfam.org/)等七大数据库对神农香菊转录组数据得到的基因进行注释。
1.2.4 差异基因分析
采用RSEM[23]软件进行转录本定量分析,将readcount 数 进 行 FPKM(Fragments Per Kilobase of transcript sequence per Millions)转换用于表示基因的表 达 量 。 用 DESeq2(http://www. bioconductor. org/packages/release/bioc/html/DESeq2.html)进行差异表达分析,以|log2(FoldChange)|>1&P-value<0.05 为标准筛选差异基因。为了控制假阳性比例,引入P-adj 对假设检验的P-value 进行校正。得到的差异基因在KEGG 和GO 数据库中注释。后续的可视化分析在R软件(https://www.r-project.org/)、Graphpad prism 8(https://www.graphpad.com/scientific-software/prism/)以及 TBtools(https://github.com/CJ-Chen/TBtools/releases)中完成。
2 结果与分析
2.1 海拔相关的生态因子差异分析
对神农香菊两个原生境及两个栽培点的生态因子进行显著性差异分析,结果表明,野生神农香菊最低分布区与最高分布区神农顶的生态因子包括年平均气温、最冷月平均温度均有显著性差异,而降水、相对湿度、年日照时长均无显著性差异。高海拔种植点黄龙堰与野生神农香菊最低分布区天门垭的主要生态因子如年平均气温、最冷月平均温度、相对湿度、年日照时长以及降水等均无显著性差异,而与最高分布区神农顶的年平均气温、最冷月平均温度、相对湿度都有显著性差异。低海拔种植点宋洛与两个神农香菊野生分布区的主要生态因子如年平均气温、最冷月平均温度、相对湿度、年日照时长均有显著性差异,而降水与相对湿度并无显著性差异。高海拔种植点黄龙堰与低海拔种植点宋洛有关温度的生态因子(包括年均温、最热月平均温度、最冷月平均温度)以及年日照时长均有显著性差异。这说明高海拔种植点黄龙堰的环境与野生神农香菊最低分布区的环境相近,在海拔相关的环境因子中,温度可能是影响神农香菊生态适应性的最重要因子之一,而在低海拔种植点宋洛,除了温度,光照也可能重要的影响了神农香菊的生长发育(图1)。
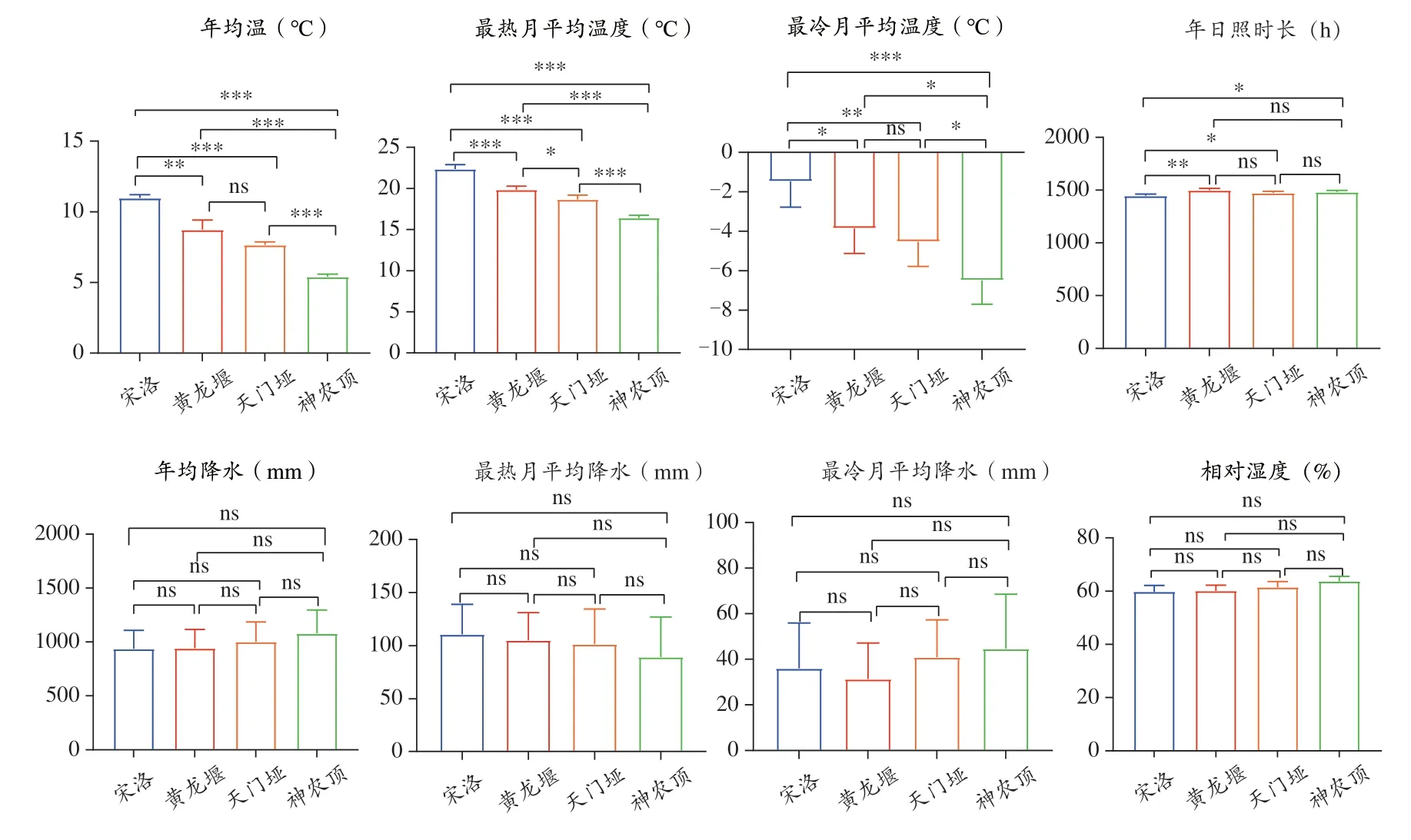
图1 四地生态因子显著性分析柱形图
2.2 转录组测序组装与注释
对两个种植点的神农香菊样本进行转录组测序,其中高海拔种植点黄龙堰的样本(HF、HL 和HS)共产生22,347,910 原始序列,质控后得到约22,103,228 干净序列;低海拔种植点宋洛(LF、LL 和LS)的测序样本共产生约22,447,988 原始序列,质控后得到约22,161,301 干净序列。测序所得碱基错误率均小于0.03%,Q20 大于97.02%,Q30 大于 92.01%,且GC 含量占比范围为41.6%-42.54%,有效数据量均超过6.17 Gb。说明本实验转录组测序数据组装质量较好,可用于后续分析(表1)。

表1 神农香菊转录组数据质量分析结果
将有效数据组装后共获得439,485 个转录本,去冗余后得到158,174 条unigenes,核苷酸总数分别为466,346,195 和146,386,887,序列平均长度分别为1,061 bp 和 925 bp,N50 长度分别为 1,457 bp 和 1,255 bp。超过71.3%的unigene长度小于1 kb,unigene长度大于2 kb的占比9.5%(图2A)。
利 用 Nr、Nt、SwissProt、PFAM、KOG、GO 以 及KEGG 七大数据库对158,174 个unigenes 进行功能注释,有 90,030 个 unigenes(56.91%)在Nr 数据库中被注释到,GO 数据库和KEGG 数据库分别注释了63,627(40.22%)和33,997 个unigenes(21.49%),有7.91%的unigenes 在所有数据库中都被注释到,至少一个数据库 中 注 释 到 的 unigenes 有 104, 486(66.05%)个(图2B)。
根据序列同源性,对63,627个unigenes进行GO功能注释并分类,一共注释到生物过程(Biological Process)、细胞组成(Cellular Component)和分子功能(Molecular Function)三个功能分类的43 个GO terms结果。在生物过程中,注释最多的基因被归类于细胞过 程(cellular process, GO: 0009987)、代 谢 过 程(metabolic process, GO:0008152)、生物调节(biological regulation, GO:0065007)以及定位(localization, GO:0051179)类别。在细胞组成中,注释最多的基因被归类为细胞解剖实体(cellular anatomical entity, GO:0110165)、细胞内部(intracellular, GO:0005622)以及含蛋白质复合物(protein-containing complex, GO:0032991)类别。在分子功能中,注释最多的基因被归类于结合(binding, GO:0005488)和催化活性(catalytic activity,GO:0003824)类别。共有 33,997 条 unigenes 被注释到了KEGG 数据库中的299 个代谢通路,包括有机系统(Organismal Systems)、代谢(Metabolism)、遗传信息处理(Genetic Information Processing)、环境信息处理(Environmental Information Processing)以及细胞过程(Cellular Processes)的不同通路类别。在注释到的次生代谢物的生物合成途径中,unigenes 数量最多的是苯丙素类生物合成途径(ko00940),不饱和脂肪酸生物合成途径(ko01040),萜类生物合成途径(ko00900、ko00909、ko00902、ko00130)以及黄酮类生物合成途径(ko00941),这些途径大多以合成挥发性代谢物质为主,与神农香菊全株富含香气的表型特征及前人对神农香菊挥发性代谢物的研究相一致,表明较多的unigenes参与到了神农香菊浓郁香气品质形成中(图2C、图2D)。

图2 Unigenes长度分布及功能注释。
2.3 不同海拔种植点神农香菊基因表达分析
基于FPKM 结果,6 组样品中检测到的表达基因(3个生物学重复的FPKM 大于0)的数量均超过10万,且高海拔黄龙堰样本中表达基因的数量高于低海拔宋洛种植点的样本,其中高海拔茎(HS)中检测到的表达基因的数量最多(134,904个)(图3A)。韦恩图结果显示,共有71,918 个基因在所有样本中均有表达,不
2.4 差异基因筛选与KEGG通路富集分析
本研究基于FPKM,以低海拔花(LF)、叶(LL)、茎(LS)为对照组,以P-adj<0.05 和|log2FoldChange|>1 为标准筛选种植在黄龙堰和宋洛两个不同海拔区域神农香菊间的差异基因。结果显示在两个海拔神农香菊叶组织样本比较组HL vs LL 中筛选到的差异表达基因最多,共鉴定到8,037 个差异基因,其中在高海拔同海拔种植点不同组织样本中特异性表达基因的数量存在较大差异,其中低海拔叶(LL)中有4,993 个特异表达基因,高海拔种植点不同样本中检测到了441-643 个特异表达基因(图3B)。皮尔逊(Pearson)相关性分析显示所有样本3个生物学重复间及同一海拔种植点茎和叶样本间基因表达相关性较高。另外,不同海拔种植点同一组织样本间也呈现了较高的基因表达相关性(图3C)。主成分分析结果表明不同海拔种植点及其不同组织样本实现分离(图3D)。上述结果表明神农香菊在不同海拔种植点及不同组织间基因具有相似的表达模式,但同时也存在明显的差异。叶组织中下调表达的基因最多,有6,070 个,有1,967个基因上调表达。在茎组织样本比较组HS vs LS 中,一共鉴定到6,139 个差异表达基因,同样在高海拔茎组织中下调表达的基因最多,有3,925 个,而上调表达基因有2,214 个。在花组织样本比较组HF vs LF 中,一共筛选到1,328 个差异基因,其中在高海拔花组织中上调表达的基因为802个,而下调表达的基因有526个。分析结果表明神农香菊不同组织基因表达均受到海拔相关的环境因子变化的影响,其中叶和茎的响应程度最为明显。对于高海拔茎和叶,差异基因中表达下调的占多数,而高海拔花中表达上调的差异基因占多数(图4A、图4B)。
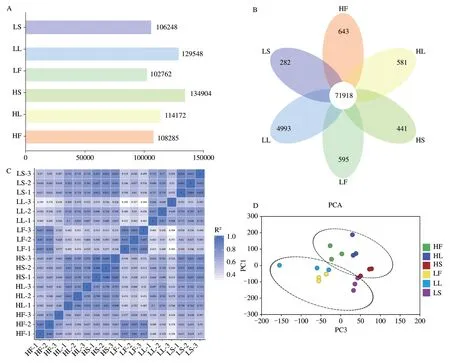
图3 不同海拔神农香菊基因表达量分析。

图4 不同海拔种植区神农香菊差异基因分析。
将所有的差异基因映射到KEGG 数据库中,以获得差异基因参与的代谢及信号转导通路。在两地神农香菊花、茎以及叶三个比较组中,差异基因主要富集到33个次生代谢途径,其中差异基因富集最多的是苯丙素生物合成途径(ko00940),三个比较组分别有14、73、53 个差异基因富集。其次为不饱和脂肪酸生物合成途径(ko01040),分别有3、75、29个差异基因富集。对于亚麻酸代谢途径(ko00592),三个比较组分别有12、42、27 个差异基因富集。在植物激素信号转导途径(ko04075)中,三个比较组分别有4、47、55个差异基因富集。富集到与萜类生物合成相关的途径共有5 条,包括萜类骨架生物合成途径(ko00900)、倍半萜和三萜生物合成途径(ko00909)、单萜生物合成途径(ko00902)和泛素酮和其他萜醌生物合成途径(ko00130)。分别有46、39 差异基因富集到脂肪酸生物合成途径(ko00061)以及黄酮类化合物的生物合成途径(ko00941)。在涉及植物生长发育等的途径包括植物激素信号传导、光合作用生物的碳固定作用、昼夜节律-植物和光合作用等途径中均有富集(图4C)。富集分析结果表明神农香菊对不同海拔生境的适应经历了复杂的生理生化过程,涉及多基因差异表达、多途径共同参与及多种代谢产物的积累。
2.5 挥发性萜类物质生物合成相关基因表达模式
研究表明,神农香菊中挥发性成分中萜烯类成分占比较大,主要以单萜和倍半萜及其含氧衍生物为主[4]。基于KEGG 富集结果在三个比较组中共发现30个差异基因与萜类生物合成有关,其中17个参与上游萜类骨架的合成,分别有8 个和4 个与下游倍半萜和单萜类生物合成有关。整体上,这些基因在不同海拔种植样本及不同组织样本间的表达模式存在较大差异,以低海拔神农香菊样本中表达量较高的基因数量最多。
在上游MEP 途径中,1-脱氧木酮糖-5-磷酸合成酶基因(1-deoxy-D-xylulose 5-phosphate synthase,DXS)和1-脱氧-D-木酮糖5-磷酸还原异构酶基因(1-deoxy-D-xylulose-5-phosphatereductoisomerase,DXR)被认为是萜烯类合成的关键酶。分析发现共有5 个DXS,其中 1 个DXS(Cluster-57284.37357)均在高海拔三个组织中上调表达,以高海拔花(HF)中的表达量最高;3 个DXS在不同海拔种植区的茎中表现出较高 表 达 量 ,其 中 2 个DXS(Cluster-57284.33469 和Cluster-57284.69971)表达模式相似,均在低海拔茎(LS)中表达量最高,而Cluster-57284.45777 则在高海拔 茎(HS)中 表 达 量 最 高 ;1 个DXS(Cluster-57284.53950)高表达出现在花器官中,以低海拔花(LF)中表达量最高。挖掘到1 个DXR(Cluster-57284.49820),发现其表达模式与上述1 个DXS(Cluster-57284.37357)相反,即均在低海拔种植样本三个组织中上调表达,以低海拔茎(LS)中表达量最高。MVA 途径中的7 个差异基因也受到不同海拔生境和不同组织发育的影响,其中,3 个酰基辅酶A-胆固醇酰基转移酶(acetyl-CoA C-acetyltransferase,ACAT)(Cluster-31241.0,Cluster-32214.1和Cluster-4297.0)和1 个羟甲基戊二酰辅酶A 合酶基因(hydroxymethylglutaryl-CoAsynthase,HMGCS)(Cluster-57284.909)表达模式一致,均在低海拔叶(LL)中上调表达且表达量最高。1 个ACAT(Cluster-57284.49820)和1 个磷酸甲羟戊酸激酶基因(mevalonate kinase,MVK)(Cluster-57284.8960)则在低海拔花(LF)中高表达。HMGCR 被认为是MVA 途径的 关 键 酶 ,共 鉴 定 到 1 个HMGCR(Cluster-57284.59325),其高表达出现在高海拔花(HF)、低海拔叶(LL)和茎(LS)中。
在参与下游倍半萜合成途径中,1 个法尼基焦磷酸 合 酶 基 因(farnesyl diphosphate synthase,FPDS)(Cluster-57284.14260)和 5 个大根香叶烯 D 合成酶基因((- ) -germacrene D synthase,GERD)(Cluster-15127.0, Cluster-43118.0, Cluster-57284.51368,Cluster-57284.57852和Cluster-57284.7379)均在低海拔 茎(LS)中 表 达 量 最 高 。 2 个GERD(Cluster-57284.7713和Cluster-57284.86323)均 在 低 海 拔 叶(LL)中表达量最高。在参与单萜合成途径中,2 个新薄荷醇脱氢酶基因((+)-neomenthol dehydrogenase,NADP)(Cluster-57284.40061和Cluster-57284.48736)显示在高海拔叶(HL)中表达量最高,而另外1 个NADP(Cluster-57284.48039)和1个香叶基二磷酸二磷酸 酶 基 因(geranyl diphosphate diphosphatase,GES)(Cluster-57284.30744)均在高海拔茎(HS)中表达量最高(图5)。

图5 萜类生物合成途径
3 讨论
神农香菊自然分布于海拔2,000 米以上的高海拔生境,常年雾多风大,空气湿度大,日照短而强烈、常年处于低温环境,导致其植株偏小和全株浓郁的香气品质。海拔相关的生态因子如温度、降水等会影响植物的生长发育以及次生代谢物的积累,而高山植物对环境变化尤其敏感[24],适宜在低温环境下生长的植物更容易受到温度升高的影响[25]。已有研究表明,低温会限制高海拔植物的生长繁殖[26],同时气候变暖在一定范围内也会刺激适宜在低温环境下生长的植物的生长和繁殖,但并不会促进其开花,而随着气候变暖的加剧和环境温度的持续升高,反而会抑制其生长[27]。这与前人开展的神农香菊引种试验相似,神农香菊从生境地引种到低海拔区域,其生长发育及挥发性香气均受到影响[7-8]。本文的生态因子分析表明,不同海拔分布点间温度的差异是主要环境因子(图1)。自然分布在高海拔如神农顶、天门垭等的神农香菊长期适应环境低温,而当神农香菊被移栽到低海拔种植点如宋洛后,相比高海拔移栽点黄龙堰,其受到温度的影响更强烈,从而导致宋洛生境的神农香菊的生长发育受到更大影响,相关的香气成分的积累也发生显著变化。除了温度之外,其他环境因子如降水和光照等也可能部分影响了移栽神农香菊的生长发育。如先前研究表明,降水量的变化对植物的物种丰富度、植被覆盖率以及生长高度具有显著影响,降水量减少会抑制植物的生长,降水量增加在一定程度会促进植物的生长以及生物量的积累[28]。不同波长以及强度的光照是植物光合作用必不可少的非生物因素,过度的光照可能使叶绿体的光合反应中心失活或受损,引起光抑制,也可能降低植物的生长[29-30],然而光照不足同样也会影响植物的生长[31]。
对于非模式植物,从转录组数据中鉴定与次生代谢产物生物合成途径相关的基因是一种便利的方法。在本研究中,从18个神农香菊转录组数据中共鉴定到695,919个表达基因,其中在不同海拔种植区同一组织样本之间共筛选得到13,431 个差异表达基因。两两比较进一步发现,低海拔茎和叶样品中上调表达的基因数相较高海拔茎和叶样品更多,而高海拔花中上调表达的基因数高于低海拔花(HL vs LL:1,967 个上调/6,070 个下调;HS vs LS:3,925 个上调/ 2,214 个下调;HF vs LF:802 个上调/526 个下调)。差异基因富集分析得到的通路主要包括生长发育及次生代谢相关途径,如植物激素信号传导、光合作用生物的碳固定作用、萜类生物合成、苯丙素生物合成、脂肪酸生物合成及黄酮类化合物生物合成等。植物激素信号转导在植物生长发育及响应逆境胁迫中发挥重要作用,当植物体处于逆境中,可通过信号转导等多种分子机制调控自身代谢和生理活动响应胁迫从而维持生命活动的进行[32-33]。次生代谢物的产生和积累可有效帮助植物体适应环境变化并抵御胁迫[34-38]。这提示神农香菊可能通过调节参与复杂生理生化过程的基因差异表达,从而适应高海拔生境并响应生境改变而产生的非生物胁迫。
在低海拔区域引种扩繁神农香菊,在保证其正常发育的情况下保留浓郁香气品质,是神农香菊资源量扩大和新品种培育的重要目标之一。萜烯类物质是植物产生的化合物中最为丰富的一类,不仅参与非生物胁迫的响应,同时也是神农香菊挥发性香气中的重要组成部分。前人研究发现,生境改变后会引起(z)-B-金合欢烯、大根香叶烯D、芳樟醇等萜烯类物质的含量变化[8]。为此,本研究从不同生境神农香菊转录组样本中进一步挖掘参与萜烯类生物合成途径相关酶基因。结果共筛选得到30 个差异表达基因参与萜类生物合成。DXS、HDR及DXR已被证实是 MEP 途径中的关键酶,HMGCR是MVA 途径上的关键酶[39-41]。DXS、DXR已被证明能提高植物对非生物以及生物胁迫的耐受性[42],HMGCR也被证实在植物生长发育和应对各种环境胁迫方面起着重要作用[43-44]。本研究共挖掘到 5 个DXS,1 个DXR和 1 个HMGCR,其中 2 个个DXS(Cluster-57284.37357、Cluster-57284.45777)、2 个NADP(Cluster-57284.40061和Cluster-57284.48736)和1 个GES(Cluster-57284.30744)基因在高海拔组织中上调表达,这与前人研究发现的樟脑、β-蒎烯、1-甲基-4-(1-乙酰氧基-1-甲基乙基)-环已-2-烯醇等物质因生境改变导致的含量变化趋势一致;相反,多个差异表达基因在低海拔组织样品中上调表达,包括3个 DXS(Cluster-57284.33469 和 Cluster-57284.69971和 Cluster-57284.53950) 、 1 个 DXR (Cluster-57284.49820)、3 个ACAT(Cluster-31241.0,Cluster-32214.1和Cluster-4297.0)、1 个HMGCS(Cluster-57284.909)、1个FPDS(Cluster-57284.14260)、7个GERD(Cluster-15127.0,Cluster-43118.0,Cluster-57284.51368,Cluster-57284.57852、Cluster-57284.7379、Cluster-57284.7713和Cluster-57284.86323)均在低海拔组织样品中表达量最高,这与前人研究发现的月桂烯、环氧芳樟醇、(z)-B-金合欢烯等物质因生境改变导致的含量变化趋势一致,表明这些基因可能在神农香菊香气成分合成中发挥重要的作用,并通过基因表达量的变化促进代谢物的积累以适应不同生境。
萜类化合物是植物产生的无数化合物中最大和最多样化的化学物质类别,在植物的生长发育以及环境适应过程中具有重要的保护作用[45],马银花作为在低海拔适应性广的杜鹃栽培种,基因组中含有比高海拔杜鹃栽培种更多的萜类合酶基因,这些基因参与了倍半萜以及单萜的生物合成,对马银花更好地适应低海拔环境具有重要作用[46]。鸡爪槭中单萜类物质的排放量随着海拔降低,温度升高而升高[47]。基于环境温度变化,根据物种不同,平均环境温度升高1℃,花中萜烯的释放速率会增加0.03-1.4倍以对应环境温度升高的影响[48]。葡萄中的单萜类物质的积累与光照有关,这与葡萄中VvDXS2和VvDXR基因在不同阳光照射下的表达量有关[49]。这提示神农香菊在低海拔受到了温度以及光照的影响,促进萜类物质的产生以适应从高海拔移植到低海后的环境变化。
4 结语
神农香菊作为一种应用广泛的高山香料植物,其生长发育以及次生代谢物的积累极易受到环境的影响。基于生态因子调查发现,神农香菊可能更容易受到环境温度与光照的影响。对不同海拔神农香菊转录组进行比较分析发现,差异表达基因主要富集在次生物生物合成途径如:萜类、苯丙素类、黄酮类、脂肪酸以及不饱和脂肪酸类。除此之外,差异表达基因也较多富集在植物激素信号传导、光合作用生物的碳固定作用、昼夜节律-植物和光合作用等途径中,大多差异基因在宋洛神农香菊样本中表达量较高,可能是由于神农香菊种植在低海拔区域,受到温度、光照等胁迫而诱导了相关基因的表达,以帮助神农香菊抵御环境胁迫。综上,本研究发现的差异表达基因涉及的复杂生理生化过程及代谢通路,进而形成神农香菊响应高海拔环境和生境变化的适应策略,其分子调控机制有待进一步探索,本研究为深入研究神农香菊不同海拔适应机制及新品种培育提供数据支撑。

