组学技术在中药种质资源遗传评价与创新中的应用*
刘义飞,胡志刚,黄必胜,陈士林
(1. 湖北中医药大学药学院 武汉 430065;2. 中国中医科学院中药研究所 北京 100700)
我国中草药野生资源十分丰富,支撑着中医药事业的千年传承和未来发展。中药种质资源是国家战略资源的重要组成部分,强化我国中药种质资源的保护、评价与应用对中医药相关事业和产业的发展具有重要意义。现代测序技术和分子检测手段的飞速发展促进了以基因组学研究为基础,涵盖转录调控、蛋白翻译、代谢合成等多层级组学研究方法和技术体系的集成,并成为现代作物种质资源评价与创新的重要工具,推动相关基础和应用研究的开展。加强组学相关先进技术在中药资源评价与创新中的应用,有利于推动传统中医药研究的现代化,也是未来我国中医药事业继续保持领先并走向世界的重要着力点和支撑点。
湖北省地处华中腹地,境内地势西高东低,拥有武陵山、秦巴山、大别山、幕阜山等众多山川汇集,形成“七山两田一分水”的总体格局[1]。湖北地形地貌和气候条件的多样性造就了省内丰富的中药材野生资源。同时,湖北是我国的药材主产区之一,悠久的中药材栽种历史产生了大量的人工繁育和驯化的中药种质。本文就中医药产业发展的种质资源源头工作进行梳理,对组学技术在中药种质资源评价与创新中的应用进行总结,并以湖北为例介绍了相关的研究案例,以期为我国区域性中药种质资源的保护、评价和应用提供思路和方向,推动地方中药源头产业的高质量发展。
1 中药种质资源的概念及遗传评价
1.1 中药种质资源的概念
中药种质资源又叫中药遗传资源,是传统中药资源中具有生物属性的药用植物或动物其亲本可遗传给子代的遗传物质和活体材料的总称[2-3]。中药种质资源的表现形式可以是一个群落、一个药用植物或药用动物个体,也可以是相关的组织器官或离体细胞等。中药种质资源是中药材进行新品种选育、改良与创新的物质基础,也是研究相关中药基原物种起源、进化和多样化等理论的材料依据。
类似于作物,中药种质资源既包括物种所在属或更宽泛分类单元内可自由有性交配的资源个体合集,特别是大量的野生动植物资源,又包括育种者人工选育或创制的资源,以及引种驯化和商业化栽培的品种品系及其替换者[4]。为了保证传统中药基原物种的纯正性和稳定性,中药种质资源的创制禁止人工干预产生多倍体或者单倍体种质,同时不同基原物种的种间杂交或转基因品种也不应出现。以药用物质成分提取为主要目标的宽泛中药种质资源则不受此限制。
从神农氏遍尝百草到李时珍编撰医药巨著《本草纲目》,历史上中草药的采集和利用以野生自然资源为主,少有人工选育和栽培种质的出现。近现代以来,随着中医药的普及和中药材市场需求的增加,催生了规模化中药种植业的发展,人工选育和创制的中药种质逐渐增多,但多数仍为野生资源的简单人工驯化或者“野转家”的过渡类型。随着资源评价与创新活动的加强,中药人工培育和创制种质以及外源种质的引入驯化份额有望迅速提升,成为未来中药源头产业发展的主要支撑。
1.2 中药种质资源的遗传评价
中药种质资源的遗传评价是在弄清其身份和来源信息(包括起源出处、地理和生态信息等)的基础上,对其遗传多样性水平和变异特征进行全面评估,以及对相关的内在基因型、基因或者单倍型与外在表型和环境之间的关系开展研究[5-6]。有效的种质资源评价是对其进行遗传育种和科学利用的前提,不仅有助于发掘和利用有用遗传资源,同时还可以预测未充分利用资源的遗传潜力和育种应用价值,发现未知或稀有等位基因及其相关的独特表型[7-8]。
对种质库中保存的中药种质资源开展全面的遗传评价也是科学合理的制定资源保育和管理策略的基础。收集管理的种质多具有不同的遗传组成、进化起源关系和遗传混杂程度,获取这些遗传信息才能对资源类型进行有效划分(如纯种、杂交种质的区分等),制定资源的分类管护和保存办法,最大化其长期利用价值[5]。基于资源遗传多样性的全面评估,还可以有效剔除冗余种质,构建核心种质(core collections)资源库,在经费和人力有限的情况下平衡种质资源长期保存利用与高投入维护成本的矛盾[6]。
2 组学技术在中药种质资源评价与创新中的应用
2.1 组学技术简介
组学技术的诞生源自基因组学研究的开展。基因组学是对生物物种全部基因和相关遗传元件组成进行集体表征、定性与定量研究和比较分析的一门交叉生物学科。1977 年,Sanger 等发明了双脱氧链终止法测序技术,即第一代DNA 测序技术,并率先开启了首个生物物种噬菌体φX174 的基因组测序和组装注释[9]。此后,以Illumina 平台为代表的二代高通量测序技术和基于PacBio 与Oxford Nanopore 等平台发展的新一代长读长测序技术迅速兴起,推动了生物物种基因组的高质量组装和注释,基因组研究也从单个个体的“草图”时代走向更高完整度和更多个体的比较与功能基因组学研究阶段。
随着测序及核磁共振、液质或气质联用等高灵敏度、高通量和高分辨率技术平台的发展和综合运用,产生了大量在基因组研究层级之上的转录组、蛋白质组和代谢组等多维度组学数据[10-11]。与此同时,生物信息学分析方法的发展促进了多组学大数据的整合,通过计算预测、数学模拟与网络交互分析,并结合实验性验证等推动对复杂生物学现象和生物表型及适应性特征的解析[11-13](图1)。多组学整合技术的应用关键在于不同组学数据的关联性分析和相互验证。对作物种质资源而言,高通量表型组数据的获得可进一步推动基因型和表型数据的关联,促进对复杂性状相关基因、调控元件和单倍型资源的挖掘与应用[5]。

图1 多组学整合分析技术示意图(修改自Aizat等[11]图1)
多组学技术可以融合应用到中药种质资源遗传评价与创新的各个方面,包括中药种质资源的起源、演化和分类鉴定研究,资源多样性评价与核心种质筛选,中药种质适应多样化环境的分子遗传机制解析,重要表型或天然产物生物合成相关的基因资源挖掘与应用,基于基因型-表型关联分析的基因组选择育种以及基因编辑技术相关的种质创新等。
2.2 中药种质资源的起源、演化和来源鉴定
中药种质资源多具有复杂的起源和进化关系,弄清不同资源的身份及种间或种内生态型间的遗传关系是进行种质资源科学收集和育种利用的前提。组学技术的发展与应用为中药种质资源的鉴定和进化发育关系研究提供了可靠的手段。在资源鉴定方面,由传统DNA 条形码[14]发展的基于全叶绿体基因组的超级条形码技术[15]在近缘中药种质鉴别中显示出更好的效率和准确度。特别是对复杂样本大规模平行测序的开展促进了整叶绿体基因组的序列比对,导致基因组密度高且分布广泛的单核苷酸多态性(single nucleotide polymorphism, SNP)标记的广泛应用,极大的提升了资源分类鉴定的精确性[16]。如一项对种属关系比较复杂的龙胆属药用植物的研究中,利用叶绿体基因组超级条形码,胡海栗等[17]对4 种滇产龙胆属种质类群进行了精确的区分,获得100%的物种单系分支支持率。
以叶绿体或核基因组为基础发展的系统基因组学可进一步揭示复杂资源类型的进化遗传关系[18]。如最近利用系统基因组学方法对30 个柑橘属野生和栽培品系种质的研究表明,多数资源类型是在宽皮橘、柚和香橼等三个大类约10 个左右祖先物种之间通过广泛的杂交渐渗和网状进化而来,不同的进化起源和遗传组成最终决定了柑橘资源的表型多样化和生态适应性差异[19]。随着中药种业和种植业的发展,一些种质资源的人工引种驯化和跨区域交换频繁发生,对这些中药种质资源的产地溯源和原始来源确认可采用基于多遗传位点变异分析的群体基因组学方法,结合相关的遗传聚类和分配分析,追溯种质资源的原始地理来源和遗传混杂程度[20-21]。在代谢组层面,靶向和非靶向代谢组学数据可为资源的分类鉴定提供额外的佐证[22]。如在枸杞种质的产地溯源研究中,便结合了代谢组数据以及同位素和矿质元素的综合分析[23]。
2.3 遗传多样性评价与核心种质筛选
遗传多样性是生物稳定的基石,它使生物物种得以适应气候变化和新型病虫害等环境变化。中药种质资源的遗传多样性水平也是其遗传育种和改良的基础。传统的分子标记技术如微卫星多态性(simple sequence repeats, SSR)等由于遗传位点有限,在资源遗传评价中所获取的群体遗传信息通常较少。随着组学技术的发展,简化基因组测序(Reducedrepresentation genome sequencing, RRGS)[24]、转录组测序(RNA sequencing,RNA-seq)[25]或者整基因组浅层重测序(genome skimming)[26]等可捕获基因组大量的遗传变异信息位点,全面提升种质遗传多样性水平的评估能力和对稀有等位基因或等位基因组合发现的概率,并增强对同质或遗传冗余样本的甄别效率,促进资源的有效管理和利用。在水稻[27]、小麦[28]、玉米[29]、大豆[30]等作物中已经开展了大量的基于重测序的群体遗传多样性评价及相关的种质特征变异研究,但中药种质资源相关的研究还比较少见。
核心种质的概念最早由Frankel[31]于1984年提出,并由Brown[32]进一步补充和完善,旨在用少量的核心种质样本(如5-30%)保存约70%以上的遗传多样性信息。传统作物的核心种质筛选和核心种质库构建,主要依赖于物种种群的遗传多样性数据。对中药种质资源而言,在评估其遗传多样性水平的基础上,整合代谢数据构建核心种质库,可以更加全面的反映资源的品质特征和差异性[33]。因此,对中药种质资源构建核心种质库的一般方法可如图2 所示,即利用基因组或转录组数据起源的批量SSR或SNP位点全面评估种质的遗传多样性水平和遗传结构变异特征,与此同时进一步获取样本的代谢物多样性数据,基于两类数据的整合采用最小距离逐步取样法(least distance stepwise sampling, LDSS)[34]等抽样方法构建不同抽样比例的初级核心种质库,对这些初级库种质的遗传多样性保留情况作进一步验证,进而决定最终的核心种质库资源,并形成育种应用。
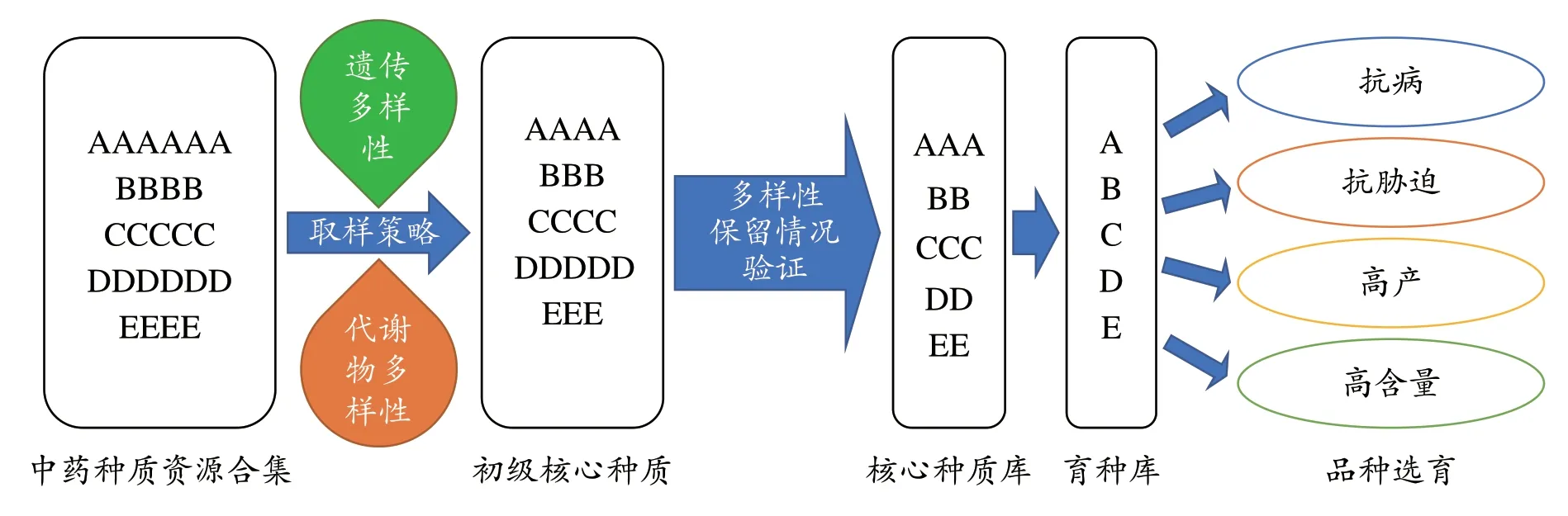
图2 中药种质资源核心种质库构建策略
2.4 中药种质资源响应环境变异的分子遗传机制
中药种质资源的特征变异与其对多样化的生态环境长期适应性进化有关,相关的遗传与环境的互作还具有明显的时间和空间属性。一些独特的表型特征或次生代谢物的产生只发生在物种特定的生长发育阶段,或者物种对特定环境或生物与非生物压力胁迫响应的时候[5]。对处于时间序列或不同生态环境的种质资源开展整合的转录组和代谢组分析可精确的捕获这些具有时空属性的种质表型并研究其内在的分子遗传调控网络[35-36]。如一项对盐碱地、草地和沙漠三种不同环境的肉苁蓉生态型的整合代谢组和转录组研究表明,总共获得的578 种代谢物中约有一半存在生态型间的差异表达,其中苯乙醇苷类化合物2'-acetylacteoside 为标志性差异成分,在盐碱地生长的肉苁蓉生态型中呈现较高含量,通过转录组进一步揭示了相关该类成分的基因表达调控基础[35]。在更微观的程度如植物种质的组织和细胞微环境,新型组学技术如空间转录组和代谢组则可通过单细胞测序、高通量质谱分子成像技术等捕获样本组织细胞代谢物产生和累积的时空动态规律,促进种质相关特异表型和基因的功能的研究[37-38]。
药用种质资源相关的环境微生物群体如根际微生物和植物内生菌的多样性和特异性对其养分的循环、生长发育、产量品质形成、病虫害防御等也起到了重要作用[39-41]。在药材的栽培过程中,随着种植年限的增加会导致根际微生物群落多样性的失衡,成为连作障碍产生的潜在因素之一[42]。宏基因组学相关的技术方法是表征中药种质环境微生物多样性和功能的重要手段[43]。早期的微生物扩增子(如16S/18S rDNA等)测序多基于Sanger 技术,主要研究群落的物种组成、物种进化关系及多样性。而基于二代高通量测序平台的宏基因组测序在提升物种鉴定精度和丰度的基础上,可进一步进行基因和功能层面的深入研究。目前,宏基因组测序及相关分析方法已广泛应用于调查药用生物外部的生长环境和内生微生物群落的多样性组成,促进对中药资源的评价及其关联的微生物群体与生态环境因子的互作关系的理解[44]。新的长读长测序技术可进一步克服二代测序读长短、比对唯一性差的弱点,提升微生物基因组的拼接效果,促进更多微生物类群的发现和分类鉴别[45]。
2.5 表型与天然产物生物合成相关的基因资源挖掘
重要特征性状关联基因的发掘是作物分子遗传育种的关键。多数中药种质资源会产生复杂的次生代谢产物及其衍生物如青蒿素、紫杉醇、长春碱和小檗碱等,这些化学物质是新药研发的重要源泉。挖掘这些天然产物生物合成相关的基因也决定了中药种质资源的遗传育种价值。目前作物基因资源的挖掘主要有正向遗传和反向遗传等方法[5]。基于方便的基因型和表型数据,整基因组范围的关联分析(genomewide association studies, GWAS)是常用的正向遗传学研究手段,广泛用于目标性状关联基因的鉴定与分析[46]。随着代谢组学的发展,将代谢组数据作为表型的 mGWAS(metabolome Genome Wide Association Study)分析推动了代谢物精准调控基因的发掘,是当前作物种质资源遗传评价的新方法[47]。如一项关于番茄风味的研究中,研究人员基于基因组、转录组和代谢 组 数 据 进 行 mGWAS 和 mQTL(metabolome quantitative trait locus)分析,成功定位了番茄风味相关的基因,并提出遗传改良番茄风味的方法路径[48]。
随着大量中药资源物种参考基因组构建的完成[49-52],相关的基因组结构和基因信息的累积可推动从基因到性状的反向遗传学研究的开展。在组学层面,种质资源不同组织部位和发育阶段的转录组比较及基于表达的数量性状位点eQTL(expressionquantitative trait locus)作图有助于推动相关表型变异内在分子机制的理解,为表型变异关联的新等位基因的发掘和功能验证提供可能[53]。在药用物种次生代谢产物如萜类、生物碱等的生物合成过程中,一些通路基因往往以生物合成基因簇(biosynthetic gene clusters, BGCs)的形式存在[50],基因组的构建则极大的方便了这些基因簇基因的批量挖掘,包括基于生物信息学方法的同源序列比对高通量挖掘有用基因[50,54]。大量天然产物生物合成相关基因的获取和功能验证也催生了合成生物学和微生物代谢工程方法学的建立,相关的天然产物人工合成已成为新兴的热门研究领域[54-55]。
对于基因多样性的研究,一个物种特别是资源分布范围较广的生物类群,单一个体的基因组信息不足以表征其物种所有的基因资源。对同一物种或者近缘种复合体多个代表性个体分别从头组装并构建泛基因组(pangenome)是全面理解其资源遗传变异的重要手段[8,56]。泛基因组可以识别物种的核心基因(core genes)和非核心基因(dispensable genes)集,后者对于一些个体或生态型特有的新等位基因或者稀有等位基因的挖掘具有重要价值[56]。
2.6 基因组选择育种与种质创新
中药种质资源特别是多数药用植物为多年生物种,生长周期长且遗传背景复杂,传统的育种方法耗时费力,效率低下。随着组学技术的发展,基于分子标记甚至整基因组数据信息开展药用植物的分子遗传育种可大大提升育种效率,并为定向提升药用植物有效成分的分子设计育种带来了新希望[57]。传统的分子标记辅助选择主要基于遗传图谱或者物理图谱的构建挖掘性状紧密连锁的遗传位点如QTL 等。而高通量重测序技术可产生大规模的SNP 标记,促进高密度遗传图谱的构建,推动标记与性状的精确关联分析,提升分子辅助选择育种的效率[58]。面多大量未知属性的种质资源,利用基因组信息的基因组选择(genomic selection,GS)是进行资源遗传评价和育种潜力评估的有效方法[59]。该方法基于小样本群体训练居群(training population)的基因型与表型关联分析计算育种值(breeding value)模型,进而利用该模型预测其他大样本基因型的表型特征,从而降低资源评价和育种的成本,缩短育种年限[59]。
针对遗传基础较为薄弱的种质资源,基因组数据的丰富和诸如CRISPR/Cas 等基因编辑技术的日趋成熟为种质资源批量突变体库的构建提供了可能,推动相关基因的功能验证、特异新种质的创造和遗传改良[60-61]。对中药种质资源,在不改变原有药用成分和基原物种遗传稳定性的基础上,利用基因编辑技术在基因组水平上对相关目标基因DNA 序列进行定点改造,可以提升种质资源的遗传特性如抗虫抗病能力和除草剂抗性,或者加速作物驯化与定向育种[62]。以药用成分研究为主的中药种质,对代谢物生物合成通路基因的编辑可以有效的改变其物质成分的含量。如Zhou 等[63]利用 CRISPR/Cas9 系统对丹参RAS基因的编辑降低了其表达量,导致迷迭香酸、紫草酸B含量的降低,而迷迭香酸生物合成前体物3,4-二羟基苯乳酸的含量则显著升高。
3 湖北中药种质资源遗传评价相关的组学研究
3.1 湖北中药种质资源概况
湖北药用动植物种类繁多,以秦巴山、武陵山、大别山、幕府山区等为集中分布区(表1),还包括“中草药王国”神农架等关注度极高的热点区域[64]。根据前期中药资源普查结果,湖北的中药资源总数约居全国第五位,中药材产量居全国第七位[1]。湖北大宗中药材和道地品种较多,其中蕲春蕲艾、英山苍术、罗田茯苓、利川黄连、麻城菊花、潜江半夏、京山乌龟、通城金刚藤、巴东玄参、南漳山茱萸和神农架竹节参、党参、七叶树等综合品种被湖北省政府纳入“一县一品”试点品种管理(表1)。湖北的中药野生种质资源和人工种植养殖品种还极具地方特色,一些动物类药材如蜈蚣、水蛭、蕲蛇、龟甲等在全国中药材市场举足轻重[65]。特殊多生物共生药材如五倍子、天麻等在湖北省已形成完善产业链[66]。

表1 湖北省五个主要中药材产区及代表性药材
3.2 代表性中药种质资源相关研究例举
3.2.1 黄连
在中国药典中,中药黄连的基原植物包括黄连(Coptis chinensisFranch.)、三角叶黄连(C. deltoideaC.Y. Cheng et Hsiao)或云连(C. teetaWall.)。其中黄连为广布种,湖北的利川和竹溪等为黄连的道地产区之一,具有丰富的野生和栽培种质。黄连的主要药用成分为原小檗碱类(protoberberine-type)生物碱,包括小檗碱、黄连碱、药根碱、巴马汀、表小檗碱等。He 等[67]对黄连和云连调查了前述五种主要生物碱成分的组织差异性分布,结果表明表小檗碱仅存在于黄连中,同时这些生物碱主要存在于两种植物的须根和根茎中;整合转录组和酶活分析进一步鉴定和验证了两个去甲乌药碱(norcoclaurine)6-O-甲基转移酶基因(Cc6OMT1和Cc6OMT2)和一个去甲乌药碱7-O-甲基转移酶基因(Ct7OMT)的功能,这些基因均为黄连生物碱合成通路的关键基因。Liu 等[51]测序组装了黄连染色体水平的基因组,预测和注释了约41,004 个蛋白编码基因。在此基础上,利用同源基因序列比对的方法,在黄连基因组上鉴定和挖掘了绝大多数原小檗碱类生物碱生物合成相关的基因。特别的,黄连中该类生物碱的多样化修饰与CYP719 家族基因编码的酶紧密相关,如小檗碱生物合成途径的一个该家族关键基因Cch00017825编码的酶可能具有催化不同底物的多样化修饰。这些生物碱生物合成相关基因资源的获取对黄连种质的遗传育种和改良具有重要意义。
3.2.2 独活
药材独活为伞形科植物重齿毛当归(Angelica biserrata(Shan et Yuan) Yuan et Shan)的干燥根,始载于《神农本草经》,因“一茎直上,不为风摇”而得名。湖北长阳及周边地区的“资丘独活”为湖北道地药材,已获得国家地理标志产品进行保护。目前独活尚无基因组数据,相关的分子标记也较少,为其种质资源的遗传评价带来困难。Liu等[68]对独活的根、茎和叶等组织的混样开展了转录组测序,并基于转录组数据开发了多态性高的SSR 分子标记,对来自湖北的208 份独活药材种质资源进行了全面的遗传多样性分析和6种香豆素类化合物的含量成分测定。基于获得的样本遗传多样性和代谢物含量数据,该研究进一步利用LDSS取样法构建了资丘独活的核心种质资源库,筛选出42份核心种质,为独活新品种的选育和应用奠定了基础。
3.2.3 野菊
野菊(Chrysanthemum indicumL.)为菊科菊属多年生草本,广泛分布于我国从华南到东北的广大地区,湖北大别山地区为野菊花药材的道地产区。野菊相关种质资源富含萜类、烯炔类和黄酮类化学成分,但由于野菊种内种间杂交频繁,资源的遗传背景十分复杂,为其资源遗传评价带来较大的挑战。目前野菊的基因组尚未公布,但其近缘种如菊花脑[52]、甘菊[69]等的基因组已经发布。通过对菊花脑基因组的分析发现,其萜类物质生物合成相关的关键基因如萜类合成酶基因(TPS)和P450类基因(CYP)以TPS/CYP 基因簇的形式存在[70],且这些基因簇的组合类型与其他植物中的已有类型存在一定差异,体现出物种或资源特异性[52]。基因簇的研究开启了野菊及其近缘种质萜类合成相关基因资源的挖掘与利用,如最近的一项研究对菊花脑、野菊及其变种神农香菊(C. indicumvar.aromaticum)进行了比较转录组学分析[71]。神农香菊为野菊的变种,独特分布于湖北神农架地区,因富含挥发性萜类物质而全株具有浓郁的香气。该研究对三种资源类型的茎、叶和根组织的基因表达谱差异进行了研究,发现22个差异表达的基因相关萜类骨架形成以及183 差异表达基因与萜类物质成分多样化有关。这些结果为野菊相关种质资源基因资源的挖掘和应用提供了参考。
3.2.4 天麻
天麻(Gastrodia elataBl.)为兰科天麻属植物,其药材目前为药食同源试点品种,市场应用潜力巨大。湖北省武陵山、秦巴山和大别山区等是我国天麻野生种质资源重点分布区和人工栽培种质繁育核心区。天麻为菌异养型植物(Mycoheterotroph),无根无叶不能进行光合作用,生长主要依赖共生蜜环菌供给营养,同时其种质的萌发需要小菇属真菌侵染种胚提供营养。Yuan 等[72]利用二代高通量测序报道了天麻的基因组序列,发现相关于光合作用的基因在天麻基因组中普遍丢失,同时一些潜在分解菌丝体的酶家族基因如编码糖苷水解酶和脲酶的基因发生了明显的扩张。Xu 等[73]进一步组装了天麻染色体水平的基因组,并与四种兰科菌异养型植物、三种寄生植物及36种自养型被子植物进行了大尺度比较基因组学研究,结果表明约10%的保守同源基序在天麻的进化过程中发生了丢失,促进其异养生活史的形成。这些研究为后续天麻资源的系统遗传评价与育种应用提供了组学数据支撑。
3.2.5 蜈蚣
蜈蚣是湖北代表性道地动物药材,中国药典记载的蜈蚣基原物种为少棘巨蜈蚣(Scolopendra subspinipes mutilansL. Koch),但少棘巨蜈蚣与其他蜈蚣类型仍存在进化关系不清,资源利用混杂等问题。Hu 等[74]测序组装了少棘巨蜈蚣的线粒体基因组,并与七个近缘蜈蚣的线粒体基因组进行了系统基因组学的比较分析,结果发现少棘巨蜈蚣的线粒体基因组存在广泛的基因组重排,且在进化分类上少棘巨蜈蚣与同属的哈氏蜈蚣(S.subspinipes dehaani)及棘盲蜈蚣属(Scolopocryptops)物种具有较近的亲缘关系。在蜈蚣种质资源的评价中,毒液所包含的蛋白和肽类的多样性差异是重要的代谢表型特征。Zhao等[75]利用转录组和蛋白质组分析,对少棘巨蜈蚣毒液和躯干组织中的毒素类蛋白多样性进行了研究,在两个部位中分别发现923 和6736 种不同的多肽成分。蛋白质组分析进一步识别了1369 种独特的蛋白成分,其中100 种在毒液和躯干组织中具有共表达,包括40 种毒素类蛋白。这些研究结果可为蜈蚣种质资源的保护和分类评价提供依据。
4 总结与展望
随着测序技术和高通量分子及表型检测平台的发展,组学技术在大量作物和园艺植物种质资源遗传评价与创新中发挥着越来越重要的作用。相比之下,从湖北省目前的相关研究进展可以看出,组学技术在我国地方中药种质资源遗传评价中的应用还处于起步阶段,已有的研究主要集中在物种基因组的解析以及部分基因资源的挖掘和功能验证。一些相关于中药种质评价的核心内容,如多样化种质资源复杂遗传背景的解析,大规模群体样本的遗传多样性分析和核心种质筛选,分子辅助新品种选育与种质创新等还缺乏大量组学技术的介入,急需加强。同时,已有的一些研究中相关的组学数据没有形成有效的联合分析,或者本身的关联性不强,体现不出组学技术对中药种质资源评价与创新的优势。
种质是现代农业的芯片,而中药材新品种则是中医药产业健康可持续发展的基石。只有不断的重视中药种质资源的保护、评价与创新这一中药材产业发展的源头基础,通过组学技术的广泛应用促进核心种质的筛选评价和中药材新品种的产出,才能推动整个产业的高质量发展。与此同时,先进技术的应用也有助于融合传统中医药与现代医学发展,促进产业发展过程中的标准化和规范化,推动中医药传承创新过程中的现代化和国际化进程。

