神农香菊自然居群遗传变异评价研究及核心种质筛选*
袁仁森,王 旭,张景景,森 林,董刚强,刘义飞**
(1. 湖北中医药大学药学院 武汉 430065;2. 安利(中国)植物研发中心 无锡 214115)
神农香菊(Chrysanthemum indicumvar.aromaticum)是菊科菊属野菊(C.indicumL.)的变种[1],因全株散发浓郁的香气而得名。研究表明,神农香菊具有较强的抑菌和抗氧化等药理活性,民间常用于清热解毒、清咽利喉、散风降压等[2]。神农香菊挥发油中富含α-侧柏酮、β-侧柏酮及龙脑等萜烯类化合物,含量较野菊和栽培药菊高,是菊属中罕见的珍稀天然香料资源植物[3]。此外,神农香菊还被用来提取精油和浸膏,广泛用于医药、食品、香精香料和化工等领域,同时也是观赏菊和药用菊芳香品种改良的重要种质资源,开发利用率高,应用前景广泛[4]。
神农香菊的自然分布范围十分狭窄,仅局限于中国神农架林区海拔2000 m 以上的高山区域。狭窄的分布范围导致其野生资源蕴藏量十分有限[5],特别是近年来随着神农香菊的市场需求增多,其野生资源破坏严重,生境破碎化加剧,严重影响了其自然种群的繁衍生息。目前,相关神农香菊的研究主要集中在对其次生代谢产物多样性的调查和功效研究[6-7],而对其自然分布范围内群体样本的遗传多样性水平和相关于生态地理环境的遗传结构变异缺乏系统的研究,不利于对其进行全面有效的资源保护和开发利用[8]。
遗传多样性是生物多样性的基石,决定了物种对外部生态地理环境的适应能力和进化潜力[9]。同时遗传多样性也影响药用植物次生代谢产物的多样性水平,相关合成通路遗传位点的等位基因变异,可最终影响代谢物合成的类别和水平[10]。目前,在农作物和园艺植物的资源评价和遗传育种工作中,基于群体样本开展遗传多样性评价和遗传结构分析已十分普遍[11-12],为相关的种质资源保护和开发应用做出了重要贡献。相比而言,药用植物特别是珍稀药用资源植物相关的研究还不充分。
在众多分子标记中,SSR分子标记因具有共显性、多态性高、重复性好等优点,以及能很好的区分纯合和杂合等位基因,在药用植物的种质资源鉴定、资源遗传多样性分析、分子辅助育种等方面有着广泛的应用[13],如最近Liu 等[14]用SSR 分子标记对湖北独活资源的遗传多样性全面评价和核心种质库构建,Wang 等[15]用SSR 标记开展芍药群体的遗传多样性和遗传结构的分析等。基于神农香菊全面的自然居群样本采集,本研究拟用SSR 标记对其自然种群的遗传多样性水平、遗传结构等进行全面的评价,并结合地理差异化样本的主要代谢成分多样性评估筛选核心种质,为该珍稀植物的资源保护和可持续开发应用提供基础数据支撑。
1 材料与方法
1.1 植物材料收集
本试验总共包括6 个自然居群共203 份样本,其中神农香菊样品有3 个居群共151 份,均来源于湖北神农架林区其自然分布区范围内(表1)。同时,还包括神农香菊居群邻近或混生的2 个居群共41 份疑似野菊样品,以及武汉市洪山区的1 个野菊居群共11 份样本作为对照参考。所有居群样本的采集按照个体间至少25 m 的间隔进行,同时记录采样地点的经纬度、海拔等信息。对应的部分活体样品种植于神农架林区中医药产业研究院科研大棚内供后续5个形态特征(株高、冠幅、叶长、叶宽、叶柄长)的描述分析和代表性代谢成分研究。叶片的形态检测取植株主茎靠近基部三片叶子的数据平均值。采集幼嫩植物叶片,用硅胶常温干燥,放置于阴凉干燥处保存备用。

表1 神农香菊和野菊居群采集地点信息
1.2 DNA提取和SSR位点筛选
基因组DNA 提取采用改良的CTAB 法[16],通过1%琼脂糖凝胶电泳检测提取的DNA的质量和纯度,并使用Nano Drop2000分光光度计测定每个DNA 样品的浓度。检测合格后,将每个DNA样品的最终浓度稀释至约50 ng·μL-1,用于后续PCR扩增实验。
本研究基于神农香菊的近缘物种菊花脑的基因组信息[17]和神农香菊的转录组数据[18],利用MISA 软件[19(]http://pgrc.ipk-gatersleben.de/misa/)分 别 进 行 核基因组(G-SSR)和转录组(E-SSR)的SSR 位点筛选。得到的SSR 位点及侧翼保守序列批量导入Primer3 软件(https://sourceforge.net/projects/primer3)进行引物设计。所有实验用引物由生工生物上海股份有限公司合成。
SSR分析的PCR反应体系为10 μL,含DNA 2 μL、缓冲液混合物Mix 5 μL、正向引物0.5 μL、反向引物0.5 μL、Fam/Hex/Rox/Tamra0.15 μL、DDH2O 1.85 μL。PCR 反应程序为:①95℃预变性2 min;②95℃变性30 s;③55℃退火30 s;④72℃延伸30 s,循环35次;⑤72℃延伸2 min,最后4℃保存。
1.3 遗传多样性和遗传结构分析
使用POPGENE 版本1.3.2[20]计算居群样本的遗传多样性参数,包括等位基因频率、等位基因数(Na)、有效等位基因数(Ne)、观察杂合度(Ho)、期望杂合度(He)、香农信息指数(I)、基因多样性指数(H)、多态性信息含量(PIC)和固定指数(F)。利用NTSYS-pc 软件版本2.1进行非加权组平均法(UPGMA)聚类分析。使用STRUCTURE 版本2.0[21]确定样本的居群遗传结构,并使用GenAlEx[22]进一步进行分子方差层次分析(AMOVA)。
1.4 黄酮类和酚酸类成分分析
基于STRUCTURE 分析确定的样品遗传分组,对每组选择代表性纯合样品(Q>95%)进行5 种黄酮类(蒙花苷、木犀草素、木犀草苷、田蓟苷、香叶木素)和4种酚酸类(绿原酸、异绿原酸A、异绿原酸B 和异绿原酸C 的代谢成分分析。对每份样品依据茎、叶和花组织的不同,精确称量0.3 g 植物的组织干燥粉末,并在室温下用10ml 80%甲醇水溶液(v/v)超声提取60 min,超声结束后通过0.45 μm PTFE 过滤器过滤。成分检测选用配备SPD-20A 检测器和CTO-20A 恒温柱室的岛津LC-20AD HPLC 系统,并选用XB-C18 柱。使用二元梯度洗脱体系,其中流动相为乙腈-0.1%磷酸水溶液,检测波长326 nm,流速0.8 mL·min-1,柱温30℃,进样量20 μL。以5 种黄酮类和4 种酚酸类标准溶液的浓度为横坐标(x),峰面积为纵坐标(y),进行线性回归分析。检测限(LOD)和定量限(LOQ)分别在信噪比为3和10时确定。
1.5 核心种质库构建
核心种质的筛选采用最小距离逐步取样策略(the least distance stepwise sampling strategy, LDSS)[23]进行。基于遗传数据进行取样,不断删除遗传相似性大的种质,多次聚类直至获得第一个核心种质(占总种质资源的40%),再进行删除并逐步聚类依次得到剩下的核心种质(分别占总种质资源的35%、30%、25%、20%、15%、10%)。初步得到7 个不同比例的核心种质后,对其进行遗传多样性评价,结合遗传多样性保留情况选择最终核心种质。利用SPSS 软件对最终核心种质与原始种质的主要遗传参数值进行t 检验,检验核心种质的遗传保留情况。
2 结果与分析
2.1 表型性状
基于样品的5 个形态特征检测数据进行PCA 分析,其结果如图1所示。PCA 分析的结果表明,神农顶(SND-CI)和天门垭(TMY-CI)的疑似野菊样本聚在一起,与武汉的野菊(HS-CI)对照样本形态相似。红坪(HP-CIA)与天门垭(TMY-CIA)的神农香菊样本形态特征一致,两者与神农顶(SND-CIA)的神农香菊有部分重叠,但呈现一定水平的小生境形态分化。疑似野菊和神农香菊之间有明显形态差异(P<0.001)。

图1 神农香菊和疑似野菊样品表型性状的PCA分析
2.2 SSR引物筛选和多态性验证
总共获得PCR 扩增效果好、多态性高的SSR 引物21 对,包括 10 对基因组起源的 G-SSR 引物和 11 对源自转录组数据的E-SSR 引物(表2)。21 对引物在203份样本中共扩增出202 个等位基因,每个位点平均等位基因数为9.619 个。这些SSR 位点的PIC 信息指数均值为0.529,相应的其他遗传参数多样性水平也较高(表3)。比较分析表明,G-SSR 和E-SSR 的主要遗传多样性参数不具有显著差异(P>0.05)。

表2 21对SSR引物的序列信息

表3 21对SSR引物的遗传多样性
2.3 居群遗传多样性
神农香菊及其邻(混)生的疑似野菊居群样本的遗传多样性分析结果如表4 所示。结果表明,各研究的居群在主要遗传多样性参数水平上不存在显著差异。各居群样本的多态性位点百分率均较高(≥95.24%),其中神农架五个居群有中等程度的PIC 值(PIC<0.5),小于武汉洪山的野菊居群(HS-CI,PIC=0.58)。在其他参数上也呈现类似趋势,神农架5 个居群的遗传多样性小于洪山居群。整体而言,6 个居群的观测杂合度均小于期望杂合度,居群呈现一定程度的纯合子过剩。
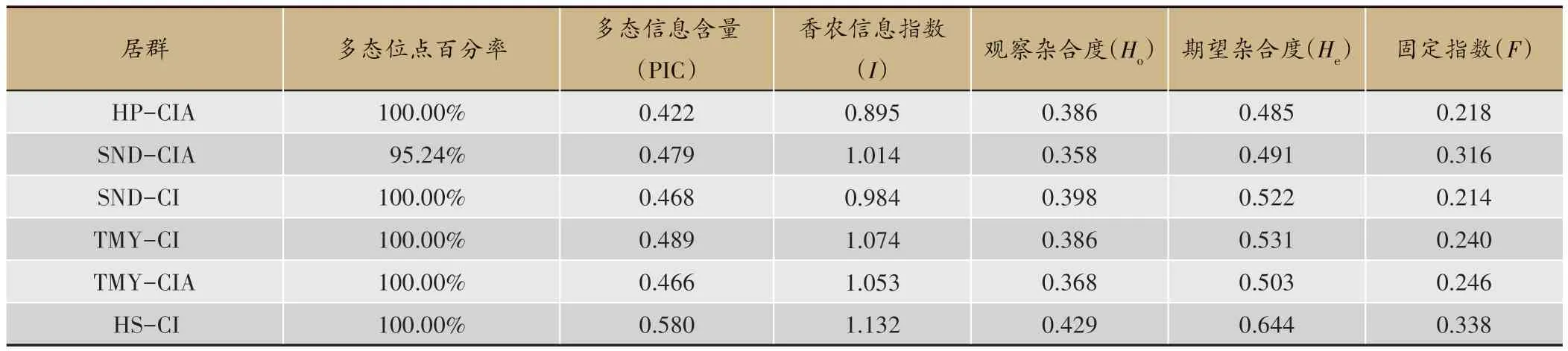
表4 6个居群的遗传参数
除去洪山野菊样本,神农架的5 个居群间基因流和遗传分化系数如表5 所示,各居群之间的基因流水平很高(Nm>1),遗传分化系数(Fst)较低(Fst<0.12)。SND-CI 和HP-CIA 的遗传分化系数最大为0.116,TMY-CIA 和SND-CIA 的遗传分化系数最小为0.025。分子方差分析显示,所有居群的遗传变异主要来源于居群内(92%)。

表5 居群间的基因流Nm和遗传分化系数Fst
2.4 居群遗传结构
对所有居群样本进行UPGMA 聚类分析和STRUCTURE 遗传聚类分析(图2)。UPGMA 树结果显示,洪山野菊(HS-CI)单独聚为一支,同时大多数神农香菊样本以及疑似野菊样本各自聚类,只有少数神农香 菊 个 体 如 TMY-CIA129、TMY-CIA176、TMY-CIA171、TMY-CIA183、TMY-CIA184、TMY-CIA185、TMY-CIA187 以 及 SND-CIA16、SND-CIA17、SNDCIA68 和少数疑似野菊个体如TMY-CI110、TMYCI111、TMY-CI112 以及 SND-CI80、SND-CI81 呈现相互居群样本混杂。

图2 6个居群样本的UPGMA聚类树和STRUCTURE分析结果。
STRUCTURE 分析结果表明,当K=2 时,洪山野菊(HS-CI)与其他居群样本具有明显的遗传分化;当K=3 时,神农顶和天门垭的疑似野菊样本(SND-CI 和TMY-CI)进一步从其他神农香菊样本中分离开来;当K=4 时,神农顶的神农香菊(SND-CIA)与天门垭和红坪的神农香菊(TMY-CIA和HP-CIA)则表现出微弱的遗传差异。
2.5 样本特征代谢成分的比较分析
基于STRUCTURE 分析结果,选择Q 值大于95%的纯合样本进行代谢成分检测分析。基于这一标准,总共选择的18 份样本分别来自神农顶(编号:SNDCIA31、SND-CIA32、SND-CIA36、SND-CIA38、SNDCIA40、SND-CIA41)和天门垭(编号:TMY-CIA152、TMY-CIA153、TMY-CIA154、TMY-CIA162、TMYCIA164、TMY-CIA169)的神农香菊以及两个地方的疑似野菊个体(编号:SND-CI82、SND-CI83、SND-CI84、TMY-CI99、TMY-CI101、TMY-CI103)。
利用HPLC 检测5 种黄酮类、4 种酚酸类成分在茎、叶、花三个部位的种类及含量差异如图3所示。不同的组织样本花(F)的代谢物的种类和含量明显高于茎(S)和叶(L),其中花检测出7 种成分,叶检测出5 种成分,茎检测出2种成分。而在同一组织部位中,神农香菊样本(SND-CIA 和TMY-CIA)检测的代谢物的种类高于疑似野菊(SND-CI 和TMY-CI),前者共检测出9种成分,而后者样本检测出4种成分。对神农香菊的同一组织如花,一些成分如异绿原酸A 和绿原酸在神农顶(SND-CIA-F)和天门垭(TMY-CIA-F)的样本之间也存在差异(异绿原酸A:P=0.0218;绿原酸:P=0.0219)。

图3 不同居群和组织器官样本的代表性代谢成分差异分析
2.6 核心种质筛选
基于LDSS 取样策略,不同取样比例下原始种质和7 个初步核心种质的遗传多样性参数如表6 所示。综合对比样本量大小和各个遗传参数的多样性水平排名,确定30%取样比例的45份样本群为最终的神农香菊核心种质候选。进一步对原始种质与30%抽样比例的核心种质的3 个遗传多样性主要评价指标Ne、I、H进行t检验,结果表明原始库与核心种质库之间不存在显著差异(表7),表明该核心种质库样本可以充分代表神农香菊原始野生种质的遗传变异水平。同时,核心种质库的样本分别来自神农顶、天门垭和红坪3 个不同采样点,在地理分布上也具有足够的代表性。将筛选的核心种质样本分别重新进行邻接树和STRUCTURE 聚类分析,结果显示各核心种质样本间具有清晰的遗传组成差异,样本基因型代表性较强(图4),基于核心种质材料的花中的代谢成分检测,与原始种质对比无显著性差异。
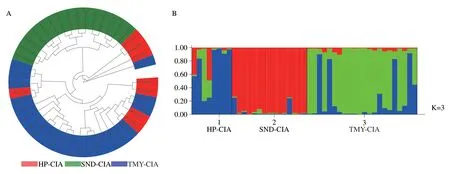
图4 基于核心种质库样本的UPGMA聚类树和STRUCTURE分析结果

表6 不同取样比例下神农香菊原始样本种质和7个初步核心种质的遗传多样性参数

表7 神农香菊原始种质和核心种质的Ne,I,H的t检验结果
3 讨论
本研究对采自神农架的神农香菊及其邻(混)生的疑似野菊样本进行了全面的表型、遗传和代谢成分分析,同时基于遗传信息和代谢数据筛选了神农香菊的核心种质。本研究所使用的21 对SSR 分子标记位点分别起源于已公布的菊花脑基因组数据和神农香菊的转录组信息。一般认为,物种基因组起源的SSR位点多为中性位点,较少受环境压力的影响,代表了中性进化的方向,而转录组起源的SSR 位点则易受环境影响,具有一定程度的选择效用[24]。因此,本研究整合了两种不同类型的SSR 标记位点,对神农香菊自然居群样本进行的遗传分析则相对较为全面性和代表性。
基于所有样本的5 个代表性形态特征分析表明,神农香菊和邻(混)生的疑似野菊样品在形态上具有明显差异,神农香菊的植株高度、叶片大小明显低于疑似野菊。同时,与对照样品武汉洪山野菊相比,即使神农架居群的样本数(192 株)远远高于洪山居群(11 株),神农架的样本无论是神农香菊还是疑似野菊,其多样性水平均稍低于武汉样本。假设神农架的居群样本均分布在较高的海拔范围(例如神农香菊>2000 m),相比武汉居群,神农架的居群可能已经形成了“天空岛(sky island)”类似的山地地理隔离效应[25],进而造成了遗传有效群体的减少,多样性水平下降。
本研究进一步展示了神农架样本居群间较高的基因流和较低的遗传分化水平。神农香菊和邻(混)生的疑似野菊的倍性相同,且神农香菊在神农架的最低分布海拔和疑似野菊的最高分布海拔区域有部分重叠。因此,除了同类型居群样本内的自由遗传交换外,神农香菊与疑似野菊间也可能存在自然杂交。在STRUCTURE 分析中,天门垭和神农顶的部分神农香菊个体和疑似野菊样本出现了遗传混杂,也进一步证实了潜在可能的自然杂交现象的存在。此外,神农架高山林立,构成了“华中屋脊”,区域内具有欧亚大陆从亚热带到寒温带的主要植被类型的变换[26]。鉴于神农架地区神农香菊和(疑似)野菊的形态特征的相似性以及遗传信息上的混杂,神农香菊也可能来源于野菊随着神农架山川的抬升适应高海拔的过程中逐渐演化而成的新变种,从而导致居群间存在未完全消失的祖先群体。
物种的遗传多样性水平和遗传变异方式间接影响其次生代谢产物的多样性水平。基于STRUCTURE分析的样本遗传背景信息,筛选的三组纯合样本分别展示了主要代谢成分含量内容的差异。本次研究发现:在所有检测的9个代谢成分指标中,相比疑似野菊个体,神农香菊可检测出的成分更多,如神农顶神农香菊和天门垭神农香菊的叶检测出了木犀草苷、香叶木素、田蓟苷,天门垭神农香菊的叶检测出了田蓟苷、香叶木素,神农顶神农香菊的叶检测出了木犀草苷。这些成分的差异可能是神农香菊适应高海拔生境而产生的特殊次生代谢产物的代表。
神农顶和天门垭神农香菊居群的叶片检测出了高含量的香叶木素,香叶木素具有显著的抗氧化、抗菌、抗肿瘤等功效[27];神农顶神农香菊居群的叶片检测出了高含量的木犀草苷,木犀草苷具有舒张毛细血管,降低胆固醇、镇痛等功效[28];天门垭神农香菊居群的茎和叶含有田蓟苷,田蓟苷对于血管性痴呆具有显著的缓解作用[29-30]。因此,神农香菊可以作为候选材料进行特殊药用产品的开发应用。基于遗传信息,本研究进一步筛选了神农香菊自然居群的核心种质代表。这些核心种质也为未来神农香菊品种的选育和规模化种植提供了种质资源,促进产业应用和发展。

