尖叶假龙胆不同组分对酒精性肝损伤模型大鼠的保护作用研究
卜义凡 朴圣爱 李紫薇 胡晓阳
作者单位:150000 哈尔滨,黑龙江中医药大学基础医学院[卜义凡(硕士研究生)、李紫薇(硕士研究生)、胡晓阳];黑龙江中医药大学附属第一医院儿一科(朴圣爱)
酒精性肝损伤(alcoholic liver disease,ALD)是由于过量摄入酒精导致的肝脏相关疾病的总称,主要表现形式有酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和酒精性肝硬化,四种表现形式可单独或混合存在[1]。目前ALD治疗方法较为局限,一般为戒酒和对症治疗,晚期主要为肝移植。传统医学凭借整体审查、辨证论治的特点,在ALD防治方面具有一定优势。尖叶假龙胆是蒙医学中清热解毒、利胆退黄的药物,其味苦、性凉,常用来治疗黄疸、肝炎等疾病,现代药理学研究表明其有保肝、抗肿瘤、抗心律失常、抗炎和抗氧化等作用[2-3]。课题组在前期研究中已证实了尖叶假龙胆对ALD的治疗作用[4-5],本研究主要探索尖叶假龙胆各组分拮抗ALD效果,通过建立慢性ALD大鼠模型,用渗漉法分离尖叶假龙胆的不同组分,测定其对ALD模型大鼠脂代谢系统、氧化—抗氧化系统、乙醇代谢酶、炎性细胞因子等指标的影响以及观察肝脏病理变化来验证尖叶假龙胆不同组分的护肝作用效果并分析其对肝脏的保护机理,确定其中作用效果最优的组分,从而为今后对酒精性肝损伤的预防与治疗提供新的思路,并为尖叶假龙胆的更深入研究奠定基础。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠80只,体质量为180~220 g之间,购自黑龙江中医药大学动物实验中心,许可证编号:SCXK(黑)2018-001。实验动物饲养于黑龙江中医药大学方剂学实验室,实验经黑龙江中医药大学实验动物伦理委员会批准后进行。
1.2 药品与试剂
蒸馏水(实验室自制);56°红星二锅头(北京红星股份有限公司,批号20180524);乌拉坦(上海山浦化工有限公司,批号20180917);谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase, ALT)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)、白介素6(interleukin-6,IL-6)、白介素8(interleukin-8,IL-8)、白介素10(interleukin-10,IL-10)、转化生长因子-β1(transforming growth factorβ,TGF-β1)、乙醇脱氢酶(alcohol dehydrogenase,ADH)、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)ELISA试剂盒(购自上海素尔生物科技股份有限公司,货号20181202B、20180906、DECO0195、DRE20142、DECO0008、DEE20030、DECO0007、DEE20031、 DEE20033、 DEE20035、 E04727r-1、03148B、03739B)。尖叶假龙胆全草(保存于黑龙江中医药大学的方剂学实验室,购自黑龙江省大兴安岭地区,经黑龙江中医药大学王振月教授鉴定为龙胆科假龙胆属的尖叶假龙胆植物的干燥全草);复方蛋氨酸胆碱片(白求恩医科大学制药厂,批号17050158)。
1.3 仪器
旋转蒸发仪(上海亚荣生化仪器厂,RE52CS-1);循环水真空泵(郑州长盛实验仪器有限公司,SHB-Ⅲ);恒温水浴锅(上海亚荣生化仪器厂,B-260);中药材粉碎机(天津泰斯特仪器有限公司,FY130);电子天平(上海精密科学仪器有限公司,JH3102);渗漉筒(自制);超薄切片机(德国莱卡公司,2135);显微影像成像系统(麦克奥迪实业公司,Moticam3000);全自动生化分析仪(美国M.D公司,Glamour 2000);台式离心机(德国Hettich公司,Mikro22/22R);紫外可见光分光光度计(日本岛津制作所,UV-2550);多功能酶标仪(瑞士Tecan公司,Infinite M200 pro)。
1.4 药液制备
尖叶假龙胆全草以10倍量蒸馏水浸泡1小时后,煎煮药物1小时,过滤药渣,取其水煎液,再将过滤后的药渣以10倍量的水加热回流提取0.5小时,过滤药渣,取其水煎液,将两次取得的药液合并,于旋转蒸发仪中将合并后的提取液减压浓缩成浸膏,加入适量的蒸馏水稀释成浓度为0.5 g/mL药液,冷藏备用,为实验中全草组使用药物。取尖叶假龙胆全草600 g粉碎成粗粉,10倍量蒸馏水密闭浸泡24小时。将药材粗粉加入渗漉筒,均匀压平,分别以蒸馏水、30%乙醇、60%乙醇、90%乙醇十倍体积洗脱,收集洗脱液进行减压浓缩成浸膏,再加适量蒸馏水稀释成相同体积的稀释液备用。将复方蛋氨酸胆碱片粉碎后用蒸馏水稀释成0.04 g/mL的溶液。
1.5 造模与分组
80只雄性SD大鼠适应性喂养一周后随机分为空白组、模型组、阳性药组、全草组、水洗脱组、30%乙醇洗脱组、60%乙醇洗脱组及90%乙醇洗脱组共8组。本实验模拟人类饮酒习惯,采取梯度酒精灌胃配合高脂饲料喂养造模,实验第1周,除空白组外,各组大鼠以8 mL/kg的56°红星二锅头灌胃。第2周开始,各组大鼠给予的酒精量每周递增1 mL/kg,至第8周酒精灌胃量达到15 mL/kg,空白组大鼠则全程给予相同体积的生理盐水灌胃,同时空白组大鼠予以普通饲料喂养,其余各组以普通饲料与高脂饲料每隔一日交替喂养。由于长期酒精灌胃导致动物死亡无可避免,造模过程中模型组和60%乙醇洗脱组实验动物分别死亡3只,阳性药组、全草组、30%乙醇洗脱组分别死亡2只,水洗脱组与90%乙醇洗脱组分别死亡1只。
1.6 给药方法
实验第5周至第8周除空白组和模型组外,其余各组均通过灌胃法给予实验大鼠相应的药物。为了模拟人类饮酒和用药的过程,并为大鼠消化吸收留出相应的时间,每日给药与酒精灌胃错时6小时,即采取于上午给予酒精造模而下午(间隔6小时)给予药物灌胃的方法,给药体积为10 mL/kg。具体方法为:阳性药组给予复方蛋氨酸胆碱片稀释液(0.04 g/mL)10 mL/kg进行灌胃,全草组给予尖叶假龙胆全草水煎稀释液10 mL/kg,水洗脱组给予尖叶假龙胆水洗脱液10 mL/kg,30%乙醇洗脱组给予尖叶假龙胆30%乙醇洗脱液10 mL/kg,60%乙醇洗脱组给予尖叶假龙胆60%乙醇洗脱液10 mL/kg,90%乙醇洗脱组给予尖叶假龙胆90%乙醇洗脱液10 mL/kg,空白组和模型组给予10 mL/kg生理盐水灌胃。阳性药组给药量相当于复方蛋氨酸胆碱片0.4 g/kg,其余各实验组给药量相当于尖叶假龙胆生药材5 g/kg。
1.7 样本采集与指标检测
1.7.1 尖叶假龙胆不同组分对ALD大鼠血清转氨酶及脂代谢的影响 末次给药6小时后禁食水,12小时后腹腔注射20%浓度的乌拉坦溶液(0.5 mL/100 g)麻醉,腹主动脉采血,离心机配平后条件设置为4℃、3500 r/min,离心10分钟,分离血清,按照试剂盒要求的操作方法于全自动生化仪分析血清中ALT、AST、TG、TC含量。
1.7.2 尖叶假龙胆不同组分对ALD大鼠炎性细胞因子的影响 末次给药6小时后禁食水,12小时后腹腔注射20%浓度的乌拉坦溶液(0.5 mL/100g)麻醉,腹主动脉采血,离心机配平后条件设置为4℃、3500 r/min,离心10分钟,分离血清,按照试剂盒要求的操作方法于全自动生化仪分析血清中IL-6、IL-8、IL-10和TGF-β1含量。
1.7.3 尖叶假龙胆不同组分对ALD大鼠肝脏指数和肝组织病理形态的影响 末次给药6小时后禁食水,12小时后将大鼠逐一称重,腹腔注射20%乌拉坦溶液(0.5 mL/100 g)麻醉,将整个肝脏取出并用生理盐水冲洗。用滤纸将整个肝脏吸干,电子天平称重,计算肝脏指数。肝脏指数计算公式为:肝脏指数=肝脏重量/体重×100%。剪取3 mm3左右大小的肝脏组织,戊二醛固定后常规漂洗、逐级脱水、包埋、固化后切片,片厚6μm,电镜下观察肝组织形态。
1.7.4 尖叶假龙胆不同组分对ALD大鼠TNF-α、ICAM-1蛋白表达的影响 肝组织经甲醛固定、乙醇脱水、石蜡包埋、切片等常规处理后,按照试剂盒说明操作,采用SP两步法进行免疫组化染色,400倍显微镜下观察。染色评分计算方法:染色总分=染色强度×染色面积,染色强度以无染色记0分,轻度着色记1分,重度着色记3分;染色面积以阳性细胞着色记分,无染色记0分,低于10%记1分,10%~50%记2分,50%~80%记3分,高于80%记4分。
1.7.5 尖叶假龙胆不同组分对ALD大鼠氧化-抗氧化系统的影响 剪取约1 g肝组织置于加入9 g生理盐水的匀浆器中,充分研磨得到10%的肝组织匀浆液。将肝组织匀浆液在4℃,3500 r/min条件下离心10分钟,取上清液,根据试剂盒说明书操作,测定肝组织中MDA、SOD、GSH、ADH、ALDH含量。
1.8 统计学方法
本实验的数据选用SPSS 22.0软件进行处理,实验计量资料均符合正态分布且方差齐,故统计学结果以均值±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用Dunnett's检验,以P<0.05有显著性差异,P>0.05则没有统计学意义。
2 结果
2.1 尖叶假龙胆不同组分对ALD大鼠血清转氨酶及脂代谢的影响
如表1所示,相较空白组,模型组大鼠血清中ALT、AST、TG和TC含量显著升高,差异具有统计学意义(P<0.05)。相较模型组,阳性药组、全草组、60%乙醇洗脱组和90%乙醇洗脱组ALT、AST、TG和TC值均降低,具有显著差异(P<0.05);在降低TG值方面90%乙醇洗脱组优于全草组、水洗脱组、30%乙醇洗脱组和60%乙醇洗脱组(P<0.05)。水洗脱组和30%乙醇洗脱组作用效果较弱,其AST和TC的含量变化无统计学意义(P>0.05)。
表1 尖叶假龙胆不同组分对ALD大鼠转氨酶及脂代谢的影响(±s)

表1 尖叶假龙胆不同组分对ALD大鼠转氨酶及脂代谢的影响(±s)
注:与空白组相比,a P<0.05;与模型组相比,b P<0.05;与90%乙醇洗脱组相比,c P<0.05。
组别 鼠只 ALT(U/L) AST(U/L) TG(mmol/L) TC(mmol/L)空白组 10 31.56±4.99 20.18±6.25 4.30±0.47 4.04±0.83模型组 7 64.53±3.99a 46.58±5.61a 7.85±0.61a 7.36±0.45a阳性药组 8 37.10±5.66b 24.11±6.38b 4.86±0.59b 4.58±1.06b全草组 8 45.87±7.43b 34.26±8.88b 6.08±0.78bc 5.72±1.02b水洗脱组 9 54.76±10.02bc 37.96±7.36 6.84±0.65bc 6.25±1.02 30%乙醇洗脱组 8 55.65±5.10bc 39.48±6.59 6.77±0.48bc 6.43±0.45 60%乙醇洗脱组 7 47.40±5.43b 32.98±6.07b 5.95±0.49bc 5.58±0.89b 90%乙醇洗脱组 9 39.56±5.37b 26.76±6.19b 5.12±0.47b 4.87±0.98 b
2.2 尖叶假龙胆不同组分对ALD大鼠炎性细胞因子的影响
如表2所示,与空白组相比,模型组血清IL-6、IL-8和TGF-β1含量升高,IL-10含量降低,具有显著差异(P<0.05)。相较模型组,阳性药组、全草组、60%乙醇洗脱组和90%乙醇洗脱组IL-6、IL-8和TGF-β1含量降低,IL-10含量升高,具有显著差异(P<0.05)。水洗脱组和30%乙醇洗脱组作用效果较弱,其IL-8和IL-10含量变化无统计学意义(P>0.05)。
表2 尖叶假龙胆不同组分对ALD大鼠细胞因子的影响(±s,pg/mL)

表2 尖叶假龙胆不同组分对ALD大鼠细胞因子的影响(±s,pg/mL)
注:与空白组相比,a P<0.05;与模型组相比,b P<0.05;与90%乙醇洗脱组相比,c P<0.05。
组别 鼠只 IL-6 IL-8 IL-10 TGF-β1 7±249.85模型组 7 131.83±12.87a 202.80±45.62a 31.91±6.96a 1738.64±215.19a阳性药组 8 67.95±6.55b 97.80±43.96b 54.46±7.18b 857.40±226.80b全草组 8 85.27±11.32b 132.49±44.88b 45.44±7.27b 1194.77±317.31b水洗脱组 9 110.67±14.03bc 152.31±41.40 40.24±8.98 1384.22±247.00bc 30%乙醇洗脱组 8 107.94±11.55bc 161.31±47.23 40.05±6.80 1397.11±230.25bc 60%乙醇洗脱组 7 90.74±10.74bc 134.49±46.46b 46.36±7.18b 1193.48±239.54b 90%乙醇洗脱组 9 75.45±10.36b 106.83±45.16b 52.15±7.10b 974.38±243.71空白组 10 58.96±10.30 80.83±46.95 58.06±7.10 768.1 b
2.3 尖叶假龙胆不同组分对ALD大鼠肝脏指数和肝组织病理形态的影响
如表3所示,与空白组相比,模型组的肝脏指数升高,具有显著差异(P<0.05)。与模型组相比,阳性药组、全草组、60%乙醇洗脱组、90%乙醇洗脱组肝脏指数降低,具有显著差异(P<0.05)。水洗脱组和30%乙醇洗脱组作用效果较弱,其肝脏指数变化无统计学意义(P>0.05)。
表3 尖叶假龙胆不同组分对ALD大鼠肝脏指数的影响(±s)
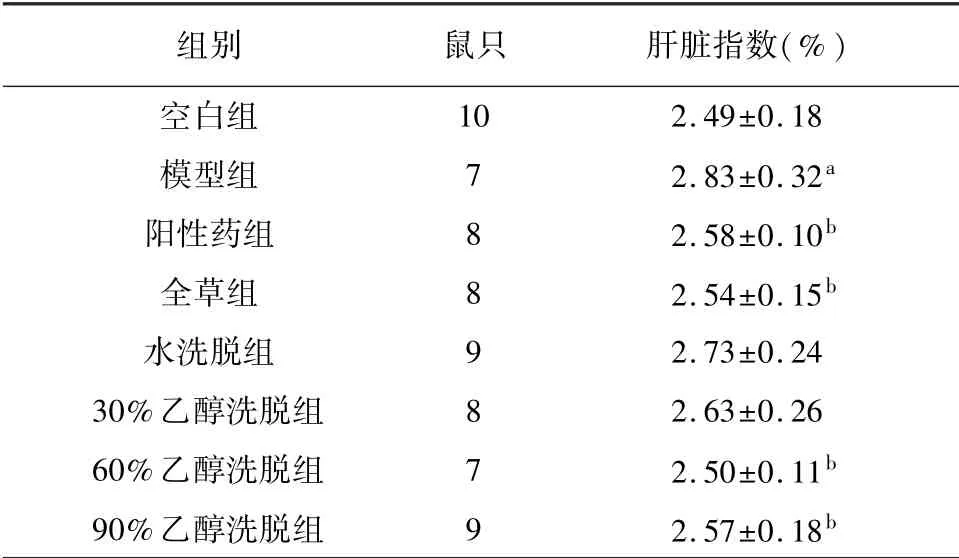
表3 尖叶假龙胆不同组分对ALD大鼠肝脏指数的影响(±s)
注:与空白组相比,a P<0.05;与模型组相比,b P<0.05。
组别 鼠只 肝脏指数(%)10 2.49±0.18模型组 7 2.83±0.32a阳性药组 8 2.58±0.10b全草组 8 2.54±0.15b水洗脱组 9 2.73±0.24 30%乙醇洗脱组 8 2.63±0.26 60%乙醇洗脱组 7 2.50±0.11b 90%乙醇洗脱组 9 2.57±0.18空白组b
肝组织形态见图1。空白组核型正常,线粒体正常。模型组线粒体明显变形,核型不整。阳性药组形态相对较好,溶酶体增多,内质网增多。全草组线粒体轻度肿胀,核型不整,脂滴略多。水洗脱组肝细胞核固缩,线粒体增多,脂滴多。30%乙醇洗脱组线粒体轻度肿胀,核型不整,脂滴增多。60%乙醇洗脱组线粒体轻度肿胀,核型不整。90%乙醇洗脱组核型基本正常,线粒体轻度肿胀,可见少量脂滴。
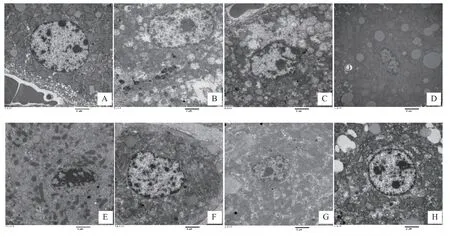
图1 各实验组大鼠肝组织病理形态变化(透射电镜,×10000)
2.4 尖叶假龙胆不同组分对ALD大鼠TNF-α、ICAM-1蛋白表达的影响
如表4所示,与空白组相比,模型组TNF-α和ICAM-1染色评分升高,具有显著差异(P<0.05)。与模型组相比,阳性药组、全草组、60%乙醇洗脱组、90%乙醇洗脱组TNF-α和ICAM-1染色评分降低,具有显著差异(P<0.05)。水洗脱组和30%乙醇洗脱组作用效果较弱,其变化无统计学意义(P>0.05)。
表4 尖叶假龙胆不同组分对ALD大鼠TNF-α、ICAM-1蛋白表达的影响(±s,分)

表4 尖叶假龙胆不同组分对ALD大鼠TNF-α、ICAM-1蛋白表达的影响(±s,分)
注:与空白组相比,a P<0.05;与模型组相比,b P<0.05。
ICAM-1空白组组别 鼠只 TNF-α 10 1.40±0.52 1.30±0.48模型组 7 8.14±1.46 a 7.00±2.00 a阳性药组 8 1.63±0.52 b 1.63±0.74 b全草组 8 2.88±1.25 b 2.88±0.99 b水洗脱组 9 5.44±1.67 5.44±1.67 30%乙醇洗脱组 8 5.38±1.77 5.88±1.55 60%乙醇洗脱组 7 2.86±1.07 b 3.14±0.90 b 90%乙醇洗脱组 9 1.89±0.93 b 1.67±0.71 b
TNF-α染色各组肝细胞呈不同程度阳性反应,阳性物质主要分布于胞浆,呈棕黄色细颗粒状,见图2。ICAM-1染色各组肝细胞呈不同呈度的阳性反应,阳性物质主要表达于肝细胞膜,部分肝细胞浆染色阳性,呈棕黄色细颗粒状,见图3。

图2 各实验组大鼠TNF-α染色情况(×400)

图3 各实验组大鼠ICAM-1染色情况(×400)
2.5 尖叶假龙胆不同组分对ALD大鼠氧化—抗氧化系统的影响
如表5所示,与空白组相比,模型组肝组织MDA升高,SOD、GSH、ADH和ALDH降低,具有显著差异(P<0.05)。与模型组相比,阳性药组、全草组、60%乙醇洗脱组、90%乙醇洗脱组肝组织MDA降低,SOD、GSH、ADH和ALDH升高,具有显著差异(P<0.05),尤以阳性药组和90%乙醇洗脱组效果最好;水洗脱组和30%乙醇洗脱组作用效果较弱,水洗脱组SOD、GSH和ALDH含量变化无统计学意义(P>0.05),30%乙醇洗脱组SOD含量变化无统计学意义(P>0.05)。
表5 不同组分对ALD模型大鼠氧化-抗氧化系统的影响(±s,U/mg)

表5 不同组分对ALD模型大鼠氧化-抗氧化系统的影响(±s,U/mg)
注:与空白组相比,a P<0.05;与模型组相比,b P<0.05;与90%乙醇洗脱组相比,c P<0.05。
组别 鼠只 SOD GSH(ng/mg) MDA(nmol/mg) ADH(U/mg) ALDH(U/mg).11 184.76±13.08模型组 7 25.51±4.06a 0.73±0.12a 0.91±0.05a 137.91±18.04a 91.18±9.58a阳性药组 8 40.39±4.06b 1.34±0.11b 0.51±0.05b 254.34±13.05b 159.59±7.71b全草组 8 33.69±3.93b 1.18±0.06b 0.69±0.11bc 222.52±13.86bc 143.78±10.85b水洗脱组 9 29.03±5.44 0.86±0.12 0.79±0.09bc 168.03±11.28bc 104.11±10.61 30%乙醇洗脱组 8 29.55±4.86 0.92±0.14bc 0.78±0.08bc 174.54±15.33bc 114.70±15.93bc 60%乙醇洗脱组 7 35.45±3.18b 1.19±0.17b 0.70±0.07bc 228.51±17.78bc 139.44±15.99bc 90%乙醇洗脱组 9 38.28±5.82b 1.32±0.14b 0.55±0.09b 252.29±24.27b 160.21±22.01空白组 10 42.36±3.87 1.58±0.11 0.44±0.06 298.96±20 b
3 讨论
传统医学认为,尖叶假龙胆具有清热解毒、利胆退黄等功效,临床中常用于治疗黄疸、肝炎等病;现代研究表明,尖叶假龙胆主要化学成分为酮类化合物、萜类化合物、木脂素类化合物、黄酮类化合物和甾体类化合物,具有保肝、抗炎、抗氧化、抗心律失常、抗心肌缺血、抗肿瘤、降糖等药理作用[2-3],并且前期研究已证实尖叶假龙胆水煎液能通过降低转氨酶、调节脂代谢系统、减少氧化损伤等途径发挥对ALD的保护作用[4-5],因此本研究具有充分的中医学理论依据和药理学研究基础。然而,仅仅研究尖叶假龙胆饮片层面的效用,存在化学物质繁杂、作用机制难以明确以及质控标准不易把握等问题,制约了临床疗效,阻碍了其现代化开发应用。因此本研究选择对其组分层面的作用效果进行探索,以期为未来进一步深入研究,开发药效物质与作用机制相对明确的现代中药奠定基础。
既往研究认为ALD与过量摄入乙醇所引起的氧化应激、炎症反应、脂代谢障碍、线粒体功能障碍、内毒素等多因素有关。长期大量摄入酒精可能导致肝脏脂质代谢紊乱和肝细胞微管创伤,脂肪和分泌性蛋白在肝细胞内堆积,导致肝脏指数升高[6]。肝脏受到损伤时,肝细胞膜通透性增高,肝细胞内的AST和ALT会顺浓度差释放入血,导致血液中ALT和AST升高。结合本研究结果来看,尖叶假龙胆组分能够降低肝脏指数,改善肝组织形态,降低ALT、AST、TG和TC含量,提示其能通过调节脂代谢系统和调节转氨酶发挥对肝脏的保护作用。
乙醇在代谢中产生的乙醛会打破机体中原本的氧化系统与过氧化系统之间的平衡出现氧化应激状态,肝组织中具有细胞毒性的氧化产物MDA升高,抗氧化物质GSH和SOD含量下降,机体抗氧化能力减弱,清除自由基能力下降,也会使肝细胞膜发生脂质过氧化反应,导致肝细胞损伤[7]。此外,酒精的代谢主要在ADH系统和ALDH系统参与下完成,ADH和ALDH含量降低,使乙醇和乙醛代谢速率下降,使乙醛堆积并产生乙醛蛋白加合物导致肝损伤[8]。本研究中,尖叶假龙胆组分能够降低MDA含量,提高抗氧化物质和代谢酶含量,提示其能够通过调节氧化-抗氧化系统,加速酒精代谢达到拮抗ALD的作用。
与炎症反应有关的细胞因子在ALD发生发展过程中扮演重要角色。酒精导致IL-6和IL-8刺激肝脏中的成纤维细胞、贮脂细胞和Kupffer细胞等分泌细胞因子,介导肝中性粒细胞浸润,导致肝脏组织发生炎症反应、脂肪堆积和纤维化[9-10];过量TNF-α可诱导肝细胞损伤和凋亡,乙醇可以刺激单核细胞和巨噬细胞产生过量TNF-α;TGF-β1是学界公认的导致纤维化的最强的一种细胞因子,能导致细胞外基质大量积聚,使肝细胞死亡、组织纤维化;ICAM-1是免疫球蛋白超家族的粘附分子中的一员[11],能介导中性粒细胞和肝窦内膜的黏附作用,然后向肝内浸润,通过微循环障碍造成肝脏的损伤[12-15]。IL-10作为抑炎细胞因子,能抑制炎症损伤拮抗ALD的发展。本研究中,尖叶假龙胆各组分能降低炎性因子含量,抑制TNF-α和ICAM-1蛋白表达,提升抑炎因子含量,提示其可能提高调节炎性因子水平,减轻炎症反应,从而改善ALD。
综上所述,用渗漉法分离提取出的尖叶假龙胆组分对ALD有拮抗作用,不同组分作用效果有所差异,其中最优组分为90%乙醇洗脱组,其次为60%乙醇洗脱组和全草组,30%乙醇洗脱组和水洗脱组效果最弱,甚至对某些指标无效。尖叶假龙胆组分拮抗ALD机制可能是通过调节脂代谢系统,促SOD、GSH生成,降低MDA,促进ADH、ALDH分泌,提高酒精代谢率,平衡氧化-抗氧化系统,抑制IL-6、IL-8、TGF-β1等促炎细胞因子生成,促进抗炎细胞因子IL-10的生成以及抑制TNF-α、ICAM-1蛋白表达从而发挥作用。

