含盐农村生活污水灌溉对土壤微生物的影响
张丹丹,郑向群,李厚禹,陈昢圳,张耕涛,孔 豪,黄治平
农业农村部环境保护科研监测所,天津 300191
我国农村生活污水排放量日益增加,每年约排放80×108t生活污水,为缓解水资源紧张局面,许多地区将农村生活污水作为农业生产的重要水资源,并且污水再利用也是世界性的研究热点[1]. 由于农村生活污水中含有一定的盐分,污灌盐分对土壤健康会产生直接影响,因此在农业利用中农村含盐生活污水对土壤健康的影响需重点关注[1]. 目前国内外土壤盐分对土壤环境的研究大多在农田、滨海湿地生态系统中开展,主要涵盖盐分与土壤养分、微生物的关系,土壤水盐的迁移估算、土壤盐分剖面分布和离子组成,以及微咸水灌溉下对作物生长影响等[2-4]. 目前生活污水相关研究主要针对氮、磷、COD、重金属,而有关生活污水盐分的相关报道较少,总体看来,农村生活污水研究中每个研究对象较分散,特别是在农村生活污水资源化利用方面系统性研究不足,有很多不确定的因素需要去验证,由于农村生活污水是农村污水的主要来源之一,盐分应是农业资源利用需考虑的重要因素之一. Hamilton等[5]发现,Na+含量过高可能导致土壤孔隙度降低,部分有毒盐基离子会导致土壤物理环境发生变化. Qian等[6]研究表明,在蒸发量高和自然降水少的地区,使用处理过后的废水进行灌溉,随着灌溉年限的增加,往往会造成土壤盐分积累,在这一结论基础上,Zalacáin等[7]使用处理后的废水用于土地灌溉,发现灌溉年限为5年时土壤没有发生盐
分积累,而灌溉年限为15年的土壤有略微的盐分积累现象.
盐分可降低酶活性、微生物量及有机物的分解速率,并且可增加微生物的功能多样性. 土壤微生物是土壤物质转化与形成的重要动力,对提高土壤肥力发挥了关键作用,可以直接反映土壤环境的变化情况. 有研究表明,土壤盐分含量的高低会对土壤养分、微生物产生直接影响,盐分含量升高会导致土壤养分、微生物多样性降低[8],对土壤微生物活性起抑制作用,影响微生物群落结构[9-11]. 因此,开展生活污水中盐分对土壤养分、微生物的变化特征研究,对于农田农业安全及可持续发展具有重要意义. 该研究以实现农村生活污水资源利用为目标,通过室内模拟土柱试验,以40 cm深度处的盐分积累来探讨土壤细菌、真菌多样性及其群落变化,以期为农村生活污水农业安全利用提供数据支撑.
1 材料与方法
1.1 供试材料
1.1.1 供试土壤
土壤样品取自天津市静海区农田土壤,为潮土.用其填充土柱后测得土壤理化性质见表1. 土壤经自然风干、混合均匀后过2 mm网筛填充土柱,土壤密度为2.47 g/cm3. 污水取自天津市静海区范子庄,供试样品理化性质见表1.

表1 土样和水样理化性质Table 1 Physical and chemical properties of soil and water samples
1.2 试验设计
采用室内有机玻璃土柱模拟试验,土柱高95 cm、壁厚5 mm、直径15 cm,0~5 cm不填充土壤,为灌溉渗滤层,85~95 cm为返渗层,实际填充80 cm土柱.土柱两侧每20 cm设置一个取样孔,共设置5对直径4 mm的取样孔,其壁厚为5 mm,于土柱40 cm深度处取样孔取样〔见图1(a)〕. 土柱填充完后用清水进行洗盐,淋洗后土柱含盐量为0.58 g/kg. 试验共设计7个不同含盐污水处理组,即ZCK(0 g/L)、ZRW(raw water) (0.2 g/L)、ZW1(0.5 g/L)、ZW2(0.8 g/L)、ZW3(1.2 g/L)、ZW4(1.6 g/L)、ZW5(2.0 g/L),如图1(b)所示,每个处理均设3次重复. 试验采用未被处理的生活污水进行浇灌. 为保证污水盐分含量保持不同水平,将原水(ZRW)稀释3倍至含盐量为0.2 g/L,再通过人工配比盐分使用. 生活污水按照田间灌溉用水含盐量标准与含盐水配制成不同含盐量的灌溉用水,选用NaCl、CaCl2和MgSO4,三者按照质量比为2∶1∶2配制不同盐度生活污水. 灌水定额由单位面积内小白菜的需水量确定,灌溉定额为350 mL,2 d浇灌一次,周期为72 d. 理化指标、盐分指标及微生物结构组成及多样性取72 d后的土样进行测定.

图1 含盐生活污水灌溉试验示意Fig.1 Schematic diagram of saline domestic sewage irrigation test
1.3 土壤指标测定
土壤TP含量根据《土壤总磷的测定 碱熔-钼锑抗分光光度法》(HJ 632−2011)测定;土壤TN含量根据《土壤质量 全氮的测定 凯氏法》(HJ 717−2014)测定;土壤NH4+-N和NO3−-N含量均参照《土壤氨氮、亚硝酸盐氮、硝酸盐氮的测定 氯化钾溶液提取-分光光度法》(HJ 634−2012)测定;土壤OM含量根据《土壤有机质测定法》(NY/T 85−1988)测定;土壤电导率按照蒸馏水与土壤样品质量比5:1,使用电导率仪(SX650,上海三信仪表厂)测定;Na+、Mg2+、Ca2+、SO42−、Cl−含量根据《森林水溶性盐分分析》(LY-T 1251−1999)测定;土壤密度根据《土壤检测》(NY/T 1121−2006)测定.
使用土壤电导率测定仪测得土壤全盐量,土壤电导率转换为土壤全盐量的计算方法见式(1)[12]:

式中:EC1∶5表示土水比为1∶5的土壤浸提液所测得的土壤电导率,dS/m;C为土壤全盐量,g/kg.
土壤含盐量计算方法见式(2):

式中:S为土壤含盐量,kg/hm2;ρs为土壤容重,g/cm3;l为土壤深度,cm.
土壤脱盐率计算方法见式(3)[13]:

式中:N为脱盐率,%;S1为灌溉前土壤盐分含量,g/kg;S2为灌溉后土壤盐分含量,g/kg.
1.4 生物信息学分析
1.4.1 DNA提取与PCR扩增
总DNA根据E.Z.N.A.® soil试剂盒(Omega Bio-tek,美国)进行抽提,DNA浓度和纯度利用超微量分光光度计NanoDrop2000 (Thermo Fisher Scientific,USA)进行检测,DNA提取质量通过1%的琼脂糖凝胶电泳检测. 每组处理均设3次重复,其中细菌引物为338F (5'-ACTCCTACGGGAGGCAGCAG-3')和806R (5'-GGACTACHVGGGTWTCTAAT-3'),对V3~V4可变区进行PCR扩增[14]. 细菌扩增程序:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min(PCR仪,ABI GeneAmp® 9 700型,美国),PCR正式试验采用TransGen AP221-02: TransStart Fastpfu DNA Polymerase,20 μL反应体系. 真菌引物为ITS1F(CTTGGTCATTTAGAGGAAGTAA)和ITS2R (CTT GGTCATTTAGAGGAAGTAA)[14],真菌扩增程序:退火温度55 ℃,循环数为35,PCR正式试验采用TaKaRa rTaq DNA Polymerase,20 μL反应体系. 利用Illumina公司的Miseq PE300/NovaSeq PE250平台进行测序(上海美吉生物医药科技有限公司).
1.4.2 OTU聚类与物种注释
原始测序序列使用Fastp软件质控,用FLASH软件拼接,其过程为过滤reads尾部质量值在20以下的碱基,窗口长度为50 bp,如果其平均质量值低于20,则从窗口开始去除后端碱基,过滤质控后窗口长度在50 bp以下的reads,去除含N碱基的reads;根据PE reads之间的overlap关系,将成对reads拼接(merge)成一条序列,最小overlap长度为10 bp;拼接序列的overlap区允许的最大错配比率为0.2,从而筛选出不符合条件的序列;根据序列首尾两端的barcode和引物区分样品,并调整序列方向,barcode允许的错配数为0,最大引物错配数为2;之后,使用UPARSE软件根据97%的相似度对序列进行OTU聚类并剔除嵌合体. 选出与代表序列相似性在97%以上的序列,生成OTU表格. 分别对细菌使用Silva数据库、真菌使用Unite 8.0数据库进行分类,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析. 原始数据已上传到NCBI并传入SRA数据库,细菌数据登记号为SUB11121402,真菌数据登记号为SUB11121399.
1.5 数据分析
土壤盐分、理化试验数据采用Excel 2019软件进行整理,利用SPSS 25软件进行单因素方差分析、差异显著分析及相关性分析. 土壤微生物高通量测序
数据利用Majorbi美吉生物云平台分析,其中利用Mothur软件计算不同随机抽样下的Alpha多样性指数,用Venn图分析时选用相似水平为97%的OTU或其他分类学水平的样本表,通过R语言(version 3.3.1)制图. 微生物群落柱形图通过R语言(version 3.3.1)制图. 利用Canoco 5进行土壤全盐量、主要盐基离子含量与细菌和真菌的多样性指数、优势菌门相关分析,其中将土壤全盐量和Na+、Cl−、Mg2+、Ca2+、
SO4
2−含量作为解释量,Alpha指数、优势菌门作为被解释量,首先对其进行降趋分析,得到4个轴中梯度轴长均小于3,再进行冗余分析(RDA). 土壤细菌功能预测采用PICRUSt软件基于KEGG功能进行分析,土壤真菌功能预测基于FUNGuild预测分析.
2 结果与分析
2.1 含盐生活污水灌溉下40 cm土层的化学性质特征
通过分析土壤全盐含量、主要盐基离子与土壤养分含量的相关性(见表2)得知,土壤全盐含量与土壤TN、TP、OM含量均呈极显著负相关(P<0.01),相关系数分别−0.80、−0.80、−0.85,主要盐基离子Na+、Mg2+、Cl−、Ca2+、SO42−含量均与土壤TN、TP、OM含量呈极显著负相关.

表2 土壤全盐、盐基离子、养分含量的相关性Table 2 Correlation table of soil whole salt, salt-based ions and nutrient contents
2.2 含盐农村生活污水灌溉下的土壤细菌、真菌分析
2.2.1 细菌、真菌OTUs分析
由图2(a)可见,各处理中细菌共有的OTUs数为1 350个,ZCK、ZRW、ZW1、ZW2、ZW3、ZW4、ZW5各处理独有的OTU数分别是322、300、292、287、280、278、273个. 随着农村生活污水盐度的增加,土壤细菌OTU数量逐渐减少,表明高含盐生活污水灌溉易降低土壤细菌OTU数. 由图2(b)可见,在真菌中,各处理共有的OTUs数为575个,其独有的OTU数分别是153、149、141、142、172、169、197个,随着灌溉用水盐度的增加,OTUs数呈显著增加(P<0.05). 以上结果说明,灌溉含盐农村生活污水会对土壤细菌、真菌OTUs数产生一定影响.
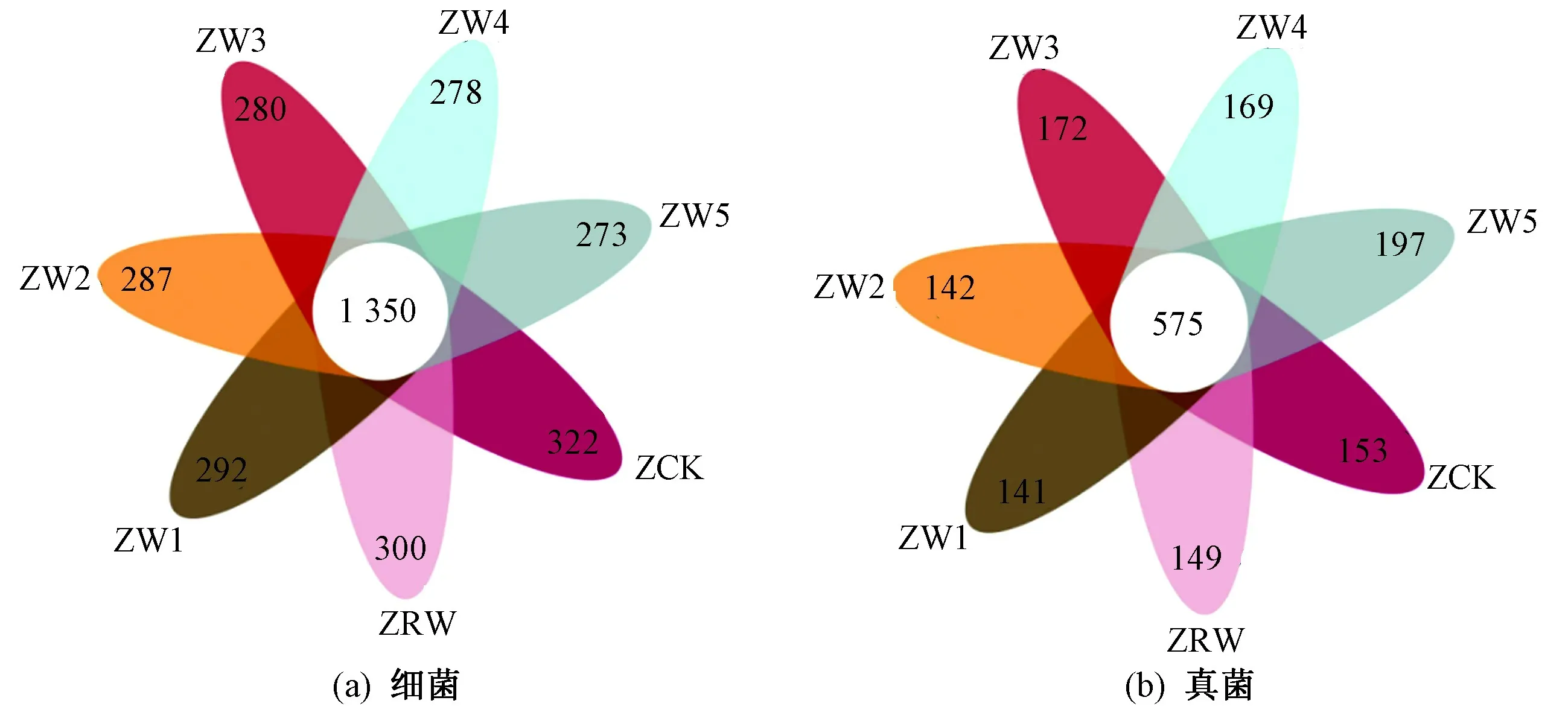
图2 各处理间的OTU Venn图Fig.2 OTU Venn diagram of each treatments
2.2.2 土壤盐分与微生物Alpha多样性的相关分析
由图3(a)可见,土壤中Na+含量与细菌Alpha多样性指数呈极显著相关(P<0.01),其中Na+含量与Chao1指数、Shannon-Wiener指数均呈极显著负相关(P<0.01). 由图3(b)可见,全盐量、Ca2+含量均与真菌Shannon-Wiener指数、Chao1指数、ACE指数呈显著正相关(P<0.05). 通过SPSS 25双变量相关性分析不同盐分浓度对土壤细菌多样性的影响(见表3)得到:高含盐(>1 g/L)生活污水灌溉下土壤全盐量与细菌群落Shannon-Wiener指数呈显著负相关(P<0.05),与Simpson指数呈显著正相关(P<0.05);低含盐(<1 g/L)灌溉下土壤全盐量与细菌多样性无显著相关性(P>0.05);高、低含盐量均对土壤真菌Shannon-Wiener指数、Chao1指数有极显著正相关的影响(P<0.01).

图3 主要盐基离子含量与Alpha多样性的冗余分析(RDA)结果Fig.3 Redundancy analysis (RDA) results of major salt ion content and Alpha diversity
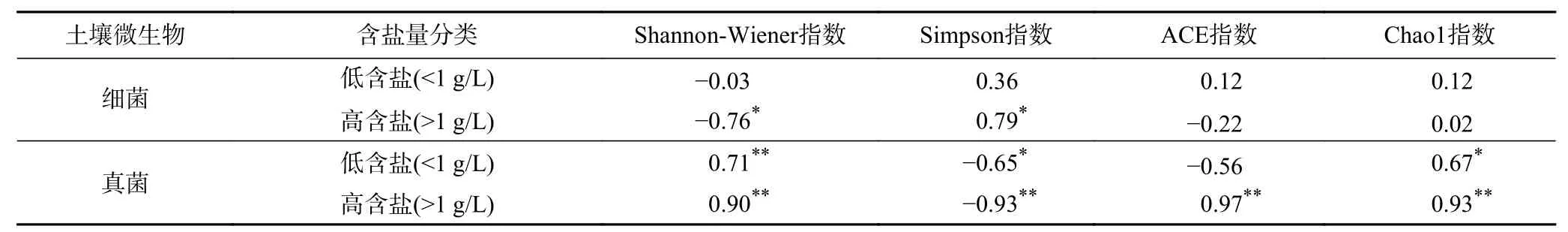
表3 高低含盐量与土壤细菌和真菌多样性相关性Table 3 High and low salt content and soil bacterial and fungal diversity correlation
2.3 不同含盐生活污水灌溉水平下土壤微生物群落组成分析
2.3.1 不同含盐生活污水灌溉下土壤细菌群落组成分析
在细菌门水平上〔见图4(a)〕,不同含盐农村生活污水灌溉下的土壤细菌类群分别是变形菌门(Proteobacteria,占比为20.18%~31.82%)、放线菌门(Actinobacteria,占比为21.75%~31.47%)、酸杆菌门(Acidobacteria,占比为5.02%~24.66%)、绿弯菌门(Chloroflexi,占比为11.25%~15.02%)、芽单胞菌门(Gemmatimonadetes,占比为4.40%~6.40%)、硝化螺旋菌门(Nitrospirae,占比为3.10%~3.78%)、拟杆菌门(Bacteroidetes,占比为2.53%~3.82%)、厚壁菌门(Firmicutes,占 比 为 1.79%~4.28%)、蓝 细 菌 门(Cyanobacteria,占比为0.18%~2.18%)和浮霉菌门(Planctomycetes,占比为0.48%~1.31%). 随着污水含盐量的增加,与ZCK处理相比,ZW5处理下Actinobacteria的相对丰度极显著(P<0.01)提高了11.64%,Proteobacteria的 相 对 丰 度 提 高 了 9.72%,Acidobacteria的相对丰度显著降低 (P<0.05),Chloroflexi的相对丰度降低了3.77%. 这说明盐分对微生物群落结构具有选择性影响.
为探究不同含盐农村生活污水灌溉下土壤细菌在属水平上相对丰度的情况,筛选分类水平相对丰度前15位的属,绘制群落物种组成分布,分析不同处理下不同物种的占比情况. 如图4(b)所示,ZCK、ZRW、ZW1、ZW2、ZW3、ZW4、ZW5各处理下土壤细菌优势菌属分别为节杆菌属(Arthrobacter,占比为1.78%~3.57%)、RB41(占比为0.35%~2.74%)、盖亚属(Gaiella,占比为1.36%~2.64%)、红色杆菌属(Rubrobacter,占比为0.61%~2.27%)、鞘氨醇单胞菌属(Sphingomonas,占比为1.27%~2.80%). 其中,土壤中RB41和Rubrobacter的相对丰度随灌溉生活污水含盐量的升高呈显著下降趋势(P<0.05),Gaiella、Sphingomonas的相对丰度随灌溉盐量的增加呈上升趋势.

图4 不同含盐量灌溉水平下土壤细菌物种组成Fig.4 Soil bacterial species composition at different levels of salt-content irrigation
2.3.2 不同含盐量生活污水灌溉水平下土壤真菌群落组成分析
不同含盐量农村生活污水灌溉下的土壤真菌类群中以子囊菌门(Ascomycota,占比为52.42%~81.12%)、被孢霉门(Mortierellomycota,占比为6.55%~13.13%)、担子菌门(Basidiomycota,占比为2.4%~36.15%)为优势菌门〔见图5(a)〕. 与其他处理相比,ZRW处理下子囊菌门(Ascomycota)的相对丰度显著降低了35.37%(P<0.05),担子菌门(Basidiomycota)的相对丰度显著(P<0.05)增加了34.11%,其他菌门的相对丰度变化较为平稳. 如图5(b)所示,在属水平上,被孢霉属(Mortierella)、Neocosmospora、绿僵菌属(Metarhizium)、毛壳菌属(Chaetomium)对土壤真菌群落组成的贡献较大. ZCK、ZRW、ZW1、ZW2、ZW3、ZW4、ZW5各处理下Chaetomium的占比分别为7.10%、6.69%、5.70%、4.70%、4.20%、3.80%、2.80%,随灌溉用水含盐量的升高,土壤中Chaetomium的相对丰度显著降低(P<0.05).

图5 不同含盐量灌溉水平下土壤真菌的物种组成Fig.5 Soil fungal species composition at different levels of salt-content irrigation
2.4 主要盐基离子与细菌、真菌群落间的相关性
该研究选取细菌、真菌优势菌门及优势属,针对各土壤盐基离子含量与细菌和真菌主要优势菌门、属之间的关系进行相关性分析. 图6(a)中第一轴解释率为35.63%,发现土壤中Mg2+、Cl−是影响40 cm深度处土壤细菌优势菌门的主要盐基离子,Mg2+含量、Cl−含量均与Actinobacteria、Proteobacteria、Nitrospirta、Firmicutes、 Entotheonellaeota、 Myxococcota、Gemmatimonadota、Methylomirabilota的相对丰度呈显著正相关(P<0.05),均与Planctomycetota、Acidobacteria、Chloroflexi、Patescibacteria、Bacteroidota的相对丰度呈显著负相关(P<0.05),且贡献率表现为Mg2+>Cl−.
将主要的盐基离子含量与真菌优势门的相对丰度进行冗余分析(RDA),结果如图6(b)所示,土壤中5个主要盐基离子含量均与真菌优势门的相对丰度无显著相关关系,而土壤理化指标与土壤真菌也存在不显著相关关系.
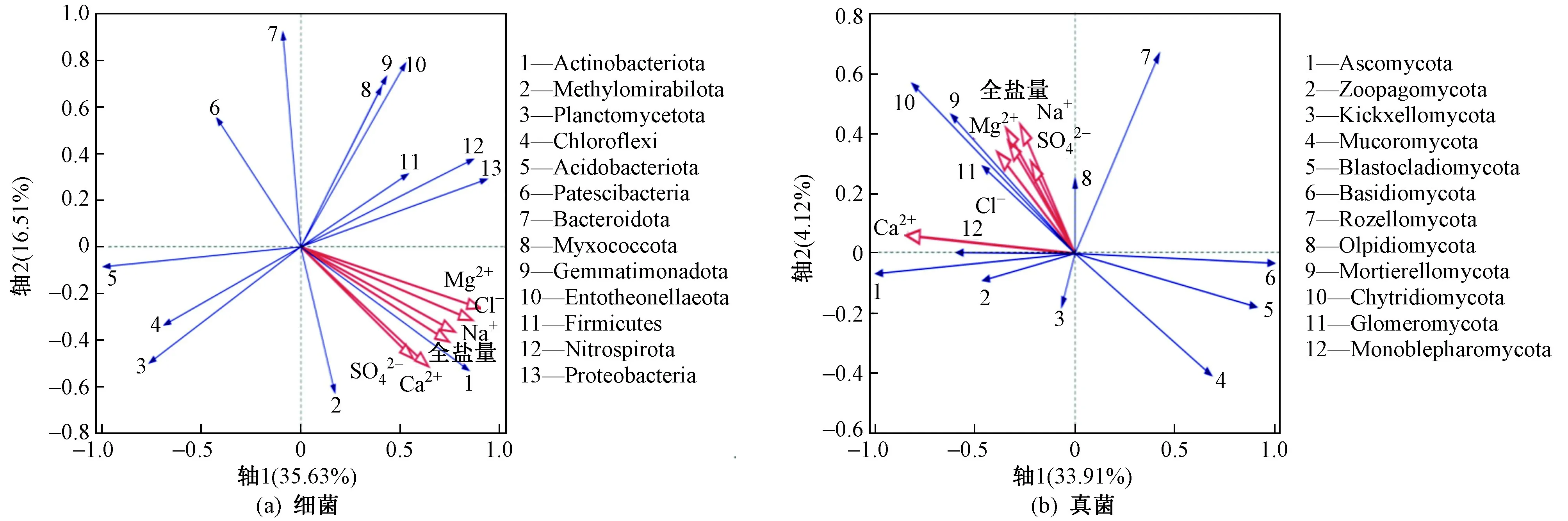
图6 主要盐基离子含量与优势菌门的冗余分析(RDA)Fig.6 RDA analysis of major salt ions contents and predominant bacteria
2.5 土壤细菌、真菌功能预测分析
土壤细菌中共含7类一级代谢通路(见图7),分别是细胞过程(cellular process)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、人类疾病(human diseases)、代谢(metabolism)、器官系统(organismal systems)和未分类(unclassified). 随着灌溉生活污水含盐量的升高,该研究中各处理下环境信息处理、人类疾病及代谢功能的相对丰度均呈增加趋势,其中高含盐污水灌溉处理下代谢功能的相对丰度显著高于低盐灌溉处理(P<0.05). 二级功能预结果(见图7)显示,该研究中土壤含有41类二级代谢通路,筛选出相对丰度前10位的主要功能通路进行比较,分别是膜运输(membrane transport)、氨基酸代谢(amino acid metabolism)、碳水化合物代谢 (carbohydrate metabolism)、复制和修复(replication and repair)、能量代谢(energy metabolism)、难分类的(poorly characterized)、翻译(translation)、辅酶维生素代谢(metabolism of cofactors and vitamins)、脂质代谢(lipid metabolism)和外源生物降解与代谢(xenobiotics biodegradation and metabolism),随着灌溉生活污水含盐量的升高,各二级功能的相对丰度也均呈增加趋势,其中膜运输、氨基酸代谢、碳水化合物代谢、复制和修复以及能量代谢的相对丰度均呈显著变化(P<0.05),其余二级功能的相对丰度增加均不显著(P>0.05).

图7 土壤细菌KEGG代谢通路的相对丰度统计结果Fig.7 Abundances statistics of KEGG metabolic pathways in soil bacteria
采用FUNGuild预测不同含盐农村生活污水灌溉下土壤真菌群落功能(见图8),根据营养方式将真菌分为三大类,分别是腐生营养型(saprotroph)、病理营养型(pathotroph)、共生营养型(symbiotroph). 基于三大营养方式,又进一步细分为若干个功能,如动物病原菌(animal pathogen)、地衣寄生真菌(lichen parasite)、未定义腐生真菌(undefined saprophytic)、木质腐生真菌(wook saprotroph)、凋落物腐生真菌(litter saprotroph)和粪腐真菌(dung saprotroph)等,结果表明,不同处理下土壤真菌群落主要以腐生营养型为主,其中未定义的腐生真菌相对丰度为25.04%~34.14%,其次是病理营养型. 除ZRW中未定义真菌显著高于其他处理组,其他土壤真菌功能的相对丰度较为均衡.

图8 土壤真菌功能群落组成变化Fig.8 Changes in the functional community composition of soil fungi
3 讨论
3.1 含盐生活污水灌溉对土壤理化性质的影响
该研究中土壤盐分含量与土壤TN、TP、OM含量均呈极显著负相关,由于盐胁迫以及高浓度阳离子和阴离子的负相互作用,土壤养分的吸收和利用效率均受土壤盐分含量的影响,土壤盐分含量过高会使土壤养分的利用效率降低. 因此,盐分含量过高的土壤则需要更多的养分. 土壤TN、TP、OM作为土壤肥力水平的重要信息来源,也是决定土壤肥力的重要因素之一,因高含盐生活污水进行农业回用时会造成土壤盐分积累,导致土壤发生盐碱化和土壤肥力降低[15].盐基离子中,因Na+含量增加会使土壤碱度增加,破坏土壤的团聚结构从而影响土壤肥力的释放;Mg2+易使土壤黏粒膨胀,团聚体遭到破坏,加速土壤OM的流失;另外,土壤盐基离子中Mg2+含量占比较低,不利于改善氮磷水平,从而降低土壤养分含量[15];Cl−含量过多会降低土壤微生物活性,从而降低土壤肥力水平,很多情况下,NaCl和CaCl2浓度的增加会降低土壤中的磷浓度,其磷浓度变化范围为20%~50%[16]. 综上,盐基离子含量与土壤养分指标呈负相关,这与笔者所得结果相一致,该研究中,全盐量以及Na+、Mg2+、Cl−、Ca2+、SO42−含量均与土壤TN、TP、OM含量呈极显著负相关.
相关研究也表明,盐分与土壤养分指标存在负相关,如符鲜等[16]在施氮水平与土壤盐分的相关性研究中也发现施氮水平与土壤盐分呈极显著负相关(P<0.01),并且王若水等[17]发现,灌溉结束后表层土壤盐分的增加易使土壤肥力降低. 刘文全等[18]针对土壤盐分与OM含量的空间变异特征研究得到,土壤含盐量与OM含量呈极显著负相关(P<0.01),主要是由于OM作为土壤营养元素的重要来源之一,对土壤形成及其肥力循环均有重要作用,而土壤盐分的增加易使土壤板结,进一步使得土壤孔隙度降低,从而使土壤OM含量减少[19],长时间灌溉含盐生活污水会导致土壤持续接受盐分的摄入,土壤盐分的增加易加快土壤OM的分解,从而导致土壤OM含量降低.
3.2 主要盐基离子与微生物群落的Alpha多样性分析
盐碱土壤中细菌群落多样性指数随盐度的增加表现为减少或增加的情况均有发生[20],影响土壤微生物多样性的因素是多方面的,如土壤类型、气候因素、作物种植以及耕作模式等. 笔者针对40 cm深度处土壤微生物的研究发现,Na+是影响细菌群落Alpha多样性指数的主要影响因子,细菌Chao1指数在ZRW处理下最低,其次是ZW5处理,细菌Shannon-Wiener指数在ZW5处理下最低,随土壤盐度的升高,Shannon-Wiener指数整体呈下降趋势,这时土壤盐度升高后盐分可能进一步影响土壤微生物的生长代谢过程,在此基础上降低了非耐盐菌种的数量,可能是因为土壤盐分对细菌的生长繁殖有一定抑制作用[21].该研究中高含盐(>1 g/L)污水灌溉与土壤细菌Shannon-Wiener指数呈现负相关关系,在1~2 g/L含盐范围内的含盐生活污水灌溉易使土壤细菌生长代谢受到盐分胁迫,从而降低土壤细菌多样性结构. 不同处理下真菌Alpha多样性指数的变化较不规律,但总体呈现增加趋势,真菌抵抗环境胁迫的能力比细菌更强,有研究发现,土壤养分含量对真菌群落多样性影响较小,但土壤含水量增加会提高土壤真菌Alpha多样性[21];而该研究针对不同含盐生活污水灌溉对土壤含水率的试验中得到,各处理下40 cm深度处含水率范围为31.32%~35.22%,可见高含盐生活污水灌溉相较于低含盐而言更易导致土壤发生饱和现象,增加土壤持水性,从而增加了土壤真菌群落多样性. 李媛媛等[22]针对影响半干旱地区土壤真菌群落多样性的驱动因素研究发现,电导率与土壤真菌多样性呈正相关,可能是耐盐类真菌有所增加致使这一现象发生.
3.3 含盐生活污水对土壤细菌和真菌组成的影响
该研究中细菌群落结构差异主要是由Proteobacteria、Actinobacteria、Chloroflexi引起的,且盐分、OM是影响细菌群落组成的主控因子[23]. 因盐基离子中Mg2+易使土壤黏粒膨胀、团聚体遭到破坏,加速土壤OM的流失,而该研究得到土壤全盐量与OM含量呈显著负相关(P<0.05),OM是土壤肥力的主要供给来源,土壤肥力的缺失也进一步限制了土壤微生物的生长. Egamberdieva等[24]发现,含盐水灌溉会导致土壤中Cl−、Ca2+发生积累,盐分含量增加也会导致土壤微生物群落丰度降低,盐基离子中影响微生物群落的主控因子为Cl−,也有研究指出,氯化物对土壤微生物的抑制作用大于硫酸盐等[25],而笔者得出40 cm深度处Cl−对微生物群落的影响程度大于SO42−的影响程度. 综上,农村生活污水中的主要的盐基离子对微生物的抑制作用大于促进作用.
该研究中Actinobacteria相对丰度增加原因可能有两方面:一是Actinobacteria为含盐土壤中的优势菌门,对土壤污染物抵抗性强,有较强的耐受性;二是因为盐分是影响微生物脱氮的重要环境因子,在土壤氮循环过程中会使部分氮挥发,或者是盐分增加的过程中制约了脱氮菌活性,土壤氮素的减少可能影响了Actinobacteria的生长,有关土壤盐分对土壤微生物氮循环的影响应有待进一步深入研究. 此外,该研究用水来自农村生活污水,不排除污水中含有其他与Actinobacteria共生的菌种. Proteobacteria主要是由α纲、β纲和γ纲组成,有较多的固氮细菌,在氮循环过程中Proteobacteria可对土壤剩余氮素起到稳定作用[26],而α-Proteobacteria主要存在于盐水生境中,因此变形菌门对进一步提高土壤养分循环发挥着促进作用[26]. Acidobacteria是一种嗜酸性细菌菌门,高含盐(>1 g/L)生活污水灌溉下的土壤环境不利于其生长,因此碱性土壤中Acidobacteria的相对丰度显著降低(P<0.05). 优势菌属中Arthrobacter、Gaiella属于Actinobacteriota,Arthrobacter作为土壤中最为常见的细菌之一,并且有较高适应性,对于高含盐环境具有适应能力,且具有用于生物修复的潜力[27].Sphingomonas属于Proteobacteria,其适应性强且能分解复杂的有机分解物,在含盐量较高的土壤中有较强的适应能力[28].
有研究表明,子囊菌门是不同盐度下土壤真菌网络中的最主要类群,不同盐度土壤均以Ascomycota为核心节点[29],这与笔者得到的Ascomycota为不同处理下的优势菌门结果相一致. 该研究中,原水处理下Basidiomycota的相对丰度显著增加(P<0.05),可能是原水中存在促进担子菌门生长的物质,Basidiomycota中存在一些有害真菌,其促进担子菌门(Basidiomycota)增长的原因有待进一步研究. 随灌溉用水含盐量的升高,土壤中Chaetomium的相对丰度极显著降低(P<0.01),Chaetomium作为子囊菌门中有益菌属,Chaetomium的减少有可能使土壤中致病菌增多,进一步影响真菌群落多样性结构.Metarhizium作为含盐生活污水灌溉下的优势菌属,Metarhizium的一些代谢产物可能在农业应用中存在一定的应用价值[30],该研究发现,Metarhizium的相对丰度随盐度升高呈降低趋势,使用含盐生活污水灌溉可能会降低其有益价值.
3.4 含盐生活污水灌溉下土壤细菌和真菌功能预测分析
该研究通过PICRUST1功能预测发现,代谢功能的相对丰度最高,说明代谢通路是该细菌群落的主要核心功能. 高含盐生活污水灌溉处理土壤中的代谢功能显著高于低含盐生活污水灌溉处理,这可能是由于盐分迁入破坏了原有细菌群落的稳定性,从而使高含盐生活污水灌溉下土壤细菌代谢功能较为活跃,这与李松旌等[31]针对再生水灌溉下土壤细菌预测功能的结果一致. 二级功能预测分析中相对丰度中较高的为膜运输、氨基酸代谢、碳水化合物代谢. 膜运输与Firmicutes相关,Firmicutes中富含许多与膜运输的相关基因,ZW5、ZW4处理下Firmicutes的相对丰度高于ZW1、ZW2处理,说明可能是在盐分的影响下高含盐处理的膜运输显著高于低含盐处理;高含盐处理下土壤细菌中氨基酸代谢功能相对丰度较高;土壤中的氮固定与磷溶解主要与碳水化合物代谢有关[32-35],而Actinobacteria、Proteobacteria是该含盐范围含盐生活污水灌溉下的主要优势菌门,Actinobacteria中存在较多可促进动植物遗骸腐烂的好氧性腐生菌,Proteobacteria中存在许多代谢种类,这两种菌门参与土壤中氮循环及固氮作用,与碳水化合物代谢有很大的相关性[36]. 该研究中细菌功能预测分析与细菌群落优势菌门功能相类似,通过细菌优势菌门的特点及功能也可进一步验证含盐生活污水灌溉下的土壤细菌和真菌功能预测结果的可靠性.
与细菌相比,真菌在土壤中以多种方式吸收营养,生活环境更为复杂,该研究中腐生功能型真菌具有显著优势. 首先从营养类型来看,各处理下土壤真菌均以腐生营养型为主,这可能是因为子囊菌门多为腐生菌,而子囊菌门是最主要的优势菌门,是土壤中最重要的分解者,这与杨盼等[37]的研究结果一致;其次是病理营养型,病理营养型主要通过损害宿主细胞而获取营养,这部分易造成植物病害. 而共生营养型是通过与宿主细胞交换资源来获取营养,对植株生长及品质产生有益作用[38],可能是因为含盐污水对共生营养型菌有抑制作用,若长时间使用可能不利于作物生长.
4 结论
a) 盐分含量会影响土壤水分的有效性及微生物细胞的生理和代谢过程,从而影响细菌群落及多样性变化. 高含盐(>1 g/L)农村生活污水灌溉会显著降低土壤细菌的Shannon-Wiener指数,但会显著增加土壤真菌的Shannon-Wiener指数与Chao1指数. 其中,Na+是影响细菌Alpha多样性的主要影响因子,Na+含量与Chao1指数、Shannon-Wiener指数均呈极显著负相关(P<0.01). 全盐量、Ca2+含量均与真菌Shannon-Wiener指数、Chao1指数、ACE指数呈显著正相关(P<0.05).
b) 含盐量不同的生活污水灌溉会导致土壤微生物群落结构具有显著性差异,且高含盐(>1 g/L)的生活污水灌溉会显著影响土壤细菌群落的相对丰度,其中Mg2+、Cl−是影响细菌优势菌门的主要影响因子.
c) 含盐生活污水灌溉下土壤细菌功能预测代谢通路多为膜运输、氨基酸代谢、碳水化合物代谢;土壤真菌功能预测显示真菌功能多以腐生营养型与病理营养型为主.

