人工纳米材料增强植物耐盐性的机理研究
朱立祺,陈菲然,陶梦娜,刘璎琳,赵晓丽,王震宇*
1. 江南大学环境与土木工程学院环境过程与污染控制研究所,江苏 无锡 214122
2. 中国海洋大学环境科学与工程学院,山东 青岛 266000
3. 中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012
近年来,由于气候变暖、化肥农药滥用以及不合理灌溉等因素导致土地盐渍化加剧,全球超过1.0×107km2的土地受到盐分的影响,且大半的灌溉土地受到不同程度土壤盐渍化的影响,进一步导致农作物产量降低[1-3]. 根据联合国人口活动基金的报告,到2050年全球人口将增至93亿,这意味着人类对粮食的需求将极大增加[4-5]. 盐胁迫主要通过渗透作用和离子作用影响植物生长发育. 渗透作用主要导致植物水分吸收减少,细胞生长减缓等;离子作用则主要体现在细胞内Na+、Cl-等有毒离子的过度累积对植物造成的毒性作用[6]. 其中,过量Na+累积而造成的离子毒性被认为是主导因素,因为Na+可取代K+在许多细胞酶促反应中的作用,如卡尔文循环、糖酵解和苯丙烷途径等,并大幅降低这些酶的活性[7]. 因此,寻找提高植物耐盐性的方法迫在眉睫.
传统的农药和化肥在提高粮食产量的同时,对人类与生态环境的安全存在一定威胁,而新型农业技术如转基因作物还未受到公众广泛的认可[8]. 近年来,纳米材料(NMs)因其高效、缓释等特点在农业增产和环境修复中的应用已崭露头角[9-10]. 已有研究[11]表明,NMs可以显著提高植物耐盐性并促进植物生长及提高作物产量. 然而,目前关于NMs增强植物耐盐性的分子机制研究仍较少,深入研究NMs刺激下的植物耐盐机理将有助于进一步拓展纳米农业的应用,最终可持续地增加粮食产量[4].
NMs是指在三维尺度中任意一个尺度小于100 nm的材料,其具备独特的物理化学性质,能以不同的方式与生物体相互作用[12]. 有研究[13-15]表明,一些NMs可进入植物组织内部,增强植物的新陈代谢活动,并增强植物抗逆性,如今越来越多的NMs逐渐被应用于农业生产中提高作物产量并增强抗性. 纳米二氧化钛(nTiO2)和纳米硒(nSe)具有增强植物耐盐能力的作用,如Hojjat等[16]发现,20 mg/L的nTiO2可以减轻盐胁迫对豌豆种子萌发和幼苗早期生长发育过程中的不利影响. 此外,nTiO2还可促进盐胁迫下大麦植株的生长和光合性能[17]. Zahedi等[18]研究发现,叶面喷施nSe可以提高草莓在盐胁迫环境下的产量,并且在改善果实品质方面具有积极作用. Soleymanzadeh等[19]发现,10 μmol/L的nSe可以通过调节离子稳态、提高光合效率和增强抗氧化能力来缓解草莓受到的盐胁迫. 施用nSe不仅有利于增强番茄耐盐性,还有助于增加番茄果实中有益物质的含量[20]. 总之,NMs对植物耐盐的提升作用主要归结于维持离子稳态、促进光合作用和增强抗氧化能力这三方面机制. 已有研究[3,18,21-22]从基因、蛋白水平对以上机制进行了深入挖掘,然而在代谢水平的分析还较为欠缺. 小分子量的代谢物作为基因表达的最终产物,其变化可有效体现生物活性的变化[23]. 代谢组可全面监测代谢途径的全过程,包括前体、中间体和产物,从生物学活动的末端小分子化合物角度阐明植物生理生化过程. 因此,代谢组在研究胁迫环境下植物的行为变化方面具有不可忽视的作用[24].
烟草(Nicotiana tabacumL.)BY-2悬浮细胞作为一种模式植物细胞,具有繁殖迅速、同质性好等优点[25]. 许多研究利用悬浮细胞作为模型研究逆境中植物的响应机制,已有研究将烟草BY-2悬浮细胞作为探索植物耐盐机理的工具. 研究[26-27]表明,适应盐胁迫的烟草BY-2悬浮细胞中阿拉伯半乳糖蛋白的含量增加,该蛋白是一种钠载体. Wang等[28]研究发现,在烟草BY-2悬浮细胞中过表达PeTPK1基因提高了烟草的盐耐受性. 另有研究[29]指出,植物体内的代谢产物如氨基酸、糖类、有机酸和脂肪酸等物质的积累与植物的耐盐性密切相关. 因此,该研究以烟草 BY-2悬浮细胞为供试材料,采用非损伤微测系统(NMT)原位实时检测Na+的净流速,研究盐胁迫下施加NMs对细胞Na+外排能力的影响,精确反映NMs对细胞外排Na+的调控作用[30];同时,利用液相色谱质谱联用(LC-MS/MS)技术分析盐胁迫下烟草BY-2悬浮细胞暴露于NMs后的代谢变化,探讨代谢水平变化与NMs介导的耐盐性关系,从代谢组的角度揭示NMs提升植物耐盐性的机理,以期为广泛应用纳米农业技术提高植物耐盐性提供理论基础.
1 材料与方法
1.1 试验材料
试验材料为烟草BY-2悬浮细胞,由山东农业大学生命科学学院提供. nSe (约70 nm)通过室温固相反应合成,将SeO2和抗坏血酸按物质的量1∶2放入研钵,并加入1/10总质量的聚乙烯吡咯烷酮(PVP),研磨至红色糊状,干燥,获得nSe[31]. nTiO2(<25 nm)购自美国Sigma-Aldrich公司.
1.2 试验设计
将烟草BY-2悬浮细胞接种于MS培养基中,在避光、25 ℃、130 r/min条件下培养. 初始接种量为40 g/L,培养7~10 d进入对数生长期后进行试验. 在进行NMs暴露试验前,先将对数生长期细胞分别转移至1/2 MS培养基和含有100 mmol/L NaCl的1/2 MS培养基中适应24 h. 将1/2 MS培养基中适应24 h的细胞作为对照组(CK),将含有100 mmol/L NaCl的1/2 MS培养基中适应24 h的细胞作为盐胁迫处理组(S),将在含有100 mmol/L NaCl的1/2 MS培养基中适应24 h后分别暴露0.05、0.1、0.5 mg/L的nTiO2或nSe的细胞作为盐胁迫下NMs处理组(S-nTiO2或S-nSe). NMs对植物的生长具有低促高抑的效应,研究[32-34]表明,小于10 mg/L的NMs会对植物细胞产生毒害作用. 预试验发现,5和10 mg/L的nTiO2和nSe均会对细胞活性产生抑制作用,因此该研究设置0.05、0.1、0.5 mg/L作为暴露浓度. 细胞暴露于NMs的同时,向CK和S处理组分别加入等体积的无菌水,经2、4、6、12、24、48、72 h后取样测定细胞活性. 细胞活性试验各处理组设置3个生物学重复,细胞表面Na+流速测定试验和代谢组试验中各处理组设置8个生物学重复.
1.3 试验方法
1.3.1 细胞活性测定
每种NMs设置3个暴露浓度(0.05、0.1、0.5 mg/L),在每个取样时间点(2、4、6、12、24、48、72 h)取1 mL细胞悬液于1.5 mL离心管中,自然沉降10 min.用针头注射器小心吸取去除上清液,用0.1 mol/L 磷酸盐缓冲液(PBS, pH=7.2)洗涤细胞3次. 去除上清液后加入1 mL 0.3%氯化三苯四氮唑(TTC)溶液(溶剂为0.05 mmol/L PBS, pH=7.2),25 ℃避光孵育8 h后,6 000 r/min离心,去除上清液,加入1 mL 95%乙醇,60 ℃水浴加热15 min,细胞基本呈发白状,6 000 r/min离心5 min. 吸取200 μL上清液至酶标板,用酶标仪(Varioskan LuX型, 美国Thermo公司)在485 nm下测定吸光度,以每个时间点的CK为基准进行归一化处理计算细胞活性[35].
1.3.2 NMT原位测定Na+净流速
利用NMT〔NMT-100S-SIM-XY型, 旭月(北京)科技有限公司〕测定Na+流速. 采用尖端直径为4~5 μm的传感器,于顶端填充250 mmol/L NaCl (长度约1 cm),并通过传感器制备装置于尖端吸取约50 μm的Na+专用LIX试剂,以0.5和5 mmol/L Na+进行校正,保持能斯特斜率在58±5范围内方可开始测试. 在相应时间点取1 mL细胞悬液加到特制盖玻片上(在小型35 mm塑料培养皿中),固定10 min后移除培养基及未固定细胞,加入5 mL测试液(测试液成分为1 mmol/L NaCl、0.1%蔗糖,pH=5.3)稳定10 min,更换新的测试液(5 mL)后准备测试样品. 将传感器靠近细胞壁距离细胞核最近的位置,距细胞壁表面约1~2 μm,步进设置为20 μm.
1.3.3 代谢产物提取与鉴定
取各处理组烟草BY-2悬浮细胞样品各20 mg,经液氮速冻并研磨成粉状,加入1 mL提取液(80%甲醇水溶液,含0.1%甲酸和内标)涡旋混匀,冰浴超声(35 kHz) 30 min;随后于4 ℃、12 000 r/min离心15 min,取700 μL上清液旋干,用100 μL甲醇、乙腈、水(体积比为4∶4∶2)复溶,4 ℃、12 000 r/min离心10 min,取上清进样分析,并确保样品中无杂质及气泡.各样品取等体积作为质量控制(QC),每8个样品设置一个QC.
采用Acquity HSS T3色谱柱(内径2.1 mm, 长度100 mm, 填料内径1.8 μm)和Agilent Hilic Poroshell 120色谱柱(内径2.1 mm, 长度100 mm, 填料内径2.7 μm)进行分离,利用LC-MS/MS对样品中的代谢物进行检测(Q-Exactive质谱仪,美国Thermo公司). T3色谱柱液相洗脱液为流动相A1 (0.1%甲酸水溶液)和流动相B1 (0.1%甲酸乙腈溶液),洗脱时间共18 min,其中0~1.5 min用5% B1洗脱,1.5~15.5 min B1由5%线性增至100%,15.5~16 min B1由100%线性降至5%,16~18 min再用5% B1进行平衡. Hilic色谱柱液相洗脱液为流动相A2 (0.1%甲酸水溶液和5 mmol/L乙酸铵)和流动相B2 (0.05%甲酸溶于95%乙腈溶液和5 mmol/L乙酸铵),洗脱时间共15 min,其中0~7 min B2由98%线性降至75%,7~10 min B2由75%线性降至10%,10~13 min用10% B2平衡,13~13.5 min B2由10%线性增至98%,13.5~15 min再用98% B2平衡. 流速均为0.35 mL/min,进样量为5 μL. ESI源参数设定:鞘气流速35 L/min;保护气流速15 L/min;毛细管温度320 ℃;保护气加热器温度350 ℃;喷雾电压分别为3.5 kV(+)和−3.0 kV(−).
1.4 数据处理
采用单因素方差分析(ANOVA)和最小显著性差异(LSD)检验确定处理之间的差异显著性,NMT离子流速数据来自imFluxes V2.2软件并通过旭月科技有限公司流速云平台进行处理,数据表示为Mean±SEM,代谢组数据首先根据Compound Discoverer 3.1.0.305软件筛选出可用代谢物,归一化后根据相对标准偏差(RSD)≤50%再次筛选,根据代谢物名称在HMDB数据库找到其编号,舍去非内源化合物,综合各模式结果去除重复代谢物,获得处理后文件. 使用Metaboanalyst 5.0软件进行数据分析时,选择Statistical Analysis,使用中位数标准化结合Pareto Scaling,获得聚类分析和主成分分析结果并筛得差异代谢物,分别选择Enrichment Analysis和Pathway Analysis进行富集分析和通路分析.
2 结果与讨论
2.1 NMs对盐胁迫下细胞活性的影响
不同浓度和时间NMs处理下烟草BY-2悬浮细胞的细胞活性如图1所示. 由图1可见,与CK相比,S处理组细胞活性明显下降了34.3%±9.0%,而S-nTiO2(0.1 mg/L)处理组在6 h时细胞活性比S处理组显著增加了8.1%,S-nSe (0.5 mg/L)处理组在12 h时细胞活性比S处理组显著增加了13.6%. 因此,选取处理6 h的S-nTiO2(0.1 mg/L)处理组和12 h的S-nSe (0.5 mg/L)处理组开展后续试验.

图1 不同浓度nTiO2和nSe处理下BY-2悬浮细胞的活性Fig.1 Viability of BY-2 cell suspensions exposed to different concentrations of nTiO2 and nSe
2.2 NMs对盐胁迫下烟草BY-2悬浮细胞Na+流速的影响
盐胁迫下烟草BY-2悬浮细胞表面的净Na+通量(外排)大幅增加,这可能是烟草BY-2悬浮细胞自身应对盐胁迫的响应机制. 测定S-nTiO2(0.1 mg/L)处理组在6 h或S-nSe (0.5 mg/L)处理组在12 h时细胞表面的Na+流速(见图2),结果发现,Na+外排进一步增加,盐胁迫下细胞暴露于0.1 mg/L nTiO2(6 h)使Na+外排较S处理组显著增强了171.5%,盐胁迫下细胞暴露于0.5 mg/L nSe (12 h)使Na+外排较S处理组显著增强了99.0%,增强的Na+外排可以减少Na+在烟草BY-2悬浮细胞体内的累积和毒害作用. 研究[2]表明,细胞膜上的Na+/H+逆向转运蛋白是主要的Na+外排离子通道,也是盐过敏感(SOS)信号通路(将Na+从胞内排除至胞外的主要机制)的重要组成.Chen等[36]通过NMT研究发现,Na+/H+逆向转运蛋白的高表达增强了植物向外分泌Na+的能力. 由此推测,nTiO2和nSe可能通过直接或间接增强Na+/H+逆向转运蛋白的活性和表达从而增强盐胁迫下细胞外排Na+的能力.
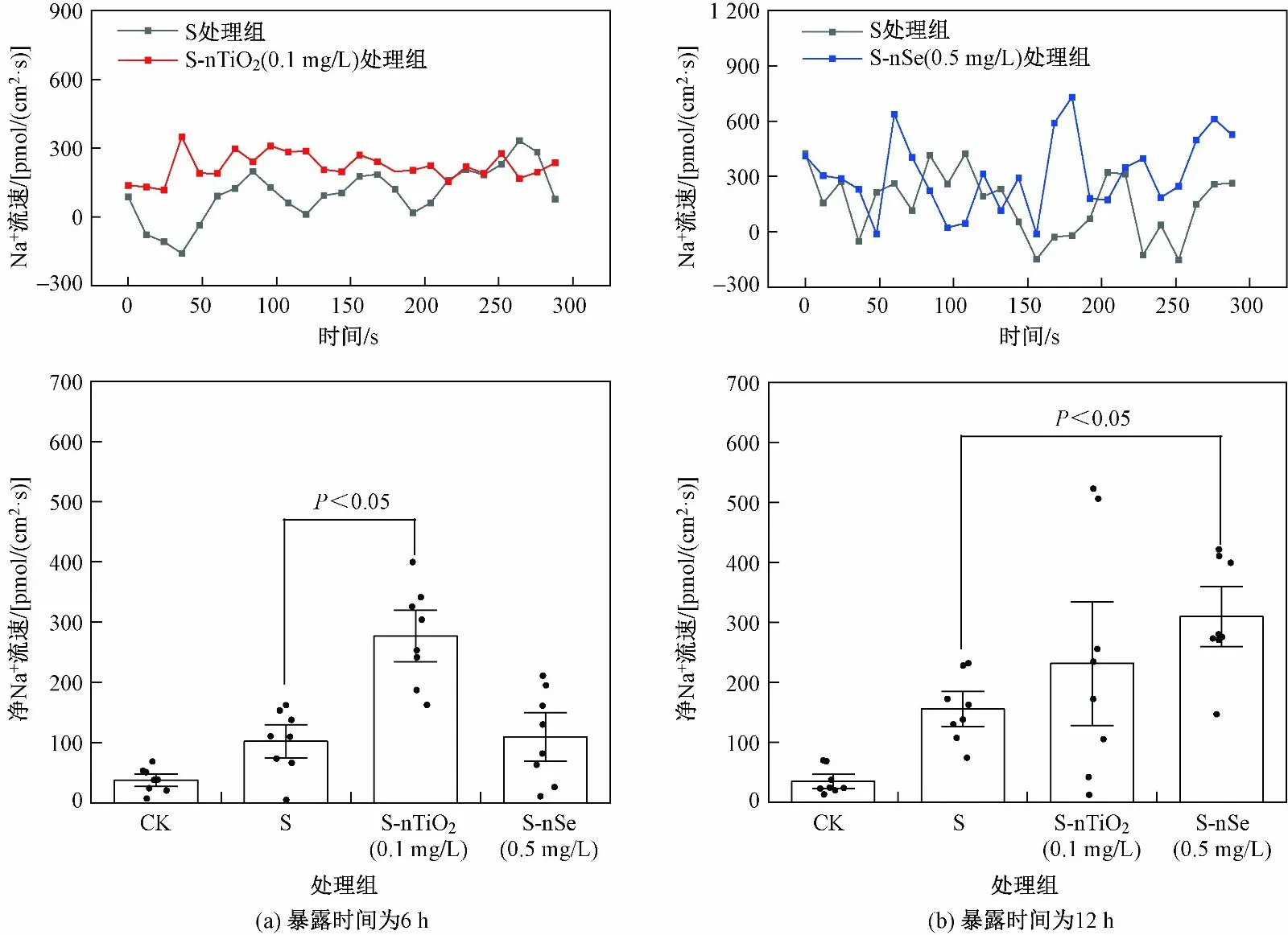
图2 NMs处理下BY-2悬浮细胞表面Na+流速变化Fig.2 Net Na+ flux on BY-2 cell suspensions surface after NMs exposure
2.3 NMs增强BY-2细胞耐盐性的代谢水平机制
2.3.1 NMs处理下细胞代谢物的变化
CK、S和S-nTiO2(0.1 mg/L)等3个处理组一共检测到128种代谢物,CK、S和S-nSe (0.5 mg/L)等3个处理组一共检测到137种代谢物. 对这128种代谢物和137种代谢物进行稀疏偏最小二乘判别分析(见图3)发现:经两种NMs处理后的代谢物组成与S处理组相比发生显著变化,暴露于0.1 mg/L nTiO26 h后,第一主成分将CK处理组与其他处理组明显分离,并代表样品总变化量的21.3%;第二主成分将S处理组与S-nTiO2(0.1 mg/L)处理组明显分离,并代表样品总变化量的15.8%. 暴露于0.5 mg/L nSe 12 h后,代谢物组成也发生显著变化,第一主成分将3个处理组明显分离,并代表样品总变化量的35.6%. 两种NMs均对盐胁迫下烟草BY-2悬浮细胞的代谢调控产生显著影响,其中nSe导致的变化更明显.

图3 NMs处理后BY-2悬浮细胞所有代谢物的稀疏偏最小二乘判别分析Fig.3 Sparse partial least squares-discriminant analysis of all metabolites in BY-2 cell suspensions exposed to NMs
2.3.2 差异代谢物筛选及聚类分析
根据多元统计分析的正交偏最小二乘法分析(OPLS-DA)来研究0.1 mg/L nTiO2或0.5 mg/L nSe处理后与S处理组代谢物的差异,变量权重值(VIP)大于1的变量为差异变量,综合考虑将单变量统计分析T检验下P值小于0.05的代谢物认定为差异代谢物[37].
CK、S和S-nTiO2(0.1 mg/L)等3个处理组共有53种差异代谢物,其中34种代谢物表达上调,19种代谢物表达下调,通过系统聚类分析发现这些差异代谢物可以分为两大类,第一类主要有激素和部分氨基酸,第二类主要有脂肪酸、嘌呤和氨基酸,各处理组重复性较好,其中S-nTiO2(0.1 mg/L)处理组与CK聚为一类,S处理组单独为一类(见图4),说明0.1 mg/L nTiO2处理6 h后烟草BY-2悬浮细胞的代谢状态更趋近于CK处理组,表明nTiO2对盐胁迫有缓解作用.

图4 nTiO2处理导致BY-2悬浮细胞差异代谢物分层聚类热图Fig.4 Hierarchical clustering heatmaps of differential metabolites in BY-2 cell suspensions exposed to nTiO2
CK、S和S-nSe (0.5 mg/L)等3个处理组共有73种差异代谢物,其中33种种代谢物表达上调,40种代谢物表达下调. 通过系统聚类分析发现,这些差异代谢物可以分为两大类,第一类主要有嘌呤、脂肪酸和部分氨基酸,第二类主要有氨基酸和部分有机酸,CK和S处理组聚为一类,而S-nSe (0.5 mg/L)处理组则单独为一类(见图5),说明nSe与nTiO2导致的耐盐性机制不同,它们可能通过不同的代谢途径增强细胞的耐盐性.

图5 nSe处理导致BY-2悬浮细胞差异代谢物分层聚类热图Fig.5 Hierarchical clustering heatmaps of differential metabolites in BY-2 cell suspensions exposed to nSe
2.3.3 NMs处理下的差异代谢物分析
对CK、S和S-nTiO2(0.1 mg/L)等3个处理组的53种差异代谢物进行富集分析发现,差异代谢物主要有氨基酸和肽(13种)、脂肪酸和共轭物(3种)、三羧酸循环(TCA cycle)有机酸(2种)、肉桂酸(2种)、胺类(2种)、有机二羧酸(2种)、吲哚(2种)、嘧啶(2种)、嘌呤(2种)、单糖(2种)、苯(2种)〔见图6(a)〕.相比S处理组,S-nTiO2(0.1 mg/L)处理组中有5种氨基酸和肽的相对含量增加,包括甜菜碱(增加了2.92倍)、O-乙酰丝氨酸(增加了1.95倍)、N6-乙酰-左旋赖氨酸(增加了2.14倍)、甘氨酸(增加了1.40倍)和γ-氨基丁酸(增加了1.60倍). 氨基酸作为一种重要的代谢物质,参与植物体内的物质和能量代谢,在植物面临各种胁迫时产生不同程度的累积[38]. 其中,γ-氨基丁酸是一种非蛋白质氨基酸,盐胁迫下植物可通过增加γ-氨基丁酸的合成来清除自由基从而减少氧化胁迫,通过增加细胞内的氮含量从而有效缓解盐胁迫[39-40]. 脂肪酸和共轭物类物质的相对含量均增加,包括甲戊酸(增加了1.58倍)、3-羟甲基戊二酸(增加了3.63倍)、脱硫生物素(增加了3.92倍),这些物质的增加可提高膜磷脂含量从而增强细胞膜完整性[41]. TCA cycle中重要的中间产物−顺乌头酸和富马酸的相对含量也分别显著增加了4.99和15.36倍,表明TCA cycle的加强. TCA cycle连接糖酵解和氨基酸生物合成,通过产生ATP和NADH对呼吸和能量生成过程起重要调节作用[42]. 胺类物质中卟啉原和组氨醇的相对含量分别增加了2.57和0.20倍,在盐胁迫条件下胺类物质中多胺会大量累积,调节各种生理生化功能,包括生长发育、增殖衰老死亡和基因表达等,在抵御盐胁迫方面起重要作用[38]. 盐胁迫下植物会增加核苷酸类物质的合成[43-44],而0.1 mg/L nTiO2使得嘧啶(尿苷、5-甲基胞嘧啶的相对含量分别增加了1.62、0.87倍)和嘌呤(腺苷、黄嘌呤的相对含量分别增加了0.38、27.62倍)的相对含量均显著增加. 单糖物质〔如木糖(相对含量增加了1.73倍)和甘露糖(相对含量增加了3.17倍)〕的增加有助于维持细胞膜的稳定性,同时起到保护蛋白质的作用,缓解细胞受到的胁迫[38]. 通过差异代谢物通路分析(P≤0.05,通路影响值≥0.1)筛选得到2条差异代谢通路,分别为精氨酸生物合成以及精氨酸和脯氨酸代谢〔见图6(c)〕.

图6 差异代谢物富集分析和通路分析Fig.6 Cluster analysis and enrichment analysis of differential metabolites
对CK、S和S-nSe (0.5 mg/L)等3个处理组的73种差异代谢物进行富集分析发现,差异代谢物主要有氨基酸和肽(15种)、TCA cycle有机酸(2种)、生物碱类(2种)、苯(3种)、有机二羧酸(2种)、吲哚(2种)、苯甲酸(2种)、单糖(2种)、脂肪酸和共轭物(5种)、黄酮类(5种)〔见图6(b)〕. 相比S处理组,S-nSe (0.5 mg/L)处理组中有10种氨基酸和肽的相对含量增加,包括酪氨酸(增加了3.88倍)、苯丙氨酸(增加了7.50倍)、脯氨酸(增加了44.33倍)、天冬酰胺(增加了1.62倍)、鸟氨酸(增加了3.80倍)、精氨酸(增加了3.65倍)、缬氨酸(增加了5.03倍)、色氨酸(增加了3.72倍)、n-乙酰鸟氨酸(增加了2.08倍)、乙酰精氨酸(增加了1.50倍)等. 脯氨酸是一种渗透保护剂和重要的信号分子,在植物细胞质中具有稳定和保护细胞膜、蛋白酶及不同蛋白质的功能,它可以通过增加膜蛋白、清除活性氧和维持细胞溶质稳态来调节植物在逆境中的新陈代谢[38,45]. 吲哚乙酸和吲哚丙烯酸的相对含量分别增加了25.15和3.72倍,而研究[46]表明,生长素(吲哚乙酸)信号可以通过与拟南芥的氧化还原代谢相互作用参与对盐胁迫的适应性反应. 通过差异代谢物通路分析(P≤0.05,通路影响值≥0.1)筛选得到6条差异代谢通路,分别为精氨酸生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,苯丙氨酸代谢,精氨酸和脯氨酸代谢,异喹啉生物碱生物合成以及酪氨酸代谢〔见图6(d)〕.
研究[21,47]发现,对植物施用nTiO2可以增强抗氧化酶活性以及增加可溶性糖和氨基酸等含量,从而提高植物耐盐性. 通过代谢组学分析发现,nTiO2显著增加了部分氨基酸和肽、脂肪酸和共轭物、TCA cycle有机酸、胺类、核苷酸类物质(嘧啶和嘌呤等)以及单糖等物质的相对含量,因此nTiO2可能是通过增加部分氨基酸和糖类物质的生物合成从而增强烟草BY-2悬浮细胞的耐盐性. nSe对植物耐盐性影响的研究[18]发现,nSe主要通过增强光合作用、提高抗氧化酶活性,增加渗透物质(可溶性碳水化合物和脯氨酸)的积累从而增强植物的耐盐性. 此外,nSe处理还会增加吲哚乙酸和水杨酸等植物激素的含量[18-19].代谢组学结果显示,nSe显著增加了氨基酸和肽类物质以及吲哚类物质的相对含量,水杨酸、脯氨酸和吲哚乙酸均大幅增加,表明nSe可能通过增强这几类物质的合成从而增强烟草BY-2悬浮细胞在盐胁迫下的耐受性. 综上,两种NMs分别通过调控不同的代谢物合成途径从而增强烟草BY-2悬浮细胞的耐盐性,nTiO2主要增强多种不同类别代谢物的合成,而nSe则主要增强氨基酸和肽类物质、吲哚类物质以及水杨酸的合成.
2.3.4 NMs调控下的差异代谢物与Na+外排相关性分析
将暴露于nTiO2和nSe后得到的差异代谢物与对应处理组的Na+流速进行相关性分析(见表1).nTiO2导致的差异代谢物中与Na+外排相关性较大物质分别为尿苷、吡哆醛、甘露糖、大麦芽碱和葫芦巴碱,nSe导致的差异代谢物中与Na+外排相关性较大的物质分别为吲哚丙烯酸、色氨酸、苯丙氨酸和酪氨酸,这几类物质都参与莽草酸途径或相关下游途径.研究[48]表明,盐胁迫下苯丙氨酸和色氨酸会发生累积,因此nSe极有可能通过调控莽草酸代谢途径促进Na+外排从而增强植物耐盐性.

表1 NMs处理下细胞不同差异代谢物与Na+外排相关性Table 1 Correlation between Na+ efflux and differential metabolites in BY-2 cell suspensions altered by NMs exposure
相关性分析发现,两种NMs暴露后富马酸和黄嘌呤均与Na+外排呈显著正相关,而其他物质在两种NMs暴露下呈不同的调控模式. 其中,富马酸作为TCA cycle的中间体,在生物能量生产中发挥着重要作用;而黄嘌呤的累积可激活黄嘌呤脱氢酶将其转化为尿酸,去除过量的ROS. 研究[49]表明,外源施加黄嘌呤和尿酸可增强苹果对盐胁迫的耐受性. 因此,富马酸和黄嘌呤可能对NMs提高盐胁迫下植物Na+外排从而增强植物耐盐性起重要推动作用.
3 结论
a) 盐胁迫导致烟草BY-2悬浮细胞的细胞活性显著降低34.3%±9.0%,而盐胁迫下细胞暴露于0.1 mg/L nTiO2(6 h)和0.5 mg/L nSe (12 h)使细胞活性比S处理组分别显著增强8.1%和13.6%.
b) 暴露于0.1 mg/L nTiO2(6 h)和0.5 mg/L nSe(12 h)后,烟草BY-2悬浮细胞表面Na+外排比S处理组均显著增强(171.5%和99.0%),说明两种NMs可能通过增加Na+外排从而提高耐盐性,最终增加细胞活性.
c) 对两种NMs暴露后各处理组进行代谢组学分析发现,两种NMs暴露均显著改变了盐胁迫下细胞的代谢物组成. nTiO2通过增加多种代谢物(部分氨基酸和肽、脂肪酸和共轭物、TCA cycle有机酸、糖类和嘧啶等物质)的含量从而增强烟草BY-2悬浮细胞在盐胁迫下的耐受性,而nSe则主要通过增加氨基酸和肽、吲哚和水杨酸等物质的合成来增强细胞的耐盐性. 此外,富马酸和黄嘌呤在两种NMs处理下都与Na+外排呈显著正相关,其中,nSe可能通过调控莽草酸代谢途径及相关代谢物促进Na+外排.
d) 该研究从代谢水平揭示了两种NMs (nTiO2和nSe)增强植物耐盐性的不同分子机制.

