酵母菌对锕系核素239Pu的富集行为及减量化研究
聂小琴,董发勤,刘 宁,刘明学,张 东,李晓安
1. 西南科技大学,核废物与环境安全国防重点学科实验室,四川 绵阳 621010
2. 绵阳市中心医院,国家卫生健康委员会核技术医学转化重点实验室,四川 绵阳 621000
3. 西南科技大学,固体废物处理与资源化教育部重点实验室,四川 绵阳 621010
4. 四川大学原子核科学技术研究所,辐射物理及技术教育部重点实验室,四川 成都 610064
5. 西南科技大学生命科学与工程学院,四川 绵阳 621010
6. 中国工程物理研究院核物理与化学研究所,四川 绵阳 621900
钚(Pu)作为锕系元素,在两方面具有独特的性质,一是5f电子复杂的成键行为,Pu存在6种同素异形体;二是Pu位于Th~Pu (5f电子具有巡回性质的轻锕系元素)和Am以后元素(5f电子具有局域性的重锕系元素)之间,同时具备局域和非局域的性质.自从1940年Pu被发现后,由于人为活动,目前全球库存的Pu总量已超过2 500 t[1]. Pu以Pu(Ⅲ)、Pu(Ⅳ)、Pu(Ⅴ)、Pu(Ⅵ)几种不同氧化态在溶液中共存,其在地下水和工程屏障中的主要化学形态为Pu(OH)5−,当pH小于5以及Eh值低于−0.5 V时,Pu主要为+3价[2],随着环境介质的改变,可能发生氧化反应、配位反应及水解和沉淀反应等,其水溶液化学行为十分复杂. 由于Pu是极毒的长寿命超铀元素,在中放废液中对放射性活度的贡献最大从而引起广大科技工作者的广泛关注;另外,在核污染场地中,Pu在生物圈中的迁移行为也一直备受国内外学者的重视[3-5]. 研究[6-7]表明,超铀废物、高中放废液、放射性核素污染场地(如超铀核素污染土壤和废物处置场)中赋存的土著微生物具有很强的环境适应性和耐辐射能力,是超铀核素(如239Pu等)污染修复和锕系核素分离的潜在优势菌种,在放射性废液锕系核素分离处理中具有较高的应用前景. 国内外研究[8-10]发现,一些微生物由于其表面的活性基团对锕系元素具有很强的络合能力.传统的生物吸附是基于代谢非依赖的物理化学反应的被动吸附过程,而通过细胞的代谢活动使金属离子通过细胞壁膜进入细胞内的吸收可称为主动吸收,把被动、主动吸收统称为生物积累或生物富集[11-13]. 无论是活体还是灭活(是否依赖于代谢活动),菌体表面的活性基团在吸附反应初期都起着十分重要的作用[14-17],通过化学预处理或表面修饰有助于进一步明确生物修复过程中微生物表面官能团的定性和定量化贡献[18],如Garden-Torresdey等[19]研究显示,藻类细胞经酯化处理后对A13+和Cu2+的结合能力下降,说明羧基在Al3+和Cu2+的吸附过程中有重要作用;Ashkenazy等[20]的研究表明,乙酰化预处理后提高了菌体对金属的吸附量. 近年来大量研究表明,部分活体微生物(如酵母菌)以在胞内外矿化结晶的形式将铀等锕系元素富集固定[21-24],且模拟核素Yb[25]和Ce[26]同样在微生物界膜处出现矿物晶体. 微生物如何高效原位地修复放射性污染场地,一直是国内外学者长期关注的热点课题[27-28]. 刘明学[29]利用有机酸解吸和湿法消解的方式有效定量区分了活体微生物对核素的表面吸附、沉积矿化或胞内富集比例,然而关于灭活和活体微生物对高中放废液中主要锕系核素239Pu的富集行为、赋存形式、减量化程度的研究鲜见报道[7-9]. 微生物在自然界中大量存在且广泛分布,研究[30-34]表明,绝大部分微生物对放射性核素及重金属的固定具有潜在有效性. 该研究选用模式微生物酵母菌作为代表菌种,通过化学预处理和湿法消解的方式,系统研究微生物对放射性核素239Pu的富集及减量化行为,以期为高放废物地质处置库的核素迁移评价及微生物对锕系核素分离研究提供基础数据和参考依据.
1 材料与方法
1.1 主要试剂与仪器
主要试剂:239Pu标准溶液(107Bq/L)以及真实中放废液由中核集团某公司提供,1 mg239Pu的放射性活度为2.27×106Bq;Hisafe3闪烁液购自美国PE公司;试验所用其他试剂均为分析纯或优级纯,配置溶液均采用Milli-Q制备;所有放射性试验均在中核集团某公司放射性分析室开展.
主要仪器:Wallac 1414液闪仪(美国PE公司);ORTEC α能谱仪〔50 mm2PIPS (passivated implanted Planar silicon, 离子注入型半导体硅)探头,美国ORTEC公司〕;BH1324F低本底多道γ能谱仪(中核北京核仪器厂);雷磁PHS-3C型精密pH计(上海精密科学仪器有限公司);800型离心沉淀器(上海手术器械十厂);BS210S电子天平(德国赛多利斯股份公司);JJ-4A六联磁力搅拌器(常州荣华仪器制造有限公司);DZ-1A真空干燥箱(天津市泰斯特仪器有限公司);KSL-1200X马弗炉(合肥科晶材料技术有限公司);UItra55场发射扫描电子显微镜(SEM-EDS,德国蔡司公司);IE450型能谱仪(英国Oxford公司);Nicolet-5700型傅里叶变换红外光谱仪(美国热电公司).
1.2 试验方法
1.2.1 试验菌体制备方法
模式微生物−酵母菌初始菌株由西南科技大学生命科学与工程学院试验中心提供. 液体培养基为葡萄糖50.0 g、尿素1.0 g、(NH4)2SO41.0 g、酵母膏0.5 g、Na2HPO40.5 g、水1 500 mL、pH=4.5. 用电炉加热并用玻璃棒不断搅拌配置成1 500 mL溶液. 将活化后的菌种接种到液体培养基中,37 ℃振荡培养至对数生长期,离心收集活体菌体备用,将部分湿菌体置于高压灭菌锅121 ℃灭菌15 min,然后置于干燥箱中于100 ℃烘至恒干,收集灭活菌体备用.
1.2.2 菌体化学预处理方法
根据文献[18]的试验方法,准确称取2.0 g酵母菌湿菌体,分别进行脱蛋白、脱脂和脱乙酰化3种化学预处理:①脱蛋白. 准确加入20 mL 2 mol/L NaOH溶液,室温脱蛋白处理24 h后,离心固液分离,用超纯水反复清洗,备用. ②脱脂. 准确加入20 mL摩尔比为1∶3的乙醇-氯仿混合溶液,室温脱脂处理24 h后,离心固液分离,用超纯水反复清洗,备用. ③脱乙酰化. 准确加入20 mL 40% NaOH溶液,在115 ℃油浴约4 h后,冷却,离心固液分离,用超纯水反复清洗,备用.
1.2.3239Pu吸附试验及活度分析
在必要条件下,利用0.1 mol/L HNO3和0.1 mol/L NaOH将一定放射性活度浓度的239Pu溶液pH调至所需值(该文仅在对图1的研究中调pH,图2~4的试验pH条件均为标准试剂的原始pH,未经调料,在高pH条件下239Pu的形态和种态将发生较大变化,形成沉淀或胶体,因放射性分析条件有限,难以清晰鉴定和解析其沉淀物相及胶体结构信息),通过Fe2+和NO2−调节239Pu至+3价和+4价,取一定体积的239Pu溶液于25 mL锥形瓶中,加入一定量的酵母菌,置于六联磁力搅拌器上,在恒温、150 r/min下搅拌吸附一定时间后,4 000 r/min离心20 min,取一定体积(0.1~3 mL)的待测溶液加入到20 mL聚乙烯闪烁瓶中,然后加入10 mL Hisafe 3闪烁液,摇匀后用液闪仪测放射性计数,计算239Pu的放射性活度浓度以及相应的吸附率和吸附量. 上述过程即为批次试验. 菌液分离后,为考察菌体对239Pu溶液的梯次递降效果,再次向液体中投加新菌体称为梯次吸附(换菌不换液);为考察菌体的吸附量,再次将吸附过的菌体投加至未经吸附的239Pu溶液中称为累积吸附(换液不换菌).
放射性活度浓度的吸附率(R,%)和吸附量(Q,Bq/g)的计算公式分别如式(1)(2)所示.
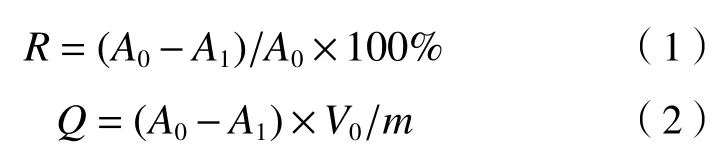
式中:R为放射性活度浓度的吸附率,%;A0为溶液初始放射性活度浓度,Bq/L;A1为溶液残余放射性活度浓度,Bq/L;Q为放射性活度浓度的吸附量,Bq/g;V0为反应溶液的初始体积,L;m为酵母菌的投加量,g.
1.2.4 中放废液吸附试验及活度分析
准确移取5 mL中放废液于25 mL的锥形瓶,加入0.1 g灭活酵母菌,在六联磁力搅拌器上搅拌30 min,测溶液pH(强碱性是因为前期处理工艺添加大量碱所致,中高放废液的组分极其复杂,若调节料液将引入更多离子,该文旨在初步探索最简化的方式下酵母菌对废液中锕系核素的分离潜力,因此未与标准试剂的pH统一),样品在4 000 r/min下离心20 min实现固液分离,取0.1 mL清液稀释1 000倍,用0.1 mol/L HNO3定容至100 mL后,移取1 mL用于放射性活度浓度〔总α(∑α)、总β(∑β)〕的分析,移取0.2 mL利用ORTEC 8-units system α-spc α能谱仪测α谱(50 mm2PIPS探头),移取1 mL用γ谱仪测总γ. 其中,γ探测效率为0.59%,本底计数为152,测量时间为1 800 s.
采用Wallac 1414液闪仪(具有α/β甄别功能)测定总α、总β. 放射性活度浓度(A,Bq/L)的计算如式(3)所示,总α和总β放射性活度浓度〔A(∑α)、A(∑β),Bq/L〕的计算公式分别如(4)(5)所示.

式中:cpm为每分钟计数值;cpmw1为总α的每分钟计数值;cpmw2为总β的每分钟计数值;Bc为本底值,其中Bcα=0.8,Bcβ=60;t为计数时间,s;e为探测效率,其中eα=100%,eβ=65%;V1为分析取样体积,mL.
样品中总α放射性活度的分析过程:准确移取0.1 mL上清液于5 mL萃取管中,用0.3 mol/L硝酸定容至1 mL,加入1 mL 30% TRPO-二甲苯,充分振荡萃取5 min,离心分相. 分相后的有机相用0.4 mol/L硝酸洗涤5 min. 准确移取0.1 mL洗涤后的有机相,用液闪谱仪测量总α放射性活度.
1.2.5 湿法消解
每组设计3份平行对照,试验方法根据文献[21]进行部分改进.
络合交换:酵母菌与239Pu溶液分离后,其中一份用10 mmol/L EDTA清洗交换5次直至乙二胺四乙酸(EDTA)洗脱液中检测不到239Pu,每次清洗,用移液器取2 mL EDTA溶液于5 mL离心管中,轻摇几次,平放静置10 min,然后离心将洗脱液转移到10 mL试管中,菌体则保留在原离心管中,如此反复,直至洗脱完毕;另一份在同样条件下用超纯水清洗作为对照. 清洗方法如上所述,同样将交换液储存在10 mL的试管中,菌体则保留在原离心管中.
湿法消解:用EDTA和超纯水洗涤后原离心管中的菌体,以及未经清洗的菌体,3份均采用1∶4的高氯酸(HClO4)与硝酸(HNO3)混合溶液5 mL浸泡48 h,进行湿法消解,此过程中轻摇几次以期与混酸充分接触使消解更加完全. 消解后,离心将消解液转移到10 mL的试管中,将上述10 mL的试管都用超纯水定容到10 mL,测定239Pu放射性活度. 其中EDTA洗脱下来的239Pu是酵母菌胞外络合的部分,经EDTA洗涤后湿法消解出来的239Pu为在酵母菌细胞表面矿化稳定结合或进入胞内的部分. 数据处理按式(6)(7)进行:
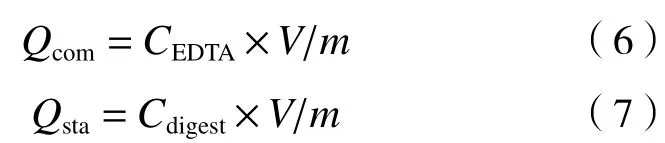
式中:Qcom为单位干质量酵母菌中胞外黏附及络合的239Pu,Bq/g;CEDTA为EDTA洗脱液中239Pu的放射性活度浓度,Bq/L;Cdigest为混酸消解液中239Pu的放射性活度浓度,Bq/L;Qsta为单位干质量酵母菌稳定结合或在胞内积累的239Pu,Bq/g;V为EDTA洗脱或混酸消解后溶液体积,L.
1.2.6 零电荷点(pHPZC)滴定方法
将不同质量的固体加入到一定量的超纯水中,得到一组不同固液比的悬浮液. 随着固液比的增大,悬浮液体系的pH越来越接近pHPZC. 分别将0.01、0.05、0.15、0.25、0.50、1.00、1.10、1.25 g灭活酵母菌加入到20 mL超纯水中,在常温(25 ℃)、150 r/min下振荡30 h,测量各溶液的pH.
1.2.7 反应前后SEM-EDS和FT-IR分析
酵母菌与239Pu及模拟溶液作用后,4 000 r/min下离心20 min,弃上清液,沉淀物45 ℃烘干备用,利用SEM-EDS和FTIR分别进行形貌和表面基团分析.SEM的放大倍数约为20 000倍. FTIR的波数范围为4 00~4 000 cm−1.
2 结果与讨论
2.1 酵母菌对239Pu的富集和减量化效果
采用EQ3/6地球化学模式和模拟计算发现,pH对239Pu的离子价态和种态有重要影响[2]. 由图1可见,pH对灭活酵母菌吸附239Pu的行为有显著影响,在最适pH=5的条件下,酵母菌对239Pu的吸附率和吸附量分别为97.32%和0.2×106Bq/g(以干质量计,下同).在pH小于5时,Pu以+3价为主,主要是Pu3+[2],该研究通过质量滴定结果发现,酵母菌的pHPZC为4.54.当pH

表1 酵母菌对水体中239Pu的去除效果及灰化减重比Table 1 Removal effect of 239Pu in water and weight loss ratio of ash treatment of S. cerevisiae

图1 pH对灭活酵母菌吸附239Pu的影响Fig.1 Effect of pH on 239Pu biosorption by inactivated S. cerevisiae
2.2 化学预处理方式对酵母菌吸附239Pu的影响
为了进一步考察酵母菌表面活性吸附位点在吸附239Pu过程中的作用,对酵母菌分别进行了3种化学预处理,经过预处理后菌体活性有一定下降. 由图2可以看出,经过脱蛋白质、脱脂和脱乙酰化处理后,酵母菌对239Pu的吸附率有所影响,脱脂处理后,吸附率略有降低,而脱蛋白质和脱乙酰化处理后,经过0.5~24 h的吸附,酵母菌对239Pu吸附率均低于对照的1/2,尤其是脱乙酰化处理后,吸附率仅为对照的1/4. 这与文献[18]的结果一致,脱乙酰化处理后,啤酒酵母菌及少根霉菌吸附241Am的性能也显著降低. Ashkenazy等[20]研究表明,乙酰化修饰胺基后使NH3+转变成中性基团CH3CO−NHR,从而与带正电的金属离子进行配位结合,提高了其对金属的吸附量. 这表明乙酰基团在重金属和239Pu等锕系核素的吸附过程中均起到了重要作用,其次是多官能团的蛋白质.
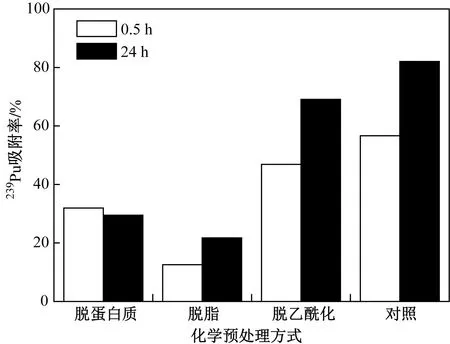
图2 化学预处理方式对活体酵母菌吸附239Pu的影响Fig.2 Effect of chemical pretreatment on 239Pu biosorption by living S. cerevisiae
2.3 239Pu在酵母菌体内的赋存方式
经过EDTA和混酸消解后,不同时间下活体酵母菌对胞外络合与胞内外稳定结合的239Pu的积累量如图3所示. 由图3可见,随着时间的延长,239Pu酵母菌体内的积累量逐步增加,96 h时,酵母菌对239Pu的吸附量达1.56×106Bq/g. 0.5~24 h内,随着时间的增加,以胞外络合和胞内外稳定结合两种方式的吸附量均在增加,单位质量酵母菌细胞壁络合239Pu的量在24 h达到最大,为1.21×106Bq/g,占总吸附量的80.13%. 96 h时,单位质量酵母菌细胞壁络合的239Pu降至1.18×106Bq/g,占总吸附量的75.64%;酵母菌细胞壁吸附络合239Pu的量随时间呈先增后减的趋势,这与细胞壁吸附机理及菌体生长代谢规律有关. 利用混酸消解后的239Pu总量一直在增加,表明部分以细胞壁络合的239Pu在该阶段进入到胞内或者矿化为更稳定的形式存在. 基于强酸性、化学毒性和强放射性的条件,推测24 h后活体酵母菌细胞壁膜逐渐破损直至活性消亡,因此在该阶段进入胞内的比例进一步增加. 由于239Pu与酵母菌细胞作用时首先接触的是细胞壁,在物理-化学吸附机理作用下,细胞壁在短时间(0.5 h)即可吸附大量的239Pu (约0.8 Bq/g). 酵母菌细胞在小剂量辐照及毒害胁迫下具有较高的代谢活性,可能会利用Ca、Mg或Fe转运蛋白等离子转运通道使吸附在细胞壁上的239Pu向胞内转运一部分,转运量的多少与细胞种类、生长代谢和膜受损状态等有关;同时,酵母菌细胞会产生一定的抗性,使细胞壁解吸部分239Pu或通过表面沉积晶化的方式将239Pu转化为更为稳定的矿物形式,表现为稳定吸附的239Pu随着时间的延长逐步增加. 随着时间延长,细胞逐步可能产生适应,以及后期细胞衰退时细胞表面暴露出更多的吸附活性基团,导致酵母菌细胞壁表面吸附的239Pu总量缓慢增加直至趋于平衡,这与刘明学[29]报道的锶离子生物吸附规律相似. 从积累的时间来看,与细胞壁上的络合吸附相比,沉积或进入胞内是一个相对缓慢的过程,这符合酵母菌细胞的代谢动力学和吸附积累推测过程,即239Pu与酵母菌细胞接触后,首先通过物理化学吸附在细胞表面,然后再通过代谢依赖或非依赖机制向细胞内转运或在胞内外成核结晶生长.

图3 不同时间下活体酵母菌对239Pu的积累量Fig.3 Accumulation of 239Pu by living S. cerevisiae at different time
2.4 酵母菌对239Pu(Ⅲ)和239Pu(Ⅳ)溶液放射性活度的批次及累积吸附
酵母菌在换菌不换液的情况下,对239Pu(Ⅲ)和239Pu(Ⅳ)溶液的梯次吸附试验结果如图4所示. 由图4可见,在经过连续6次吸附后,239Pu(Ⅲ)和239Pu(Ⅳ)溶液的放射性活度浓度从106Bq/L逐渐降至103~104Bq/L,239Pu的吸附率均在99%以上. 灭活酵母菌对239Pu溶液的吸附性能在前期(前2次累积吸附总量)略优于活体,在前面3次吸附中,酵母菌对239Pu(Ⅲ)的吸附率远高于239Pu(Ⅳ),考虑到溶液初始pH的差异导致Pu在溶液中的种态不同.239Pu(Ⅳ)溶液的初始pH较低,游离H+较多,这对239Pu的吸附将造成较大的影响. 在换液不换菌的条件下,经过3次累积吸附,灭活酵母菌对239Pu(Ⅲ)和239Pu(Ⅳ)的累积吸附量分别可达0.76×106和0.43×106Bq/g.

图4 酵母菌对239Pu(Ⅲ)和239Pu(Ⅳ)溶液放射性活度的梯次递降结果Fig.4 The radioactivity result of 239Pu(Ⅲ) and 239Pu(Ⅳ) batch adsorption by S. cerevisiae
2.5 酵母菌与真实Pu及模拟Ce溶液作用前后的FTIR及SEM-EDS分析
酵母菌与Pu溶液作用24 h的红外光谱如图5所示. 酵母菌细胞壁主要组分是葡萄糖和甘露聚糖,并含有几丁质和蛋白质. 由图5可见,3 411 cm−1附近强宽谱峰为O−H伸展振动和N−H伸展振动的混合峰,来自多糖、几丁质和蛋白质等组分的贡献.2 959和2 926 cm−1附近的谱峰分别来自蛋白质和脂类的νas(CH2)和νas(CH3),是典型的脂碳链的C−H伸展振动吸收带,它反映脂肪酸、各种膜和细胞壁组分的亲水脂分子的信息. 1 634 cm−1处为蛋白质酰胺Ⅰ带,来自C=O伸展振动. 1 546 cm−1处为酰胺Ⅱ带,来自N−H弯曲振动和C−N伸展振动,这两处峰是蛋白质的特征谱带.
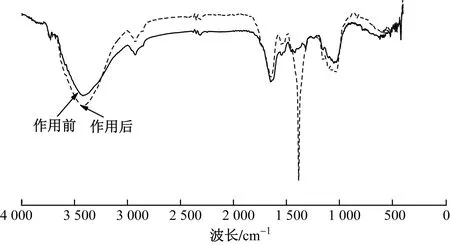
图5 酵母菌与239Pu溶液作用前后的FTIR谱图Fig.5 FTIR spectra of S. cerevisiae before and after interaction with 239Pu solution
1 453和1 405 cm−1附近的吸收带分别属于蛋白质分子中甲基的反对称弯曲振动峰〔δas(CH3)〕和对称弯曲振动峰〔δs(CH3)〕. 1 385 cm−1处中等强度的吸收归属于羧基的对称伸缩振动,1 238 cm−1处的谱峰为酰胺Ⅲ带C−N伸展振动和N−H弯曲振动的混合振动峰,可能还有P=O伸缩振动. 1 047 cm−1处为多糖骨架振动吸收带,主要是糖类的C−OH伸缩振动,可能也含P−O−C伸缩振动[13]. 酵母菌与Pu作用后,3 419 cm−1附近的O−H和N−H伸缩振动峰谱带变宽,酰胺带和多糖羟基谱峰变化较大,尤其明显的是,1 384 cm−1处羧基的C−O和C=O特征吸收峰显著加强. 这表明酵母菌与Pu作用时,羧基、羟基和氨基等活性基团的氢键被破坏,由C、N、O提供配位电子,与有空轨道的Pu(Ⅳ)或Pu(Ⅲ)以−CO−Pu−、−O−Pu−、−N−Pu−等螯合、络合或配位的方式结合. 由此推断,酵母菌在吸附Pu的过程中的确存在化学吸附过程,相对而言,细胞上的多糖、蛋白质酰胺成分更多地参与了对Pu的吸附过程.
稀土元素Ce的离子半径、价态及化学性质与Pu等超铀元素相似,且酵母菌对Ce的吸附矿化试验研究[26]发现,酵母菌对Ce的吸附行为与239Pu非常相似,因此用Ce4+替代239Pu进行有关扫描电镜和能谱分析是可行的. 酵母菌在25 mg/L的Ce溶液中作用72 h后的SEM-EDS结果如图6所示. 在pH=1和pH=3的条件下未发现明显的沉积物,在pH=5的条件下,在酵母菌表面发现有粒径约100 nm的针状沉积物,EDS证实这些沉积物含有Ce,同时含有较明显的P和Fe的峰. 推测在pH=5时,Ce在酵母细胞表面与从胞内释放出P结合,生成Ce的磷酸盐纳米结晶.
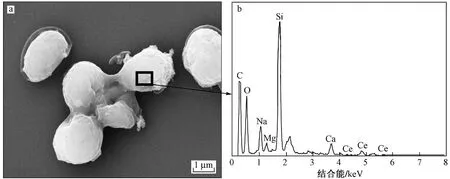
图6 酵母菌与Ce溶液作用后的SEM-EDS结果Fig.6 SEM and EDS results of S. cerevisiae after interaction with Ce solution
2.6 酵母菌对真实中放废液锕系核素的梯次递降
取100 mL真实中放废液(由中核集团某公司提供,pH=13.4,总α放射性活度浓度为2.64×106Bq/L)于手套箱中,在未进行酸度、浓度、活度等任何调料的前提下,通过静态批次吸附试验,考察酵母菌对真实放射性废液中锕系核素的吸附提取性能,结果如表2所示. 在中放废液中,总α放射性活度主要由放射性核素239Pu和241Am提供,从α谱仪分析计数得知,吸附前后废液中239Pu和241Am的计数比例均约为10∶1.从表2可以看出,吸附后,溶液从强碱性(pH=13.4)水平逐渐降至弱碱性水平,酵母菌对真实中放废液中的总α放射性活度有较好的去除效果,两次吸附率分别可达72.50%和92.74%,吸附量分别达18 684.11和6 571.35 Bq/g,经过酵母菌2次吸附,总α放射性活度降低了2个数量级,累积吸附率可达98%,而总β和总γ放射性活度仍保持原有数量级,累积吸附率仅分别为11.45%和6.35%. 这表明利用微生物对放射性废液中锕系核素的提取和分离是可能的.

表2 酵母菌对真实中放废液的吸附试验结果Table 2 Biosorption results of the real middle level radioactive liquid by S. cerevisiae
3 结论
a) pH=5时,0.1 g灭活酵母菌对20 mL放射性活度浓度为1.24×106Bq/L的239Pu的去除可达97.32%,蛋白质和乙酰基团对酵母菌吸附239Pu起到重要作用.
b) 活体酵母菌对239Pu的吸附是一个生物、物理、化学作用相结合的过程. 随着吸附时间从0.5 h延至96 h,酵母菌积累的239Pu总量逐渐增加,24~96 h期间,络合在细胞表面的239Pu略有降低,而以稳定形式赋存在酵母菌细胞内外的239Pu在增加.
c) 通过Fe2+和NO2−调节239Pu至+3价和+4价,经过6批次酵母菌吸附(换菌不换液),239Pu(Ⅲ)放射性活度浓度可从7.35×106Bq/L梯次递降至2.30×103Bq/L,吸附后的酵母菌经灰化处理后,可减量98.21%.
d) 经过酵母菌2次吸附,总α放射性活度浓度降低了2个数量级,累积吸附率可达98%,而总β和总γ放射性活度浓度仍保持原有数量级,累积吸附率仅分别为11.45%和6.35%. 因此,利用微生物对放射性废液中锕系核素的提取和分离是可能的.

