高寒草地耐低温植物根际促生菌的筛选鉴定及特性研究
刘晓婷,姚拓
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃兰州 730070)
红原县位于我国青藏高原的东部边缘,近年来由于人类活动和气候变化的不断影响,退化草地的面积不断增加[1]。退化后植被生产力、生物多样性和土壤因子相互作用,使生态环境持续恶化,严重制约了农牧业和环境的可持续发展[2]。近年来许多科研工作者对高寒退化草地的改良和修复进行了大量研究,从农牧业可持续发展及生态环境保护等多方面综合考虑,微生物肥料在高寒草地生态修复中具有良好的应用潜力[3]。而植物根际促生菌(plant growth promoting rhizobacteria,PGPR)是微生物肥料的主要功能成分,能够固氮,溶磷,分泌吲哚-3-乙酸(indoleacetic-3-acid,IAA)、赤霉素(gibberellin,GA3)、玉米素(trans-zeatin,t-Z)等直接促进植物生长[4-5]。此外,PGPR 等生防菌定殖在植物根际,在抑制或减少植物病原菌的同时促进植物生长并增加作物产量[6]。PGPR 还可以诱导植物抗逆性,从而减少病害对植物生长发育的不利影响[7]。因此,植物根际促生菌资源的筛选成为人们研究的热点。
PGPR 作为一种天然的根际细菌[8],其来源广泛。研究发现PGPR 的生长受到土壤环境变化的影响,不同生境中的菌株其促生效果和菌株的适应性存在差异[9]。Mishra 等[10]从喜马拉雅山西北部高海拔地区植物根际分离出一株能在4 ℃下生长良好的耐低温假单胞菌,其通过溶磷、调节植物激素分泌促进小麦(Triticum aestivum)幼苗生长。除此之外,PGPR 在生态环境修复方面也表现出巨大的潜力,接种PGPR 可以增强植物对盐碱、干旱等胁迫的耐受性,例如,在盐胁迫下接种耐盐促生菌通过改善叶面养分吸收和增强抗氧化机制使植物盐毒性降低,提高作物产量[11]。Xu 等[12]发现在干旱条件下接种耐旱PGPR 可以增强苹果(Malus pumila)幼苗叶片抗氧化酶活性,减少细胞膜过氧化损伤,提高植株的抗旱性能。目前已开展了大量的关于农田、草地等的促生菌资源筛选研究,但天然草地,尤其是青藏高原东部边缘的川西北高寒草地,植被群落物种组成丰富,其耐低温促生菌资源的筛选及将其应用于退化草地修复的研究鲜有报道。因此,挖掘适应高寒地区的耐低温PGPR 用于开发新型微生物肥料以修复退化高寒草地已成为一项具有重要意义的工作。
本研究以生长在高寒、高海拔地区的毛稃羊茅(Festuca kirilowii)、洽草(Koeleria cristata)、紫穗鹅观草(Roegneria purpurascens)3 种优良植物为研究对象,从植物根际分离筛选固氮、溶磷、分泌植物激素的菌株,并对其进行促生特性研究及分类鉴定,旨在筛选获得兼有固氮、溶磷、分泌植物激素多种功能的耐低温优良PGPR,以期为退化高寒草地生态系统的生态恢复和微生物肥料的研制应用提供理论依据和菌种资源。
1 材料与方法
1.1 植物样品采集
2020 年7 月,在四川省阿坝藏族羌族自治州红原县邛溪镇(32°53′15″N,102°35′59″E,海拔3480 m),选择生长旺盛且无病害的毛稃羊茅、洽草、紫穗鹅观草植株,用铁锹沿着植物根部的生长方向取出植株,将植物根际尽量采集完整,装入无菌自封袋中注明植物名称和采集日期,于4 ℃冰盒保存,带回实验室尽快进行微生物分离和筛选。
1.2 培养基
无 氮 培 养 基(nitrogen free medium,NFM)[13]:CaCl2·2H2O 0.02 g,MgSO4·7H2O 0.2 g,K2HPO40.5 g,NaMoO4·2H2O 0.002 g,NaCl 0.1 g,KOH 4.5 g,苹果酸5.0 g,生物素10 μg,0.5%溴百里酚蓝5 mL,琼脂20.0 g(半固体培养基2.0 g),蒸馏水1000 mL,pH 7.0。无机磷 培养基(national botanical research institute’s phosphate,NBRIP)[14]:葡 萄 糖10.0 g,Ca3(PO4)25.0 g,MgCl2·6H2O 5.0 g,MgSO4·7H2O 0.25 g,KCl 0.2 g,(NH4)2SO40.1 g,琼脂20.0 g(液体培养基不加),蒸馏水1000 mL,pH 6.8~7.0。有机磷培养基[15]:以相同质量的植酸钙替代NBRIP 培养基中的磷酸钙制成。LB 培养基(Luria-Bertani,LB)[13]:胰蛋白胨10.0 g,酵母粉5.0 g,NaCl 5.0 g,琼脂20.0 g(液体培养基不加),蒸馏水1000 mL,pH 7.0。King 氏培养基[13]:胰蛋白胨20.0 g,K2HPO41.15 g,MgSO4·7H2O 1.5 g,丙三醇15 mL。
1.3 植物根际促生菌的分离纯化
为了解PGPR 在植物根际的分布情况,本研究将植物根际划分为3 个部分,即根表土壤(soil adhering to roots,RS)、根系表面(rhizoplan or surface of roots,RP)、根内(histoplan or interior of roots,HP)[16]。具体方法如下:在超净工作台中将植物根系上大部分土壤和根系表面的虚土抖落后,称取1.0 g 根系放入9 mL 0.85%生理盐水(已灭菌)中,200 r·min-1振荡10 min 后静置,上清液即为10-1根表土壤稀释液;振荡后的根系放入9 mL 0.85%生理盐水(已灭菌)中,并加入2~3 粒无菌玻璃珠,1000 r·min-1离心2 min 后静置,上清液即为10-1根系表面稀释液;取出上述根系并用石蜡将两端密封,先用2%的次氯酸钠表面消毒30 s 后用无菌水冲洗干净,再用75%酒精灭菌1 min 后无菌水冲洗3~5 次,剪去两端石蜡,用无菌滤纸吸干表面水分,在已灭菌的研钵中研磨,用9 mL 0.85%生理盐水(已灭菌)冲洗,1000 r·min-1离心5 min 后静置,上清液即为10-1根内组织稀释液。再按稀释梯度法依次制备10-2、10-3、10-4、10-5梯度的根表土壤、根系表面和根内组织稀释液备用[17]。
采用平板涂布法[17]将制备好的植物根际3 个区域的10-3、10-5稀释液各50 μL 分别接种在NFM、NBRIP 无机磷和植酸钙有机磷固体培养基上,每个浓度梯度重复涂布3 次,15 ℃培养箱培养5~7 d,挑取NFM 培养基中生长较快、形态各异的单菌落进行多次重复划线至无杂菌长出,即为固氮菌株。用接种环挑取NBRIP 无机磷和植酸钙有机磷培养基中菌落周围出现溶磷圈的不同大小单菌落,并进行多次重复划线直至菌株纯化,即为溶磷菌株。将分离纯化好的固氮菌和溶磷菌接种在LB 斜面培养基上,于4 ℃冰箱保存备用。
1.4 菌株促生特性测定
1.4.1固氮特性 采用乙炔还原法[18]测定菌株固氮酶活性。用接种环将1.3 中已分离出的固氮菌挑取一环接种于10 mL 半固体培养基中(血清瓶,规格30 mL),每个处理重复3 次,以不接菌培养基为对照处理,用棉球塞封口,15 ℃培养箱培养2 d。在超净工作台中将棉球塞换成橡胶塞,用无菌注射器抽出1 mL 气体,然后注入1 mL C2H2气体并用蜡质封口膜密封,15 ℃培养箱培养2 d;2 d 后用50 μL 微量进样器从血清瓶中分别抽取50 μL 混合气体快速注入气象色谱仪(GC7890,美国)气体进样柱内,记录并观察C2H4的出峰时间及峰面积,计算菌株的固氮酶活性(nitrogenase activity,NA,nmol C2H4·h-1·mL-1)。
1.4.2溶磷特性 采用溶磷圈法定性测定,将1.3 中分离出的溶磷菌接种于NBRIP 无机磷培养基和植酸钙有机磷培养基中,每个处理重复3 次,15 ℃培养箱培养7 d,测量各菌株的溶磷圈直径(D)与菌落直径(d),根据D/d 值的大小进行初步筛选。钼蓝比色法[17]定量测定:在无菌条件下,将初筛后的菌株接种于NBRIP 无机磷和植酸钙有机磷液体培养基(已灭菌)中,每个处理重复3 次,以不接菌培养基为对照处理,15 ℃、180 r·min-1摇床中培养10 d 测定菌株溶磷量,用酸度计测定各菌株培养液的pH。准确吸取10 mL 各菌株培养液,4 ℃、10000 r·min-1离心15 min,吸取上清液1 mL 于50 mL 三角瓶中,同时每个三角瓶中加入0.5 mol·L-1NaHCO3溶液19 mL,180 r·min-1振荡30 min 后吸取5 mL 于50 mL 容量瓶中,每个容量瓶中加入0.5 mol·L-1NaHCO3溶液5 mL,加少量蒸馏水摇匀,并加5 mL 钼锑抗显色液,摇匀充分反应后定容至50 mL。30 min 后在紫外可见分光光度计(TU-1901,北京)下测定波长700 nm 的吸光度值,通过制作的磷标准曲线计算各菌株的溶磷量(phosphate solubilization capacity,PSC)。
1.4.3分泌植物激素能力 采用高效液相色谱法(high performance liquid chromatographic,HPLC)[19-20]测定27 株优良PGPR 菌株分泌植物激素的能力。将待测菌株接种于King 氏培养基(已灭菌)中,每个处理重复3 次,以不接菌培养基为对照,15 ℃、180 r·min-1摇床中培养7 d。样品经乙酸乙酯萃取,真空离心浓缩仪(RVC 2-25,北京)浓缩至近干,以2 mL 甲醇溶解,经0.45 μm 有机系滤器过滤后注入棕色样品瓶,保存于4 ℃冰箱待高效液相色谱分析。HPLC 色谱条件如下:色谱柱为Agilent ZORBAX Eclipse Plus C18 柱(4.6 mm×250 mm,5 μm),流动相A 为甲醇,流动相B 为含0.2%(体积分数)的冰乙酸水溶液,柱温为30 ℃,流速为0.8 mL·min-1,检测波长为254 nm,进样量为10 μL。
1.5 菌株分子鉴定
选择优良菌株,使用TaKaRa Lysis Buffer for Microorganism to Direct PCR,80 ℃热变性15 min 后,低速离心,裂解后的上清液作为PCR 反应的模板。选择细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行16S rRNA 序列的扩增。PCR 体系为:DNA 模板5 μL、2×Tap PCR Master Mix 25 μL、正反向引物各1 μL、ddH2O 18 μL。PCR 扩增条件为:95 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环35 次;72 ℃延伸10 min。PCR 扩增产物经1.0%琼脂糖凝胶电泳检测后送至兰州天启基因生物科技有限公司测序。将测序结果与EzBioCloud 数据库中的序列进行对比,然后利用MEGA 7.0 软件构建系统发育树,确定菌株的分类学地位。
1.6 数据分析
利用Excel 2010 软件整理数据及制图,采用SPSS 22.0 统计分析软件对数据进行One-way ANOVA 分析,并应用Duncan’s 新复极差法进行差异显著性检验。
2 结果与分析
2.1 不同植物根际菌株的分布情况
利用选择性培养基从3 种植物根际初步分离出294 株细菌,其中固氮菌株120 株,溶解无机磷菌株64株,溶解有机磷菌株110 株。从洽草根际分离出的固氮、溶磷菌数量最多,紫穗鹅观草次之,毛稃羊茅最少,分别占菌株总数量的45.9%、30.3%、23.8%。毛稃羊茅RP、RS、HP 菌株数量分别为33、29、8 株,洽草分别为62、55、18 株,紫穗鹅观草分别为63、24、2 株,总体来看,3 种植物根际菌株数量分布都呈RP>RS>HP 的趋势,表现出较强的根际效应(图1)。
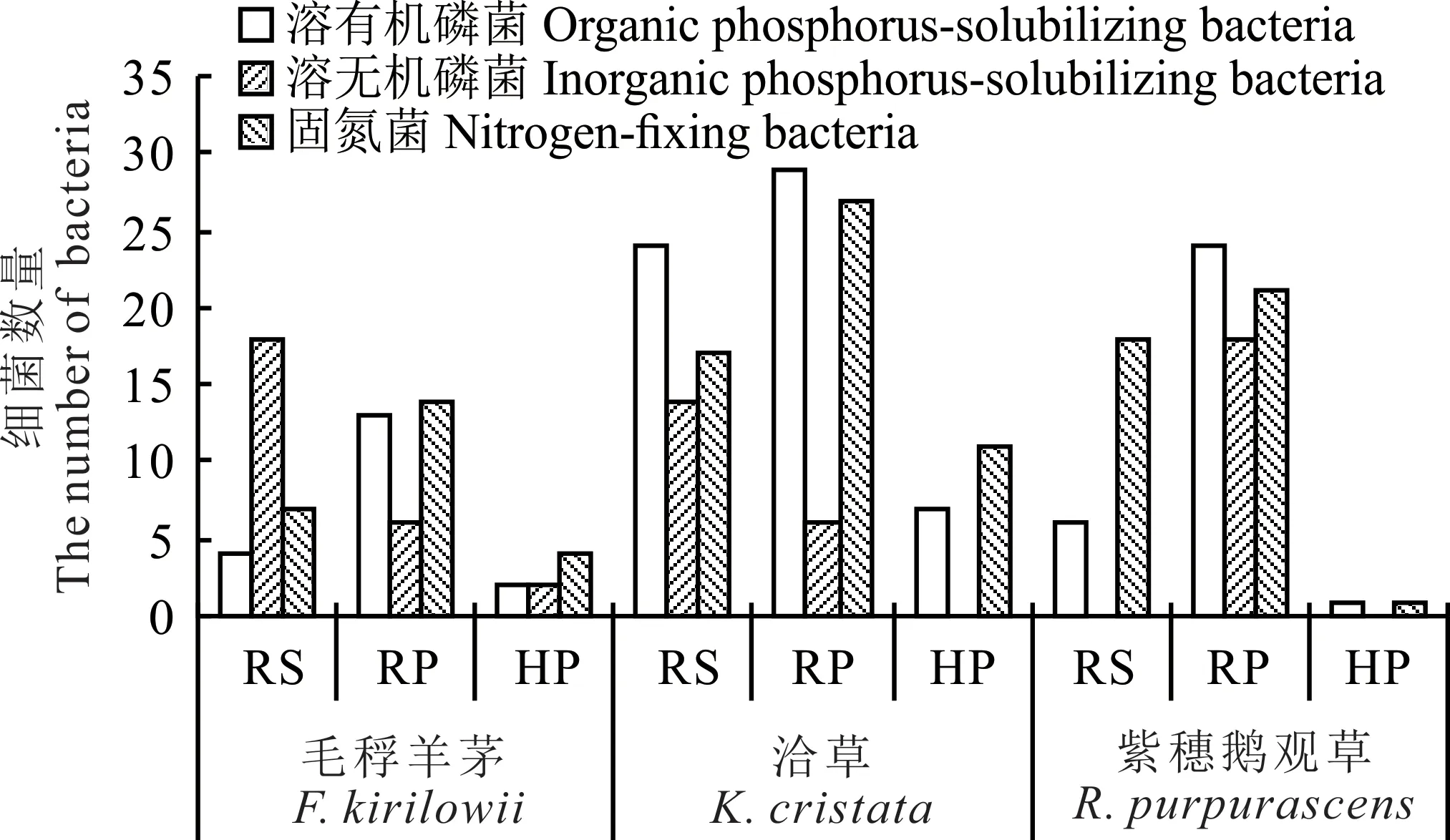
图1 细菌菌株在植物根际的分布情况Fig. 1 The distribution of bacteria strains in rhizosphere of plant
2.2 菌株固氮酶活性
利用乙炔还原法对植物根际初步分离的120 株固氮菌进行固氮酶活性测定,有30 株的固氮酶活性良好,其中14 株分离自洽草,11 株分离自紫穗鹅观草,剩余5 株分离自毛稃羊茅。各菌株固氮酶活性为124.61~311.04 nmol C2H4·h-1·mL-1,其中NCZ1 的固氮酶活性最高,分离自紫穗鹅观草根内组织,NCM3 固氮酶活性最低。固氮酶活性高于180 nmol C2H4·h-1·mL-1的有6 株,分别为NCZ1、NAQ15、NAM6、NAM7、NAZ11、NAZ19,占固氮菌总数量的20%。30 株固氮菌中,15 株产碱,4 株为中性,11 株产酸(表1)。
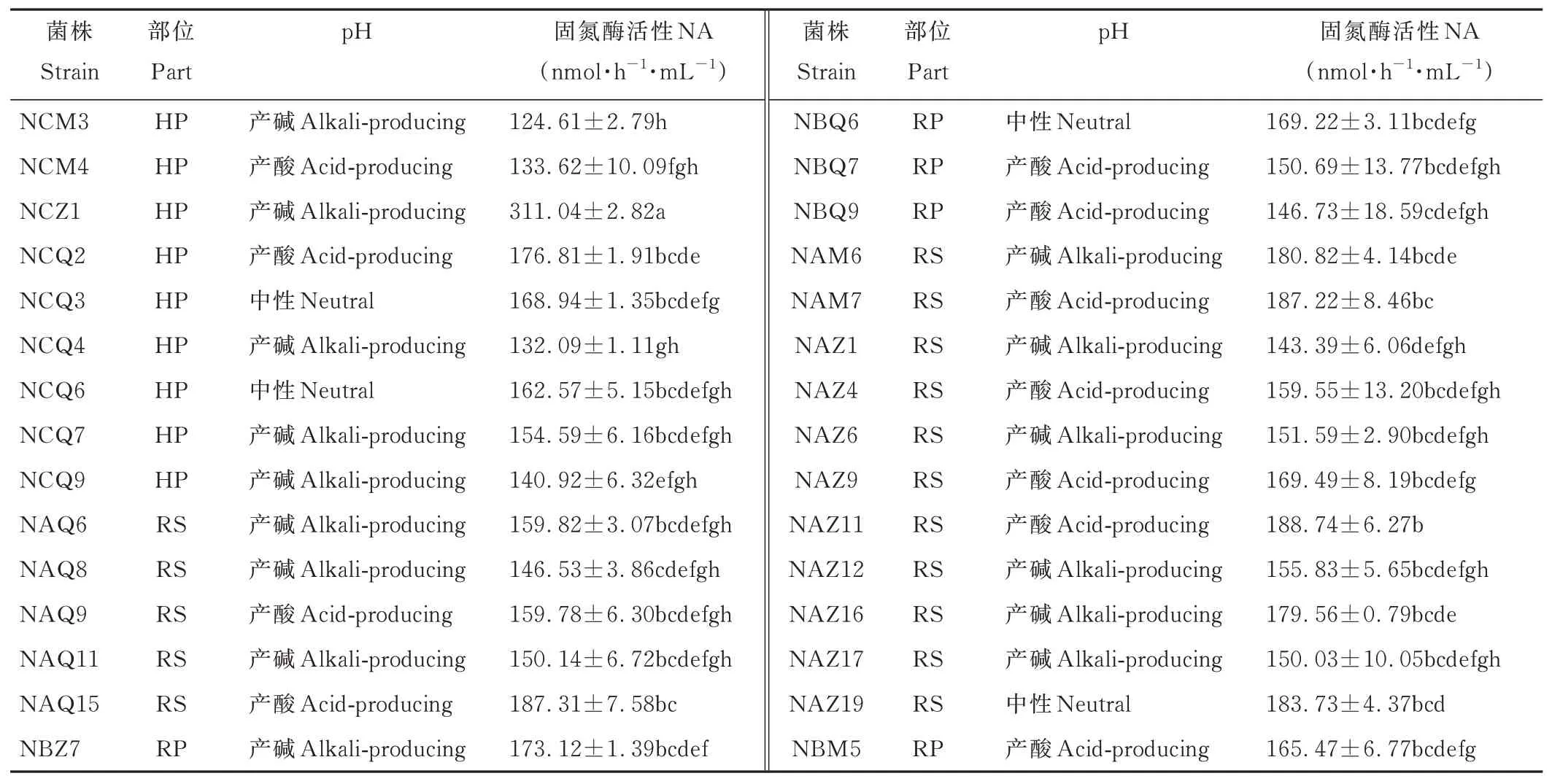
表1 固氮菌株固氮酶活性Table 1 Nitrogenase activity of nitrogen-fixing strains(mean±SE)
2.3 菌株溶磷特性
2.3.1菌株溶解无机磷能力测定 根据溶磷圈大小对菌株进行定性分析发现,64 株溶解无机磷菌株中有24株的D/d 值大于1.5,这些菌株主要分离自洽草和毛稃羊茅根际,分离自紫穗鹅观草根际的最少。溶磷菌株的无机磷溶磷量为249.85~558.07 μg·mL-1,各菌株培养液pH 为4.06~5.10,PAZ17 溶解无机磷能力最强,分离自紫穗鹅观草根表土壤,PAM11 溶磷能力最弱。此外,PAQ4、PAQ7、PAZ17 的溶磷量均高于500 μg·mL-1,具有高效的无机磷溶解能力(表2)。
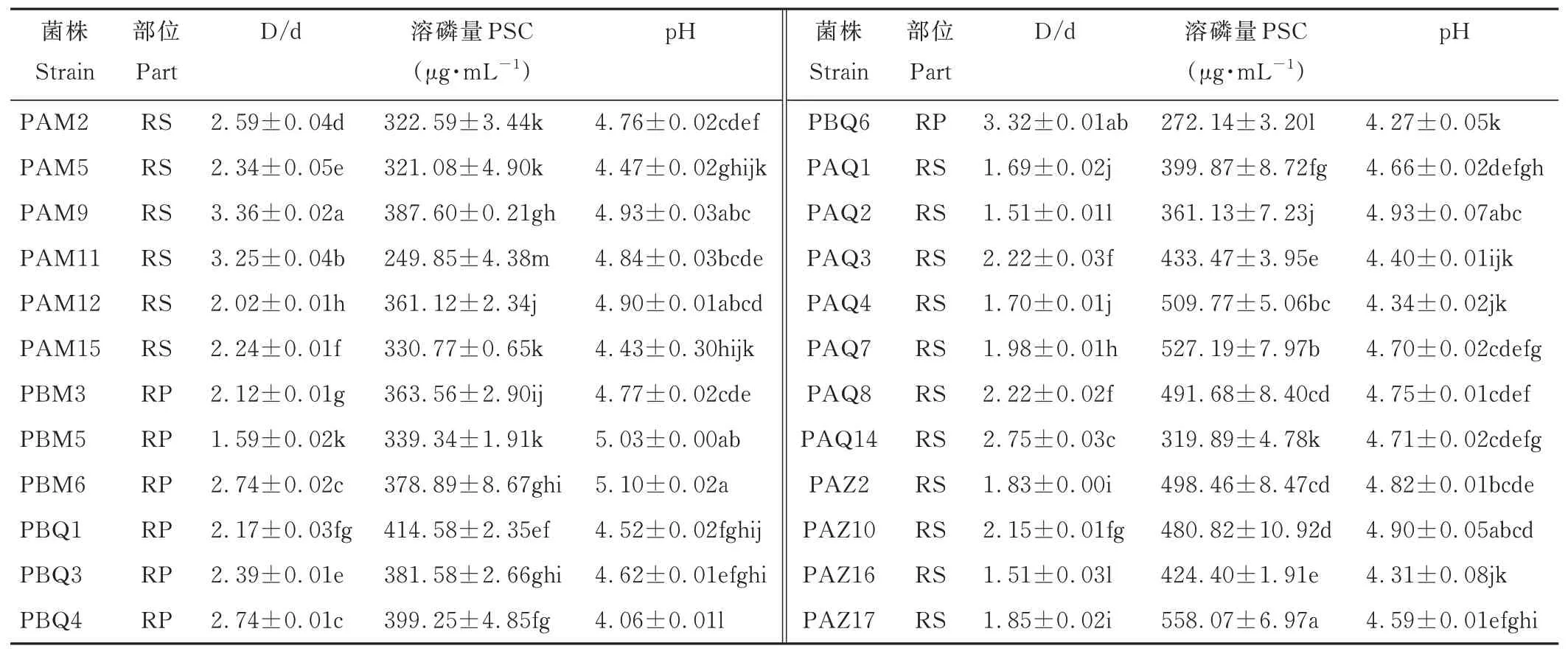
表2 溶磷菌株溶解无机磷能力Table 2 The capacity of dissolving inorganic phosphorus of phosphate-solubilizing strains
2.3.2菌株溶解有机磷能力测定 同样对初步分离的110 株溶解有机磷菌株的溶磷能力进行定性分析,110株溶解有机磷菌株中有22 株D/d 值大于1.5,其中13 株分离自洽草根际,5 株分离自紫穗鹅观草根际,4 株分离自毛稃羊茅根际。定量测定结果表明,溶解有机磷菌株溶磷量为52.25~158.77 μg·mL-1,各菌株培养液pH 为2.88~4.34,其中以MBM5 的溶磷量最大,分离自毛稃羊茅根系表面,MCZ1 的溶磷能力最弱。溶磷量高于100 μg·mL-1的有3 株,分别为MBM5、MBQ3、MAQ23(表3)。
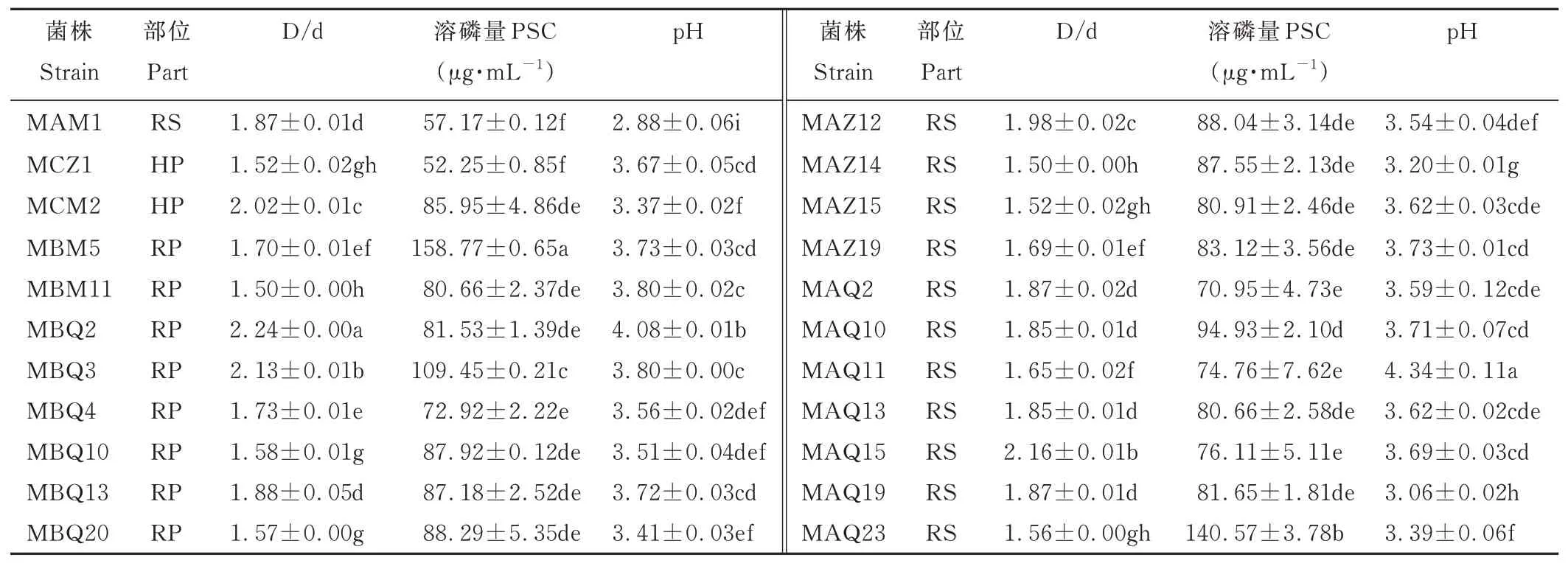
表3 溶磷菌株溶解有机磷能力Table 3 The capacity of dissolving organic phosphorus of phosphate-solubilizing strains
2.4 菌株分泌植物激素能力
对27 株优良PGPR 菌株产植物激素的能力进行测定发现,3 种植物激素含量差别较大,总体来看GA3的含量高于IAA 和t-Z。27 株PGPR 菌株均能产生植物激素,其中14 株分离自洽草根际,8 株分离自紫穗鹅观草根际,5株分离自毛稃羊茅根际,有48.15%的菌株可同时分泌3 种植物激素,有51.85%的菌株可同时分泌2 种植物激素。26 株具有分泌GA3的能力,分泌量为0.60~52.91 μg·mL-1,其中PAQ2 分泌GA3的能力最强,显著高于其他菌株,分泌IAA 的有18 株,分泌量为0.11~1.53 μg·mL-1,23 株PGPR 可分泌t-Z,分泌量为0.11~0.31 μg·mL-1(表4)。
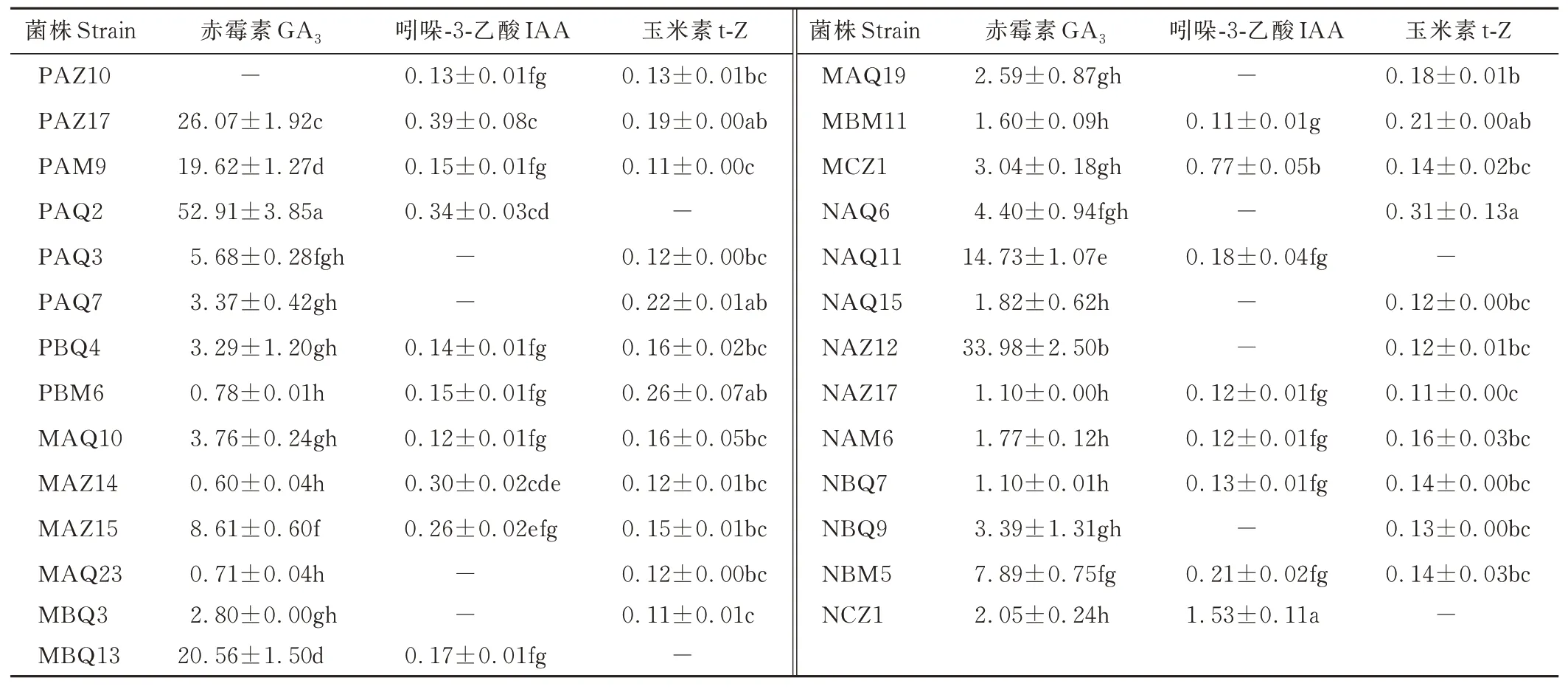
表4 PGPR 菌株分泌激素能力Table 4 The capacity of PGPR strains to secrete hormones(μg·mL-1)
2.5 优良PGPR 菌株的鉴定
通过16S rRNA 鉴定并与同源序列比对分析,对促生特性优良的14 株PGPR 菌株的分类地位进行确定,发现分 别 属 于4 个 属13 个 种,假 单 胞 菌 属 有10 个 种,PAZ10、PAZ17、NAZ17、MAZ15、NAQ6、PBQ4、MAQ23、PAQ2、MAQ19、PBM6 及MBM11 为假单胞菌属(Pseudomonas),其中MAZ15、MBM11 为同一种,NCZ1 为假节杆菌属(Pseudarthrobacter),MAQ10 为不动杆菌属(Acinetobacter),NAM6 为贪噬菌属(Variovorax)(表5)。
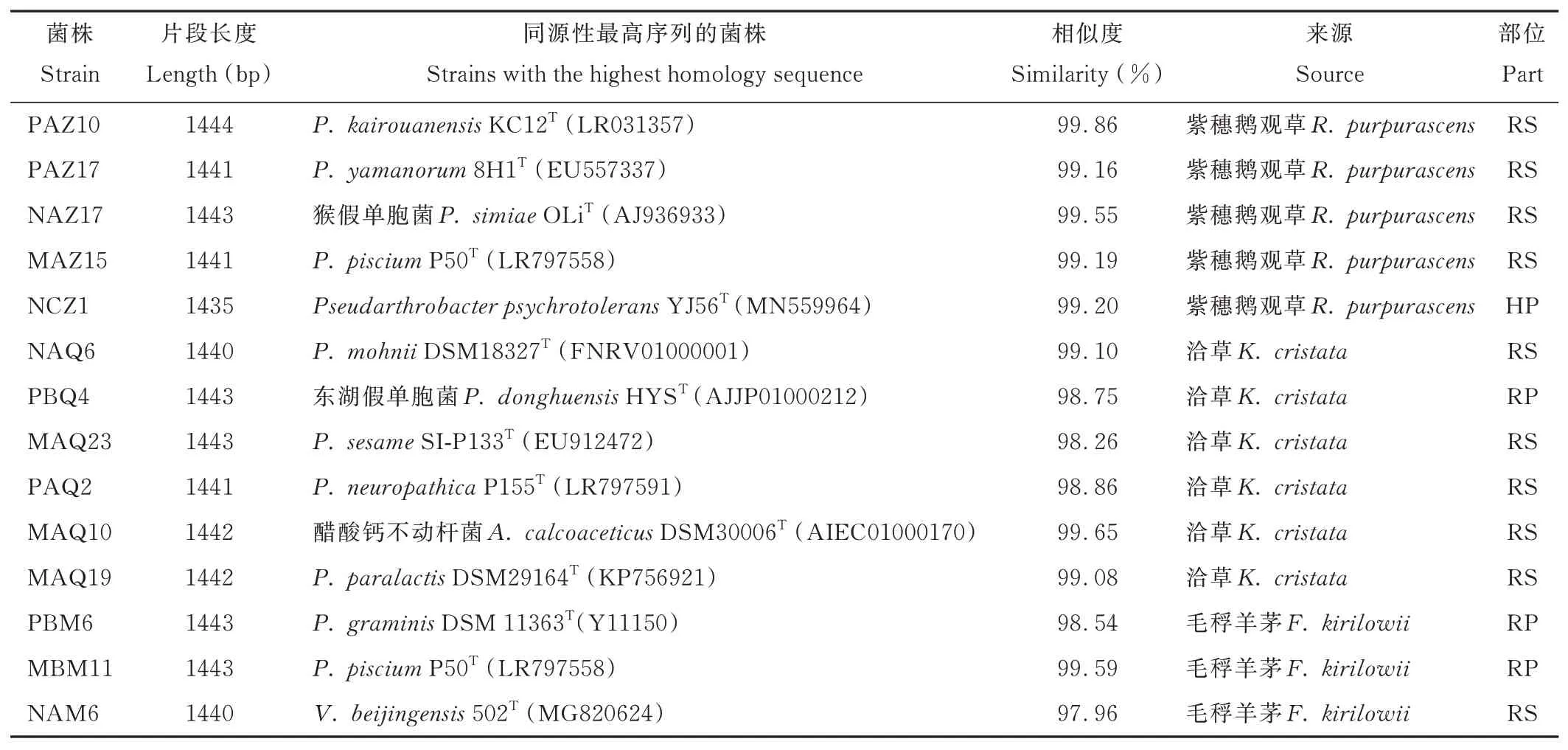
表5 优良PGPR 菌株分子生物学鉴定Table 5 Molecular biology identification of excellent PGPR strains
3 讨论
近20 年来,在微生物资源的研究工作中,作为绿色新型投入品和优先支持发展的微生物肥料被广泛应用于生产[21]。PGPR 是一类具有促进植物生长功能,或具有抑制植物病原菌作用的自由生活在土壤或附生于植物根际的有益菌群。然而PGPR 菌株因其特定的生长环境,对土壤物理性质、栽培措施、植物种类等外部因素非常敏感,因此筛选更多适应特定气候条件的优良PGPR 菌株就显得尤为重要[22]。
低温是限制川西北高寒地区植物生存的重要环境因子。低温会影响自由基的消除进而损伤植物的细胞膜系统,而接种耐低温PGPR 可以提高植株抗氧化酶活性,增强其对自由基的清除能力,从而增强植物对低温环境的耐受性[23-24]。本研究针对红原地区独特的地理环境和气候特征,以高寒草地优良植物洽草、紫穗鹅观草、毛稃羊茅为研究对象分离获得能在15 ℃条件下良好生长的促生菌,研究发现3 种植物根际分离纯化的具有固氮、溶磷能力的菌株数量不同,而且根际不同部位PGPR 菌株种类分布也存在差异,PGPR 在数量上呈现“RP>RS>HP”的根际分布趋势,其原因可能是微生物生长需要碳源,而植物根系在生长过程中组织脱落物和根系分泌物为微生物活动提供了生长和繁殖所需要的营养和能量[25],因而表现出植物根际微生物数量高于根外土壤的现象,这与姚拓[26]、马文文[27]、马骢毓等[28]在植物根际分离筛选PGPR 时取得的研究结果相一致。
根据菌株能否在固氮、溶磷培养基上生长的筛选方式初步分离了294 株细菌,并测定了这些菌株的促生特性,最终获得76 株PGPR 菌株,其中固氮菌株30 株,溶磷菌株46 株。研究发现该地区筛选的PGPR 菌株溶解无机磷能力较强,溶解有机磷能力较弱,而且PGPR 菌株溶磷圈大小与溶磷能力不完全呈正相关关系,究其原因可能是由于溶磷菌溶磷过程十分复杂,Patel 等[29]的相关研究表明微生物溶磷的主要机制是产生有机酸,但除产酸外,微生物还可以通过酶解、释放H+等溶解土壤中难溶性磷酸盐,因此,溶磷圈的大小并不能绝对地判断菌株溶磷能力的强弱。与以往研究相比,本研究筛选出的有机磷各菌株培养液pH 较低,可能的原因是筛选有机磷菌株时所选择的磷源不同,溶磷菌在溶磷培养基中能够分泌酸性、中性、碱性磷酸酶,而培养基磷源种类不同对3 种磷酸酶活性有很大的影响,以植酸钙为磷源时,碱性磷酸酶与中性磷酸酶活性很低,只有酸性磷酸酶活性稳定,因而各菌株培养液pH 较低[30]。氮是植物生存和生长的关键营养因素,尤其在高寒草地生态系统中发挥着极其重要的作用[31]。本研究经复筛只有25%的菌株固氮酶活性良好,固氮酶活性为124.61~311.04 nmol C2H4·h-1·mL-1,除个别外整体上高于高亚敏等[9]在天祝高寒草甸植物根际所筛选的固氮菌的固氮酶活性,其可能是分离固氮菌的植物种类不同及两地所处的环境差异所造成的。研究表明固氮酶由铁蛋白和钼铁蛋白组成,它受温度、氧气浓度和pH 等多种因素的影响[32-33],因而固氮酶活性差异很大。除固氮、溶磷等促生特性外,PGPR 的另一个直接促进植物生长的功能为分泌植物激素,本研究发现测定的27 株PGPR 均能产生植物激素,但3 种植物激素含量差别很大,GA3含量较高而IAA 和t-Z 含量甚微。Tomoaki 等[34]研究表明PGPR 代谢产物中的激素类物质能精确地与植物细胞中的特定蛋白质受体相结合,即使微量也能发挥重要的促生作用。
假单胞菌属和芽孢杆菌属(Bacillus)是土壤-植物生长体系中发挥重要作用的两大类土壤细菌[35],本研究分离的PGPR 多数属于假单胞菌属,这可能与宿主植物自身的生长环境密切相关,也可能与筛选PGPR 的温度有关。本研究中,一株高效的植物根际促生菌NCZ1 经分子生物学鉴定为P. psychrotolerans,在低温条件下表现出优良的促生特性。据报道该菌株是一株仅在南极土壤中分离到的新的耐寒细菌,可以耐受4 ℃的低温条件。研究表明生长于低温等逆境下的微生物,在长期适应生存的过程中,形成了独特的生理生化机制以抵抗外界环境变化[36],因此具有很强的抗逆性,在高寒草甸生态修复方面发挥良好的应用潜力,后期将进行进一步研究。
4 结论
从红原高寒地区3 种优良植物根际分离的PGPR 数量分布上呈“RP>RS>HP”的根际分布趋势;共分离得到76 株PGPR 菌株,固氮菌30 株,溶磷菌46 株,分泌GA3菌株26 株,分泌IAA 菌株18 株,分泌t-Z 菌株23 株,分泌t-Z 含量均小于0.31 μg·mL-1;筛选出有较强固氮、溶磷、分泌植物激素能力,且在低温下生长良好的菌株14 株,经鉴定分别属于假单胞菌属、不动杆菌属、假节杆菌属、贪噬菌属,其中,PAZ17、NAZ17、NCZ1、PAQ2 最具有作为微生物肥料在高寒植被恢复方面应用的潜力。

