过表达长穗偃麦草EeHKT1;4 基因增强拟南芥抗旱耐盐性分析
张勇,田小霞,郑明利,毛培春,孟林
(北京市农林科学院草业花卉与景观生态研究所,北京 100097)
干旱和盐是限制植物生长发育和作物产量的主要非生物胁迫因素[1-2],会导致植物细胞中有毒离子的过量积累,影响细胞代谢并抑制生长发育[3]。K+在大多数植物的生长发育过程中发挥重要作用,Na+与K+的理化性质相似,这导致K+易在细胞内被Na+置换,Na+流入使质膜去极化,激活外向整流K+通道导致K+流出[4]。拟南芥(Arabidopsis thaliana)细胞质中高浓度Na+会抑制根部AKT1 通道对K+的吸收[5],故Na+毒性是主要的生长抑制因素[6]。植物试图在细胞质中保持较低的Na+/K+,该比率通常被用作评估盐胁迫强度和植物耐盐性[7]。为了应对外界Na+压力,植物已经进化出完整的机制来确保在外部高Na+浓度的情况下对K+的吸收,以保证植物正常的生长发育[8-9];一方面限制Na+的流入,促进Na+外排以抵消不可避免的Na+流入;另一方面通过木质部长距离运输将Na+转运至植株的各个组织器官中,实现Na+在植物器官的重新分配[10-11],避免Na+在局部组织中过高累积。
植物高亲和性K+转运蛋白基因(high-affinity potassium transporters,HKT)编码K+、Na+转运或K+-Na+共转运质膜通道蛋白[12];虽然在双子叶植物基因组中的代表性较弱,如杨树(Populus)和拟南芥中仅存在单个HKT基因[13],但在单子叶植物中HKT家族包含更多成员,表现出巨大的功能多样性;如,水稻(Oryza sativa)拥有9 个HKT基因[13],大麦(Hordeum vulgare)和小麦(Triticum aestivum)基因组中拥有5~11 个HKT基因[14]。基于系统发育和功能分析,植物HKT基因已分为两个亚家族[15];亚家族I 类HKT存在于所有高等植物物种中,编码Na+选择性转运蛋白,而亚家族Ⅱ类基因是单子叶植物所特有,编码Na+和K+共转运蛋白系统[1,16-17]。亚家族I 类HKT的Na+转运蛋白已被证实在植物耐盐方面起关键作用[1,18-19]。AtHKT1;1在拟南芥的维管组织(木质部薄壁组织和韧皮部细胞)中表达,已被证明有助于从木质部汁液中卸载Na+及在盐胁迫下将Na+加载到韧皮部汁液中,从而减少植株地上部Na+的积累[20]。水稻OsHKT1;5和小麦TaHKT1;5-D均在根维管系统中表达,且在高盐浓度条件下阻止Na+由根部向地上部转移,将Na+保留在根中,从而使叶组织能够维持K+稳态[16,21-22]。尽管亚家族I类HKT基因均在维管组织中表达,参与植物体内Na+的分配,但I 类基因在不同组织器官中表达量存在差异,构成HKT 功能特性(对Na+的亲和力、对K+的敏感性、运输方向等),引起植物中Na+转移和组织累积不同,最终导致植物不同的盐敏感性。例如,盐胁迫下,水稻OsHKT1;1、OsHKT1;4和OsHKT1;5可降低叶片Na+含量,增强植物耐盐性,而OsHKT1;5主要在根中表达,OsHKT1;4主要在叶鞘和穗中表达,OsHKT1;1主要在叶中表达[17-21]。一粒小麦(Triticum monococcum)基因TmHKT1;4在根和叶鞘中行使功能,TmHKT1;5仅在根中发挥作用[23];大麦HvHKT1;5功能缺失,降低了盐胁迫下Na+从根部向地上部的转运,导致植物体内K+/Na+提高,耐盐性增强[24]。
长穗偃麦草(Elytrigia elongata)系禾本科小麦族偃麦草属多年生根茎疏丛型草本植物,具有较强抗旱耐盐性,是小麦的近缘物种,已成为小麦遗传改良的野生基因库[25]。先前的研究中,已从长穗偃麦草中发掘出一个耐盐基因EeHKT1;4,该基因主要在长穗偃麦草根中表达且不受外界K+影响,而NaCl 能诱导EeHKT1;4基因上调表达,导致K+在长穗偃麦草根中流失,表明EeHKT1;4在维持长穗偃麦草K+、Na+稳态中起重要作用[26]。基于此,本研究通过农杆菌介导的遗传转化法,将长穗偃麦草EeHKT1;4转化到拟南芥中,研究过表达EeHKT1;4拟南芥的抗旱耐盐性,为长穗偃麦草抗逆分子机制的研究提供重要理论基础,同时为通过基因编辑技术提高农作物耐盐性研究提供候选基因。
1 材料与方法
1.1 材料
1.1.1植物材料 长穗偃麦草(PI 531747)种子由美国国家植物种质资源库(The U. S. National Plant Germplasm System,NPGS)提供;试验所用拟南芥野生型(wild type,WT)为Columbia-0 型;植物材料均于2020年4 月9 日-2021 年5 月27 日置于25 ℃、光照16 h/黑暗8 h(白天/黑夜)的人工气候室培养。
1.1.2主要试剂 琼脂糖凝胶回收及质粒提取试剂盒购自天根生物公司,高保真Taq 酶、限制性内切酶XbaI和KnpI、克隆载体、反转录试剂盒、qPCR 试剂盒购于塔克拉(TaKaRa,日本)生物公司,植物表达载体pZh01 由本实验室保存。
1.2 方法
1.2.1植物表达载体构建 依据已获得的长穗偃麦草EeHKT1;4基因序列设计酶切引物(表1),以长穗偃麦草根cDNA 为模板,使用高保真酶,按照94 ℃预变性2 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min,30 个循环,72 ℃延伸7 min 的PCR 程序扩增EeHKT1;4基因。分别使用XbaI 和KnpI 酶切消化EeHKT1;4基因与植物表达载体pZh01,消化过的载体及基因片段纯化回收后使用T4连接酶连接,重组植物表达载体转化大肠杆菌DH5α。经测序比对,构建成功的植物表达载体,转化农杆菌GV1301,用于后续遗传转化。

表1 本研究所用的引物序列及用途Table 1 The primer sequence and application used in this study
1.2.2拟南芥遗传转化及分子鉴定 将转化有EeHKT1;4基因植物表达载体的农杆菌接种到添加了50 mg·L-1硫酸卡那霉素和50 mg·L-1利福平的LB 液体培养基中,28 ℃,200 r·min-1培养至OD600值0.8~1.0,参照李小冬等[27]描述的浸花法转化拟南芥野生型,收集转化后的拟南芥种子,记为T0代。T0代种子使用1%次氯酸溶液消毒后,使用无菌水洗涤7~8 次,平铺至添加了50 mg·L-1潮霉素的MS 培养基中,4 ℃春化3~4 d,然后转移至人工气候室置于光下培养。2 周后将抗性绿色小苗转移至土壤中培养,待成熟后提取抗性植株DNA,使用EeHKT1;4全长引物进行PCR 鉴定,同时提取转基因拟南芥RNA 反转录成cDNA,使用qEeHKT1;4-F/R 定量引物检测EeHKT1;4是否在拟南芥中表达。收集转基因种子,成功转化的拟南芥种子记为T1代,选择T1代抗潮霉素性状分离比为3∶1 的转基因拟南芥继续筛选至纯合。T3代种子用于后续抗旱耐盐试验。
1.2.3NaCl 和甘露醇处理下植株表型分析 拟南芥WT 和转基因T3代种子如1.2.2 所描述的方法脱菌后,均匀铺在不添加潮霉素的MS 培养基平板中,平板水平放置于如1.1.1 所描述的条件下生长4 d,选择已萌发的拟南芥,使用尖头镊子将WT 和转基因拟南芥幼苗点种于添加有50、100 mmol·L-1NaCl 和75、150 mmol·L-1甘露醇的MS 培养基平皿(直径9 cm)的同一直线上,将平皿垂直固定培养14 d,观察根生长状态并记录根长,每个浓度重复5 皿;同时选取WT 与转基因株系(L1、L2 和L5)各25 粒萌发后的种子置于上述培养基中,平板水平放置于上述相同培养条件下进行耐盐和干旱处理试验,生长20 d 后观察其表型并统计存活率,每个浓度重复3 皿。
1.2.4转基因拟南芥DAB 与NBT 染色 使用0.01 mmol·L-1磷酸盐缓冲溶液(pH=7.0)配制1 mg·mL-1二氨基联苯胺(diaminobenzidine,DAB)溶液和0.5 mg·mL-1硝基氮蓝四唑(nitroblue tetrazolium,NBT)溶液;选择不同胁迫处理生长20 d 后的转基因拟南芥同一位置的叶片,分别置于添加有适量DAB 和NBT 溶液的10 mL 离心管中,真空渗透10 min,置于28 ℃恒温培养箱中DAB 避光染色6 h,NBT 避光染色2 h。染色完毕后弃染色液,使用95%酒精煮沸脱色5 min,观察并拍照。
1.2.5转基因拟南芥抗逆相关基因的表达模式分析 提取不同干旱、盐胁迫处理下生长20 d 的转基因和野生型拟南芥RNA,按照TaKaRa 反转录试剂盒说明书的要求反转录成cDNA,作为qPCR 的模板,根据已报道的拟南芥AtSOS1、AtNHX1、AtP5CS1和AtRD29B基因序列设计定量引物(表1),以拟南芥AtACTIN基因作为内参基因,按照侯洁茹等[28]描述的qPCR 程序进行PCR,采用2-ΔΔct计算基因的相对表达量。
1.3 数据分析
表型统计、组织化学染色和qPCR 均进行3 次生物学重复;使用t-test 进行显著性分析,不同的小写字母代表P<0.05;GraphPad Prism 5 和Adobe Illustrator CS5 软件用于作图。
2 结果与分析
2.1 EeHKT1;4 基因表达载体构建
先前的研究中,已成功从长穗偃麦草中获得EeHKT1;4基因,该基因包含1722 bp 的开放阅读框(open reading frame,ORF),编码573 个氨基酸,且与其他植物HKT1 氨基酸序列同源性达65%以上。采用双酶切的方法将EeHKT1;4基因构建至pZh01 植物表达载体(图1A),经测序和酶切验证,正确的植物表达载体命名为35S::EeHKT1;4,同时转化至农杆菌中。
2.2 EeHKT1;4 转基因拟南芥鉴定
采用农杆菌介导的浸花法转化拟南芥野生型,收集转化后的种子经潮霉素抗性筛选,获得抗性植株(图1B)。提取抗性植株DNA 并使用EeHKT1;4基因全长引物进行PCR 检测,获得1722 bp 的条带(图1C),与预期结果一致;提取PCR 阳性植株RNA 反转录成cDNA,以拟南芥AtACTIN为内参基因,使用qEeHKT1;4-F/R 定量引物检测,结果在L1、L2、L4 和L5 中检测到PCR 条带,而在WT 中并未检测到PCR 条带(图1D),表明EeHKT1;4基因已成功整合到拟南芥基因组中并表达。
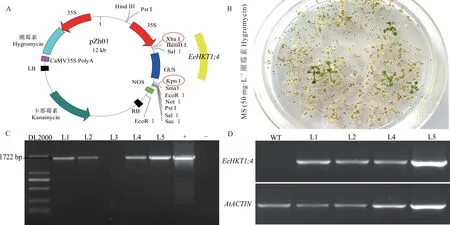
图1 转基因拟南芥植株的获得与鉴定Fig.1 Obtaining and identification of transgenic Arabidopsis
2.3 NaCl 与甘露醇胁迫下EeHKT1;4 转基因拟南芥主根的表型变化
将萌发后的转基因拟南芥与WT 转移至不同浓度NaCl 和甘露醇的MS 培养基中,垂直生长结果显示,正常生长条件下,转基因株系L1、L2 和L5 与WT 的根长均未有差异;在NaCl 和甘露醇各个浓度处理下,L1、L2 和L5株系与WT 主根的生长均受到抑制,且随着处理浓度的增加抑制愈加显著,但L1、L2 和L5 株系主根生长受抑制程度较WT 小,主根长度显著高于WT(图2)。
2.4 NaCl 与甘露醇胁迫下EeHKT1;4 转基因拟南芥植株表型变化
将萌发后的转基因拟南芥与WT 转移至不同浓度NaCl 和甘露醇处理的MS 培养基中生长20 d,正常生长条件下WT 与转基因株系的长势一致并未表现出差异(图3)。50 mmol·L-1NaCl 处理下,WT 部分植株表现叶片萎缩,而转基因株系的生长与正常条件下的生长基本一致;100 mmol·L-1NaCl 处理下,WT 出现植株叶片萎缩和枯黄现象,而L1、L2 和L5 株系中仅有少量植株出现萎缩。75 mmol·L-1甘露醇处理下,WT 的部分植株表现出叶片萎缩,L1、L2 和L5 株系中仅有少量植株出现萎缩;150 mmol·L-1甘露醇处理下,WT 的大部分植株表现叶片萎缩且枯黄,L1、L2 和L5 株系中仅有少量植株出现萎缩和少量的枯黄。不同胁迫处理下植株存活率的统计显示,正常生长条件下,WT 与各转基因株系的植株存活率无差异,而在NaCl 和甘露醇处理下,WT 的植株存活率显著低于同等处理条件下转基因植株。
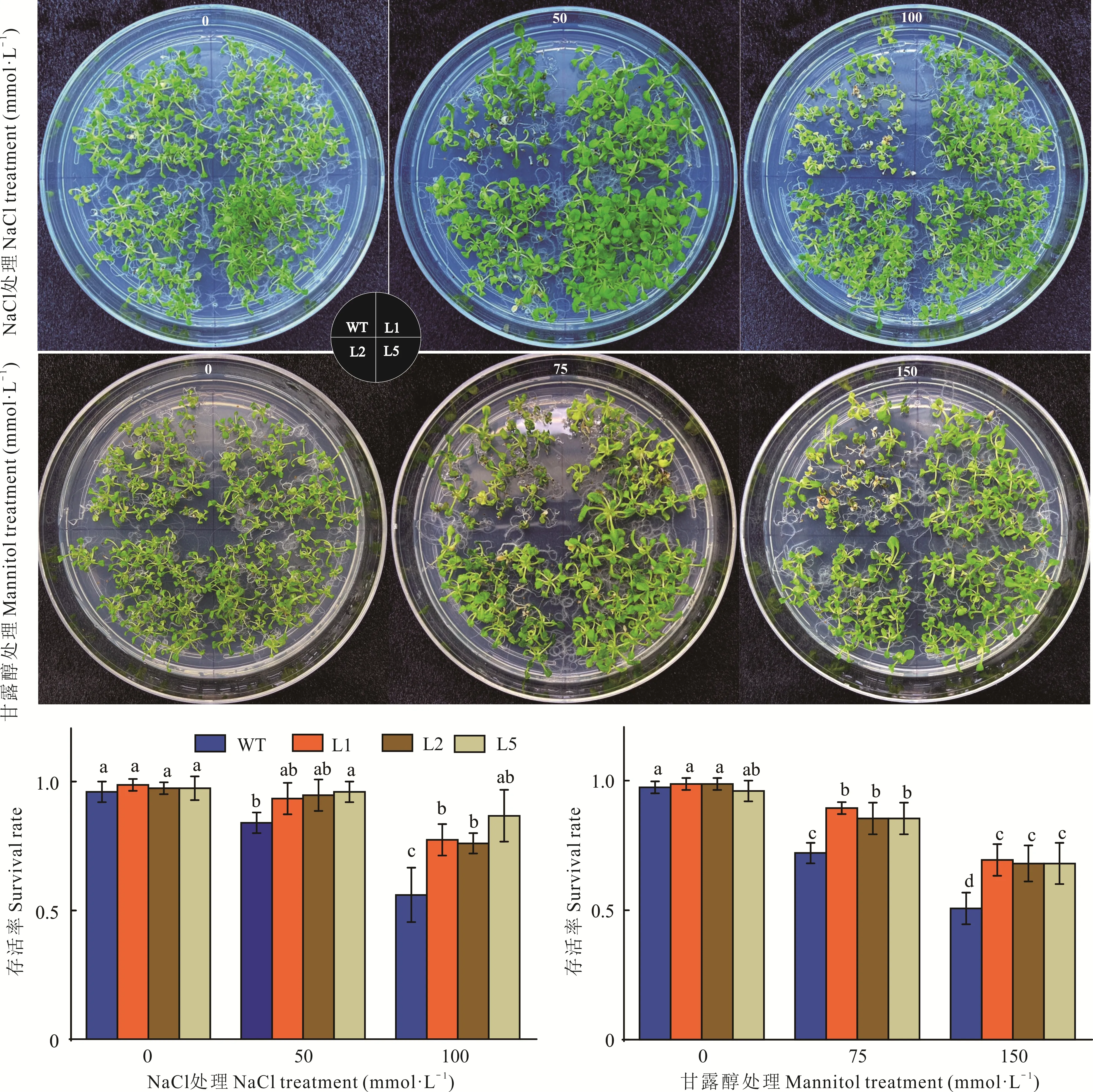
图3 NaCl 与甘露醇处理下转基因与野生型拟南芥表型分析Fig.3 Phenotype analysis of transgene and wild-type Arabidopsis under NaCl and mannitol treatment
2.5 NaCl 与甘露醇胁迫下EeHKT1;4 转基因拟南芥组织化学染色
选取NaCl 与甘露醇胁迫下EeHKT1;4转基因拟南芥株系和WT 相同生长位置的叶片分别进行NBT 和DAB 染色,结果显示,NBT 染色中,正常生长条件下,WT 与转基因各株系染色相对较浅,随着NaCl 浓度的增加所有叶片呈蓝色的程度逐渐加深,且同等胁迫处理下WT 被染色程度高于转基因各个株系;同样地,随着甘露醇浓度的增加,叶片的染蓝色程度逐渐加深,且同等胁迫处理下WT 被染色程度也高于转基因各个株系。DAB 染色中,未胁迫处理的WT 与转基因各个株系染色相对较浅,仅在叶片上出现棕色斑点,随着NaCl 处理浓度的增加所有叶片呈红褐色程度逐渐加深,且同等胁迫处理下WT 被染色程度高于转基因各个株系;随着甘露醇浓度的增加,叶片的染红褐色程度也逐渐加深,且同等胁迫处理下WT 被染色程度高于转基因各个株系(图4)。
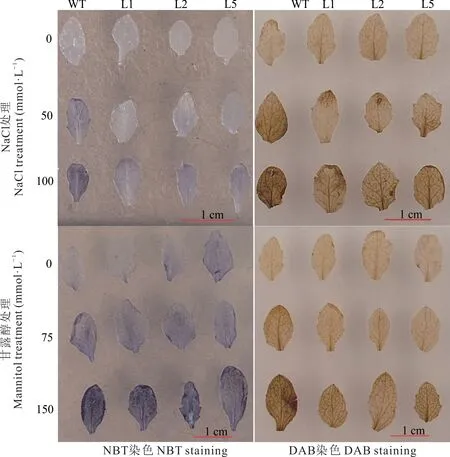
图4 NaCl 与甘露醇处理下转基因株系与野生型拟南芥的DAB 和NBT 染色Fig.4 DAB and NBT staining for the transgenic and wild-type plants under NaCl and mannitol treatment
2.6 拟南芥抗性相关基因的表达分析
提取不同浓度NaCl 和甘露醇胁迫处理下的拟南芥RNA 反转录成cDNA,检测拟南芥抗逆基因的表达水平,在NaCl 处理下,AtNHX1基因上调表达且转基因拟南芥植株中的表达量低于野生型(图5);除转基因拟南芥株系L5 外,随着NaCl 处理浓度的增加,WT 和转基因株系的AtNHX1基因表达量未显示出明显差异。NaCI 处理同样会诱导AtSOS1基因的表达,以正常生长条件下AtSOS1基因的表达量为对照,随着NaCl 处理浓度的增加,AtSOS1基因在WT 和转基因株系中均逐渐上调;在甘露醇处理下,AtRD29B和AtP5CS1基因均上调表达且随着甘露醇处理浓度的增加上调幅度愈加明显,且转基因株系中的表达量高于同等胁迫处理下的WT。
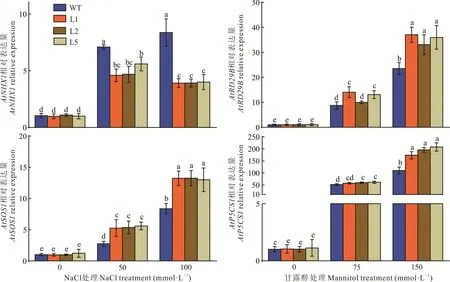
图5 NaCl 与甘露醇处理下拟南芥抗性相关基因的表达分析Fig.5 Expression analysis of Arabidopsis resistance-related genes under NaCl and mannitol treatments
3 讨论
长穗偃麦草EeHKT1;4基因编码573 个氨基酸,且与其他植物HKT1 氨基酸序列同源性达65%以上,其氨基酸序列上存在编码P-loop A 区域的一段保守序列LFFTAVSAATVSSMSTV,含有丝氨酸残基,是Na+特异选择性位点,另外,EeHKT1;4表达丰度在外源KCl 处理下并未发生变化,但却受到NaCl 诱导[28],结果表明EeHKT1;4 属于HKT1 家族。
非生物胁迫下植物通过调整组织细胞的数量和大小来应对不适的外界环境,如干旱和盐胁迫处理下植物根系的生长受到抑制等[29-30]。正常生长条件下拟南芥WT 与转基因株系的植物长势一致并未表现出差异,NaCl 和甘露醇处理下WT 植株均表现出叶片萎缩、植株枯黄和根系生长受到抑制的现象,而转基因株系仅有少量植株出现叶片萎缩;根系的抑制程度显著低于同等胁迫条件下的WT。NaCl 和甘露醇处理下,植株存活率和主根长度统计结果显示,正常生长条件下,WT 与转基因拟南芥株系的植株存活率及主根长度无显著差异,而在NaCl 和甘露醇处理下WT 的植株存活率及主根长度均显著低于同等条件下的转基因植株。以上结果表明,EeHKT1;4异源过表达增强了拟南芥抗旱性和耐盐性。
非生物胁迫下植物体内活性氧(reactive oxygen species,ROS)大量产生,少量的ROS 可触发适应性反应中的信号通路,而高浓度的ROS 会对DNA、蛋白质和膜脂等大分子造成损伤[31]。因此,ROS 含量可作为生物体氧化胁迫的信号[32]。NBT 能与超氧阴离子反应生成不溶于水的蓝色甲臜颗粒[33],沉淀在叶片表面;蓝色越浅,表明该植株的抗氧化能力越强。正常生长条件下,拟南芥WT 与转基因各个株系的染色相对较浅,随着NaCl 浓度的增加所有叶片呈蓝色的程度逐渐加深,且同等胁迫处理下WT 被染色程度高于转基因各株系;随着甘露醇浓度的增加,叶片的染蓝色程度逐渐加深,且同等胁迫下WT 被染色程度高于转基因各个株系,表明转基因株系能更好地清除超氧阴离子,提高植物的抗旱性和耐盐性。DAB 可以与H2O2反应生成黄褐色不溶性沉淀,聚集在叶片表面,色泽越深,表明H2O2含量越高[34]。未胁迫处理的拟南芥WT 与转基因各个株系的染色相对较浅,仅在叶片上出现棕色斑点,随着NaCl 处理浓度的增加所有叶片呈红褐色的程度逐渐加深,且同等胁迫处理下WT 被染色程度高于转基因各个株系;同样地,随着甘露醇处理浓度的增加,叶片的染红褐色程度也逐渐加深,且同等胁迫下WT 被染色程度高于转基因各个株系。
在盐胁迫条件下,AtNHX1会将胞质中过量的Na+转移至液泡中,维持细胞渗透压并降低Na+的毒性[35],以增强植物耐盐性。植物应对过量Na+的主要方式是盐过度敏感(SOS)途径,SOS1通过实现细胞Na+外排提高植物耐盐性。本研究中,NaCl 处理下,AtNHX1基因上调表达且转基因株系的表达量低于野生型,除转基因株系L5外,转基因各个株系在50、100 mmol·L-1NaCl 处理条件下AtNHX1基因表达量无差异,该结果与WT 表现一致;NaCl 处理同样会诱导AtSOS1基因的表达,随着NaCl 浓度的增加,AtSOS1基因在WT 和转基因植株中均逐渐上调。植物干旱胁迫下会产生大量的脱落酸(abscisic acid,ABA)和脯氨酸,ABA 将作为信号分子促进气孔关闭,促进根对水分和离子的吸收;脯氨酸能调节细胞渗透压保护质膜免受破坏[36]。拟南芥AtRD29B和AtP5CS1分别是ABA 和脯氨酸合成基因,在甘露醇处理下,AtRD29B和AtP5CS1基因均呈上调表达且转基因植株中的表达量高于野生型,表明EeHKT1;4异源过表达上调了干旱和盐胁迫下拟南芥抗逆基因的表达,降低了植株中ROS的含量,增强了植物抗旱性。
4 结论
本研究将长穗偃麦草EeHKT1;4基因在拟南芥中异源过表达,干旱和盐胁迫下拟南芥表型特征、组织化学染色与拟南芥相关抗逆基因表达模式的分析,表明EeHKT1;4在植物响应干旱和盐胁迫中起重要作用。长穗偃麦草EeHKT1;4直接或间接影响不同的植物组织器官中Na+/K+,进而影响抗逆基因的表达和ROS 在细胞中的积累以增强其抗旱耐盐性。

