ceRNA 调控网络在骨关节炎中的研究进展及中医药干预现状
杨 雷,伍搏宇,熊 辉*,齐新宇*,杨少锋
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007)
骨关节炎(osteoarthritis, OA)是一种严重影响患者生活质量的关节退行性疾病,给家庭和社会造成了沉重的负担。 OA 不但导致关节疼痛、畸形与功能障碍,还可显著升高心血管事件、下肢深静脉血栓栓塞、髋部骨折及全因死亡率的风险[1]。据文献报道,目前全球已有超过3 亿OA 患者[2],而我国40 岁以上人群原发性OA 的总体患病率已高达46.3%[3]。 随着我国人口老龄化程度的不断加剧,OA 的患病率有逐渐加重的趋势。 OA 的发病机制尚不清楚,其病因复杂多样,涉及创伤、炎症、关节发育异常、感染、肥胖等因素[4]。 目前,OA 诊疗方法多样,然而近几十年来,OA 的诊疗水平并没有突破性的进展,现有的治疗方法也以对症治疗为主,旨在缓解疼痛,提高生活质量,对于OA 的病理本质却无法逆转。 因此,进一步探索OA 的发病机制、 寻找OA 治疗的靶点及生物标志物,对OA 的治疗药物开发、诊疗水平的提升至关重要。
中心法则确定人类以“基因-RNA-蛋白”为准生物定律。 表观学说兴起后,人们发现只有约2%的RNA 参与蛋白的编码,而剩下98% RNA 不参与直接编码蛋白过程,称为非编码RNA(non-coding RNA,ncRNA)[5]。后者因缺乏生物学功能,一度被认为是基因转录的“副产物”或“暗物质”。 随着二代测序技术的发展,众多的ncRNA 被发现,以往被认为是垃圾分子的ncRNA 生物学功能也逐渐被揭示,其在生物学中的作用也得到广泛关注[6]。 2011 年哈佛医学院SALMENA 等[7]提出竞争内源性RNA(competing endogenous RNA, ceRNA)假说,指出ceRNA 并不是新的RNA 分子,而是一种新的基因调控模式。 该假说认为ceRNA 只要在其3'-UTR 上包含相同的miRNA 反应元件(miRNA response elements, MRE),就能够竞争性结合miRNA,从而降低/增强靶RNA的稳定性,或限制/促进靶RNA 表达效率和水平,介导生物体的生理和病理过程。 随着ceRNA 学说研究深入,人们发现靶RNA、长非编码RNA(long noncoding RNA, lncRNA)、环状RNA(circular RNA, circRNA)和假基因转录物等都可以作为ceRNA 与miRNA 结合,调控相关的基因表达,介导OA 的发生发展。 本研究阐述OA 中ceRNA 的生物学特点,并重点介绍了经过验证的ceRNA 参与OA 的生物学功能;此外,还讨论了ceRNA 作为新型预后和诊断生物标志物的临床意义,以及中医药治疗OA 的现状。
1 组成ceRNA 的分子特点和生物学功能
研究发现,同卵双胞胎同时患OA 的比例较高,因而遗传因素逐渐被认为是OA 的危险因素之一[8]。 随着相关基因组学技术的发展,越来越多的学者认为OA 的发病机制涉及ncRNA 介导的表观遗传学效应。
1.1 lncRNA 特点及生物学功能
lncRNA 是转录本长度超过200 个碱基序列的ncRNA,主要位于细胞核内,大部分lncRNA 都有A聚尾结构,与mRNA 结构相似[9]。 lncRNA 可以通过不同途径调节基因表达水平,包括染色质修饰、转录和转录后的干扰,在细胞分化、增殖、凋亡等过程中发挥调节作用[10]。 对于染色质修饰,lncRNA 通过与染色质重塑复合物相互作用在特定基因组位点诱导染色质形成,从而导致基因表达降低。 此外,由于RNA 的灵活性,lncRNA 能够折叠成独特的二级构象,形成类似DNA 结合域、RNA 结合域以及蛋白质结合域分子结构,促进它们能够与DNA 颗粒、RNA颗粒和蛋白质复合物结合,在转录和转录后的水平进行调节[11],例如lncRNA 可抑制RNA 聚合酶Ⅱ、调控组蛋白乙酰化或DNA 的甲基化,从而影响基因的表达[12],同时与有相应结合位点的特定蛋白质相结合,调节蛋白质的活性[13]。基于这些特性,lncRNA 参与许多重要的生物学过程,如基因印记、转录增强、染色体循环和反义调控等,一些特殊的lncRNA 还参与细胞器的组成过程。 随着对lncRNA 的深入研究,人们还发现某些lncRNA 还具有信号分子、分子诱导、导向分子及分子支架等生物学功能[14]。
1.2 circRNA 特点及生物学功能
circRNA 是一种封闭环状的特殊类型的ncRNA,3'-端与5'-端共价结合生成circRNA,其没有开放的线性尾,所以对核酸外切酶不敏感,不易被酶降解,表达更加稳定[15]。 circRNA 富含miRNA 结合位点,可以像“海绵”吸附一样与相应的miRNA 结合,而发挥“海绵吸附”效应,促使miRNA 无法与靶基因结合,进而调控靶基因的表达。有些circRNA 还能结合RNA 结合蛋白,从而改变蛋白的功能或者水平。此外,circRNA 可以翻译成有生物功能的肽段,调控不同的生物学功能。
1.3 miRNA 特点及生物学功能
miRNA 是一类小于50 个碱基序列的ncRAN分子,广泛存在于真核生物中。 在哺乳生物中,大约50%以上蛋白质编码基因受其调控。 miRNA 可以与靶基因mRNA 的3′-非翻译区形成互补序列,进而抑制mRNA 的翻译或剪切功能,所以其主要发挥对靶基因mRNA 的抑制效应,在转录水平对靶基因进行直接调控,在生物体的生长发育、细胞凋亡、细胞增殖、病毒防御以及脂肪代谢等过程发挥作用。
1.4 假基因特点及生物学功能
假基因的最初定义为非功能性基因组DNA 序列[16],它们起源于整个进化过程中重复基因的衰变,与功能基因相似,但在编码序列中含有缺陷序列,如终止密码子、框架转移、缺失等。 假基因主要是通过其转录物对基因进行调控:(1)假基因反义链,假基因可以转录成为亲本基因反义链RNA,反义链RNA与亲本基因的转录本形成RNA 双链或互补配对,继而影响后者在细胞中的表达,从而抑制其功能;(2)内源性小干扰RNA,假基因转录本和亲本基因转录本杂合成的双链RNA,或有重复序列的假基因转录本由核糖核酸内切酶剪切而成,这些小干扰RNA 通过RNA 机制来调节亲本基因的表达;(3)通过ceRNA机制影响miRNA 的假基因,假基因与miRNA竞争与靶基因的结合,进而调控靶基因的表达。 有些假基因还可以编码短肽和蛋白质发挥调节功能[17]。
2 ceRNA 调控网络在OA 的分子机制中的作用
OA 是一种完整的关节疾病,它涉及整个关节结构,包括软骨、软骨下骨、滑膜以及关节周围韧带等结构[18]。软骨退变、软骨下骨硬化、骨赘形成、滑膜炎症等是其主要病理表现,以往认为其是一类“磨损”类疾病,随着研究深入,人们发现它涉及机械负荷、感染、遗传、肥胖等因素,最终造成软骨破坏失去完整性[1]。人们以往认知OA 为被动的骨关节退行性疾病,然而现有证据已经表明,其是一种修复-损伤失衡的主动动态病理过程[19]。 早期以软骨成分发生变化为主,造成软骨材料性质的改变,增加其对机械应力破坏的敏感性,而后机械应力造成软骨裂隙,扩大钙化软骨区,而在修复过程中,病态的软骨细胞的反馈表现出更高的基质合成能力,伴随着基质降解产物和促炎介质产生,加重对软骨细胞的损害,这些基质降解产物和促炎介质会作用于滑膜,造成滑膜水肿和炎症反应,所以在OA 患者中,滑膜炎症是共有症状[19]。与此同时,受刺激的滑膜细胞也会释放促炎产物, 引发巨噬细胞、 浆细胞以及树突状细胞浸润,加重软骨的侵蚀。 而在软骨下骨,破坏的松质骨会形成血管翳,穿过潮线,进入软骨,引发免疫和炎症反应,加重对软骨的破坏。关节边缘发育的骨赘则是在炎症反应、机械应力、免疫介导、代谢改变等共同作用下形成。 因此,OA 的病理涉及了炎症成分增加、机械负荷过载、代谢改变、细胞衰老等病理过程[20],详见图1。 这些机制表型并不是独立存在,而是重叠交叉,所以,应将OA 描述为一种综合征,而不是一种单一的疾病,ceRNA 网络失衡以及分子之间的相互调控在其中扮演着重要的角色。
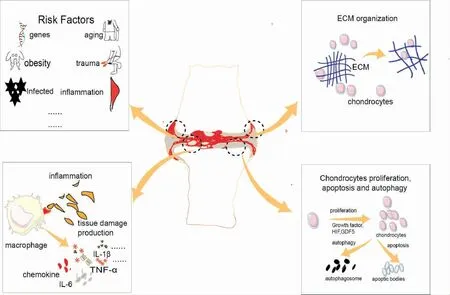
图1 OA 的主要病理机制
2.1 lncRNA 作为ceRNA 与miRNA 结合在OA 发病过程中的作用
lncRNA 在OA 发展过程中发挥着各种功能。为了深入了解lncRNA 在OA 中作用机制以及病理表型的介导,对其转录序列进行深入挖掘并进行分组,对lncRNA 与OA 相关性、软骨细胞凋亡、增殖和ECM 代谢以及信号通路等研究,进一步加深对疾病的理解。
研究显示,lncRNA 主要在软骨细胞增殖、细胞凋亡、ECM 代谢、炎症反应等方面发挥作用[21-27](见表1)。同一lncRNA 可以通过竞争结合不同的miRNA来调控OA 的进展,例如FAN 等[28]发现lncRNA DANCR在OA 患者的中显著上升,其作为ceRNA 作用于海绵miR-577,促进软骨细胞增殖,抑制细胞凋亡;而LI等[29]发现lncRNA DANCR 的敲低可以减弱脂多糖诱导的细胞凋亡和炎症反应,提高软骨细胞增殖、抑制细胞凋亡,这一作用是通过海绵作用负向调节miR-19a 的表达完成的,此外,lncRNA DANCR 还可以通过miR-216a-5p 来调节OA 软骨细胞的存活,并且调节JAK2/STAT3 信号通路,抑制炎症反应对软骨的侵蚀[30]。 lncRNA SNHG5 作为ceRNA可分别与miR-10a-5p、miR-181a-5p、miR-26a 等miRNA 竞争性结合[31-33],促进软骨细胞的增殖,抑制凋亡,延缓OA 的进程,而lncRNA XIST 可以分别与miR-675-3p、miR-142-5p、miR-149-5p、miR-653-5p、miR-376c-5p、miR-130a 等结合[20,34-38],从ECM 代谢、炎症反应、软骨细胞增殖、细胞凋亡等不同表型影响OA 的发展,这说明lncRNA 作为ceRNA调节的复杂性。 除此之外,信号通路与OA 的之间也存在密切关系,且受到lncRNA 的调节。 LIANG 等[39]发现,lncRNA MALAT1 可以靶向miR-127-5p,从而通过抑制骨桥蛋白和激活PI3K/Akt 信号通路,调节软骨细胞增殖;lncRNA ARFRP1 通过靶向miR-15a-5p,激活NF-κB 通路,加重炎症反应过程,而沉默lncRNA ARFRP1 表达,可以减缓OA 的进程,有望为OA 的治疗提供靶点。

表1 lncRNA 中作为ceRNA 在OA 中的作用及机制总结
2.2 circRNA 作为ceRNA 与miRNA 结合在OA 发病过程中的作用
circRNA 具有结构稳定、高度保守、分布广泛、特异性强等特点,不仅参与疾病的发展过程,而且可以作为诊断标志物和治疗靶点[40]。随着研究的深入,越来越多的circRNA 被发现,尤其是外周血、滑液等体液中,其易于获取和检测,在OA 中的诊疗价值越来越受到关注。 WANG 等[41]发现,circ_RUNX2在OA 血清中显著高表达,利用生存曲线研究其预后价值,发现血清circ_RUNX2 可以作为早期诊断的生物标志物和预后的判决指标;同样,通过微阵列分析OA患者滑液中的circRNA 表达谱,发现circRNA(hsa_circ_0104595、hsa_circ_0104873 和hsa_circ_0101251)的表达出现显著差异,因此,可以作为诊断OA 的特异性生物标志物[42]。 此外,circRNA 也可以作为OA药物的治疗靶点,虽然目前还没有开发出药物,但是在实验过程中,通过增强或者减弱circRNA 的表达显示较好的治疗效果[43]。circRNA 在OA 中的主要作用[44-52]详见表2。

表2 circRNA 作为ceRNA 在OA 中的作用及机制总结
目前,研究circRNA 在OA 中的“海绵”功能已经相当成熟,尽管如此,对circRNA 和OA 的研究仍然存在局限性。一方面,如上所述,几乎所有的研究都集中在circRNA 在OA 中的“海绵”功能,而其他机制如转录调控和与RBP 的相互作用仍然难以不清楚。另一方面,关于circRNA 在OA 中的临床应用的研究仅限于诊断生物标志物和可能的治疗靶点,许多新方向尚未探索。 所以深入挖掘circRNA在OA 中的作用,可能为诊疗OA 提供一个新的方向。
2.3 假基因作为ceRNA 与miRNA 结合在OA 发病过程中的作用
假基因,定义为蛋白质编码基因功能失调的转录本,其在产生过程中,在编码基因序列中出现有害突变而形成,因其丧失了编码蛋白质的功能,所以在很长一段时间内都认为是无用的垃圾基因序列。 而随着人类基因组计划的改进表明,许多假基因具有转录活性,以不同的方式在转录后水平发挥作用。它的失调可以导致疾病的发生,其中,假基因作为ceRNA 是其发挥基因调控作用的重要方式,且这种作用方式已在多种疾病中得到证明[53]。然而,目前对假基因在OA 中研究较少。 LIU 等[54]研究发现TMSB4假基因lncRNA-MSR 在受损软骨中被上调,并在软骨细胞中被激活以响应机械应力。 此外,lncRNAMSR 通过与软骨细胞中的miRNA-152 竞争来调节TMSB4 的表达。 lncRNA-MSR 的上调引发了导致软骨退化的病理变化,而lncRNA-MSR 的抑制可能成为OA 的潜在治疗靶点。
目前,约14 000 个假基因在人类基因组中被发现,其功能也被揭示。 假基因与亲本基因有高度同源性,且两者存在许多相同的MRE[55],因此,假基因是理想的ceRNA。 可以推断,OA 病理过程中存在一定量的假基因作为ceRNA 发挥基因调控作用,但这还需要进一步研究证实。 ceRNA 在OA 中的作用机制详见图2。 在Dicer 酶作用下,核内前体miRNA 变为成熟的miRNA,释放到胞质后与Argonaute 蛋白结合形成miRISC,miRISC 可以与靶mRNA 的MRE结合,从而抑制mRNA 表达。含有相同的MRE 的不同类型RNA(lncRNA、circRNA),转录假基因作为ceRNA 竞争结合miRNA,从而阻碍miRNA结合靶mRNA,解除miRNA 抑制靶mRNA编码蛋白作用。

图2 OA 的ceRNA 调控机制
3 中医药在OA 治疗中的ceRNA 调控机制研究
OA 属于中医学“痹病”范畴,中药治疗OA 具有多部位、多环节、多靶点的作用机制,对于OA 的治疗具有重大的前景。现有研究表明,中药提取物以及中药复方可以通过抑制炎症反应、促进ECM 合成、抑制软骨细胞凋亡等作用延缓OA[56]。 例如,中药单体姜黄素可以降低前列腺素E2 水平而延缓膝OA的发展[57],中药复方独活寄生汤具有抗氧化应激、软骨保护、抗细胞凋亡、抑制炎症反应[58]等作用而治疗各类型的OA。
进一步研究表明,ceRNA 调控机制也是中药治疗OA 的重要调控方式。 例如,李涛研究发现,益气养血方可以上调lncRNA-UFC1 表达,进而竞争性结合miR-34a,抑制MMP13 的水平,从而延缓软骨退变[59]。 lncRNA SNHG7 是重要的OA 抑制因子,在OA 患者中低表达,其可竞争性吸附miR-34a 上调SYVN1 基因的表达,进而影响软骨细胞增殖、凋亡和自噬,延缓OA[21]。 YAO 等[60]发现姜黄素可以通过靶向miR-34a 通过Akt/mTOR 通路激活自噬来发挥软骨保护作用;而张丽等[61]利用脂多糖诱导的骨损伤细胞模型中,证实淫羊藿总黄酮可以调控miR-34a 的表达,而发挥保护作用;LIU 等[62]发现中药复方独活寄生汤可以抑制miR-34a 表达,调节内质网应激来抑制软骨细胞凋亡,而治疗OA;此外,补骨脂素和左归丸等都可以调控miR-34a 表达,在成骨细胞分化中发挥作用[63]。 上述结果提示,调节miR-34a 表达,可以促进软骨细胞增殖,抑制细胞凋亡,调节细胞自噬等功能,发挥治疗OA 的作用。 因此,这些中药及其有效成分在lncRNA SNHG7/miR-34a 通路上可能参与相应靶点的调控。
一些中药单体也通过直接或间接ceRNA 机制发挥治疗OA 的作用,例如:姬松茸多糖上调miR-382-3p 表达保护IL-1β 诱导的软骨细胞损伤[64];红花黄色素上调miR-140-5p 促进IL-1β 诱导的OA软骨细胞自噬,减少细胞凋亡和炎症因子分泌[65];毛蕊异黄酮可增强OA 软骨细胞的增殖能力,并减少细胞凋亡,其作用机制可能与上调细胞中miR-502-5p 表达有关[66]。 这些单体发挥治疗作用的本质可能与ceRNA 机制相关,因此,中药及其有效成分通过ceRNA 发挥调节作用的机制研究将会有效推动OA相关中药药理研究的发展。 运用现代科学的研究理念,将中医药治疗与ceRNA 作用机制相结合,或可对未来的OA 治疗的研究提供一条新路径。
4 结语
众所周知,OA 的患病率高、治愈率低、影响人群大以及诊疗方法相对缺乏,因此,明确其病因,深入探究其机制,对于OA 的早期诊断、药物开发、靶点干预以及预测转归等都具有重要意义。 随着高通量测序和生物信息学技术的发展,人们发现众多的ceRNA 参与OA 的软骨细胞凋亡、炎症反应、ECM合成与代谢、免疫调节、细胞的自噬等病理过程。 本文着重介绍了lncRNA、circRNA 和假基因等转录物,通过MRE 与miRNA 相结合,构建一个复杂、巨大的ceRNA 调控网络,参与OA 的各个生理病理过程,加深对转录物调控蛋白编码过程和疾病的认知,拓宽OA 的研究途径。 从现有的研究水平看,ceRNA 的主要调节途径是RNAs-miRNA-RNAs 模式,在此模式下关键的miRNA 和ceRNA 可有望成为OA 的诊断和治疗的靶标。例如人工miRNA 抑制剂,通过载体进入细胞后,与细胞内天然miRNA 完全或部分互补结合,缓解其对靶mRNA 的过度抑制,促进有益的mRNA 的稳定性及翻译,从而可以恢复正常的细胞表型。 目前,人工miRNA 抑制剂已经逐步应用在靶mRNA 缺失和miRNA 高表达疾病的基因治疗。 此外,利用miRNA“海绵吸附”效应,人工开发的miRNA 海绵模拟物,相比基因敲除和传统人工miRNA 抑制剂技术,有着更加稳定、广泛的特点,是一种有前景的治疗策略。 然而,基于ceRNA理论的新型人工miRNA 抑制剂在OA 治疗领域尚处于动物或细胞实验阶段,与临床应用还有一定的距离。
OA 中的ceRNA 调控网络复杂多样,与众多疾病一样,OA 的ceRNA 机制是由miRNA 介导转录调控的,它连接着编码RNA 和ncRNA 的功能,ceRNA成分的丰度和亚细胞位置,与miRNA 亲和力都是影响ceRNA 功能发挥的因素。此外,研制ceRNA 治疗剂有效、精准的递送载体也是当前面临的挑战,对突变基因的非特异性操作可能还会影响和改变正常基因的表达。 但不可否认的是,加深OA ceRNA 调节机制研究,对于OA 的诊疗仍有广泛前景。 同时,中药有效成分干预在OA 治疗方面有巨大潜力,而基于ceRNA 调控的中医药治疗OA 的机制研究也为OA 治疗提供了新的研究方向。

