T10 脊髓损伤后T10~L2 脊髓组织中差异表达蛋白的生物信息学分析
唐丽亚,瞿启睿,吴 霞,龙轶映,许 明,张 泓,刘 琼,艾 坤*,周 璐*
(1.湖南中医药大学,湖南 长沙 410208;2.长沙医学院,湖南 长沙 410219;3.郴州市第一人民医院,湖南 郴州 423000)
神经源性膀胱(neurogenic bladder, NB)是脊髓损伤后常见的并发症之一[1]。 膀胱正常的排尿反射由脊髓的交感神经区(T10~L2 脊髓节段)、副交感神经区(S2~S4 脊髓节段)和脑桥等高级中枢共同控制。脊髓损伤后由于炎症反应、胶质细胞增生和氧化应激等继发性损伤,导致神经组织损伤范围进一步扩大,出现胶质瘢痕增生和轴突再生障碍。T10 及以上脊髓损伤后,支配膀胱的交感神经失去脑桥等高级排尿中枢的控制而出现过度兴奋,其支配的膀胱括约肌(膀胱颈)过度收缩,最终导致膀胱颈梗阻和膀胱排尿障碍[2],继而引起尿液反流和肾功能损伤等一系列泌尿系统问题[3-4]。
因此,减轻脊髓损伤后的继发性损伤,保护神经组织,抑制T10~L2 脊髓节段交感神经区过度兴奋是治疗脊髓损伤后膀胱颈功能障碍(bladder neck dysfunction, BND)的重要思路之一。 目前,临床上主要通过膀胱颈切开术和注射α 受体阻滞剂来治疗BND,虽然取得一定疗效,但依然存在术后并发症、药物毒副作用等缺陷[5-6]。 因此,从T10~L2 脊髓节段寻找其他潜在的干预靶点来指导治疗脊髓损伤后BND,其临床意义尤为重要。
TMT 标记定量蛋白质组学技术能更全面地检测出组织中表达的蛋白质,这也为蛋白质组学的应用实现高灵敏度和高深度的蛋白质组覆盖[7]。通过筛选目标组织中的差异表达蛋白(differentially expressed proteins, DEPs),并对DEPs 进行生物信息学分析,重点探讨潜在的关键靶点蛋白,能从多个角度探讨疾病的病理机制[8],有助于挖掘出疾病潜在的临床干预靶点。
本研究通过横断T10 脊髓节段制备脊髓损伤后BND 模型[9],使用TMT 标记定量蛋白质组学技术检测T10~L2 脊髓节段的DEPs,再对这些DEPs 进行生物信息学分析,从而寻找新的生物标志物来指导治疗脊髓损伤后BND。
1 材料与方法
1.1 实验动物与分组
健康成年雌性SD 大鼠40 只,体质量250~280 g,由湖南中医药大学动物实验中心提供,合格证编号:1107271911006889。标准条件下(温度24~26 ℃,湿度50%~70%)分笼饲养于湖南中医药大学动物中心实验室,适应性喂养1 周。 40 只大鼠采用随机数字表法分为假手术组(12 只)和造模组(28 只),造模组大鼠采用Hassan Shaker 脊髓横断法[9]制备T10 脊髓损伤模型,脊髓休克期过后共存活25 只,其中13 只模型组大鼠出现尿潴留,采用随机数字表法抽取12只纳入模型组。
1.2 主要试剂与仪器
水合氯醛(国药集团化学试剂有限公司,批号:20131031);青霉素钠(哈药集团有限公司,80 万U/支,批号:H23021600);胰蛋白酶(上海嵘崴达科技公司,批号:11047841001);蛋白酶抑制剂(上海嵘崴达科技公司,批号:10109878001);BCA 蛋白质定量试剂盒(美国Thermo Scientific 公司,批号:QB214754);TMT10plexTM同量异序质量标签试剂盒(美国Thermo Scientific 公司,批号:90113CH);碘乙酰胺(美国SIGMA-ALDRICH 公司,批号:I1149);无水乙腈(美国SIGMA-ALDRICH 公司,批号:271004)。
MP-150 多通道生理记录仪(美国BIOPAC 公司,型号:MP150-WSW);微量注射泵(浙江史密斯医学仪器有限公司,型号:WZ-50C6);Q Exactive 质谱仪(美国Thermo Scientific 公司,型号:0726090);加热混合器(美国Thermo Scientific 公司,型号:13687711);酶标仪(美国Thermo Scientific 公司,型号:1425955)。
1.3 动物造模
大鼠造模前2 h 腹腔注射青霉素钠20 万U/只以抗炎。 用10%水合氯醛按30 mg/kg 腹腔麻醉,大鼠俯卧固定在鼠板上,以T13 椎体作为骨性标志,往上数至T8~T9 椎体处备皮、消毒,做2~3 cm的纵向切口,切开皮下组织,钝性分离两侧竖脊肌和棘突旁肌肉,暴露T8 和T9 的棘突和相邻椎弓。 用显微咬骨器咬除T8 椎板和两侧椎弓根,暴露脊髓,牙科弯钩勾出脊髓,11 号手术刀片横断,多次切断确保脊髓完全横断。 缝合肌肉,用5%聚维酮碘消毒切口及周围,缝合皮肤。
术后将大鼠放置恒温电热毯上直至苏醒,单笼饲养;术后1 周早晚各1 次腹腔注射青霉素钠(20万U/只);每天早、中、晚定时采用Crede 手法[10]辅助排尿;出现压疮、自残现象者用5%聚维酮碘消毒并在对应部位撒上青霉素粉。
对动物模型进行后肢运动功能评估(后肢不能参与行走,在前肢行走时处于拖动状态,BBB 评分[11]为0 分)和膀胱排尿功能评估(在脊髓休克期过后,膀胱持续处于尿潴留状态,膀胱胀大明显,不能自主排尿),同时符合这两个条件则造模成功。
假手术组大鼠常规饲养直至尿流动力学检测,期间不做其他处理。
1.4 观察指标及检测方法
造模后第19 天行尿流动力学检查[12],而后断头处死大鼠,取T10~L2 脊髓组织和膀胱颈备检,取3只大鼠的T10~L2 脊髓组织液氮冷冻用于TMT 蛋白质组学检测,剩余的膀胱颈组织和T10~L2 脊髓组织用于HE 染色。
1.4.1 尿流动力学检测 大鼠麻醉后进行膀胱灌注实验,导尿管插入膀胱顶后与膀胱水平放置,设置MP150 主机压力基线为零。 将F3 导尿管、MP150-WSW 型16 通道生理记录仪与WZ-50C6 微量注射泵通过三通管相连接。打开微量注射泵,灌注速度为6 mL/h,灌注的生理盐水温度为25~35 ℃。 观察并记录膀胱压力曲线的变化和漏尿情况:观察有无尿液从尿道口溢出,大鼠首次出现尿液溢出,此时记录的膀胱压力即为漏尿压(leak point pressure, LPP);最大膀胱容量(maximum cystometric capacity, MCC)则为从开始灌注生理盐水到尿液漏出尿道口所灌注液体的体积。 继续灌注出现稳定波形。
1.4.2 HE 染色 大鼠腹腔注射10%水合氯醛麻醉后剪开右心耳,用生理盐水从左心室快速灌注直至流出液体变清透后用4%多聚甲醛固定,取T10~L2脊髓组织和膀胱颈用4%多聚甲醛48 h 固定、乙醇梯度脱水、二甲苯透明、浸蜡、包埋、切片、脱蜡、苏木精和伊红染色、脱水和中性树胶封片后,光学显微镜下观察T10~L2 脊髓和膀胱颈的组织学变化。
1.5 TMT 蛋白组学分析
1.5.1 蛋白质样品制备 在10%水合氯醛麻醉下,提取大鼠T10~L2 脊髓组织。样品中各加入1000 μL 工作液(RIPA 裂解液与蛋白酶抑制剂混合,置于冰上预冷,得到工作液)充分混匀,冰浴超声5 min,充分溶解;14 000 r/min、4 ℃离心15 min,转移上清至新的EP 管中;使用BCA 蛋白测定试剂盒按照说明书要求定量测定蛋白浓度。
1.5.2 TMT 定量标记 每个样品取100 μL 上清液进行还原、烷基化、丙酮沉淀和蛋白重溶,得到相应样品的多肽,吸取20 μL 不同的TMT 溶液至对应样品中,混匀并离心,室温孵育1 h 后加入羟氨至100 mmol/L,室温孵育15 min 终止反应;将各组标记样品等量混合;去除脱氧胆酸钠(sodium deoxy cholate, SDC)后取上清至新EP 管,得到标记的多肽样品;经过多肽脱盐和RP-RP 分级和真空干燥后-80 ℃冻存,用于LC-MS/MS 分析。
1.5.3 蛋白质组学数据分析 经过LC-MS/MS 分析后得到的原始数据使用MaxQuant(version1.6.1.0)进行搜库和TMT 定量分析,蛋白质数据库为uniprot_rattus_20190711_iso,多肽和蛋白水平FDR<0.01。 随后对样品进行标准化,使各组样品总蛋白或中位数一致。将差异倍数(fold change, FC)>1.2 或<1/1.2,P<0.05,unique peptide≥2 的蛋白定义为DEPs,并对DEPs进行京都基因与基因组百科全书 (Kyoto encyclope dia of genes and genomes, KEGG)通路富集分析、蛋白质-蛋白质相互作用(protein-protein interaction,PPI)分析。
1.6 DEPs 的生物信息学分析
将DEPs 对应的基因名导入kobass 数据库(http://kobas.c bi.pku.edu.cn/)[13], 选择物种 Rattus.norvegicus,P<0.05 对DEPs 进行KEGG 分析。 利用STRING(https://string-db.org/)构建PPI 网络,下载tsv格式的分析结果并导入到Cytoscape 软件[14],对PPI做进一步可视化分析。 利用cytoHubba 插件[15]并根据DEPs 的度(Degree)值筛选出排名前35 位的关键DEPs,并通过GluGO 插件[16]对35 个关键DEPs 参与的生物过程进行分析。
1.7 统计学分析
采用SPSS 25.0 统计软件进行数据处理。 计量资料符合正态分布,以“±s”表示,满足正态性和方差齐性用t 检验,不满足则用Wilcoxon 检验。 以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
假手术组一般情况良好。 模型组大鼠脊髓休克期后后肢随意运动消失,爬行时处于拖动状态;膀胱胀大,可在下腹部触摸到“橄榄型”膀胱;大鼠下腹部和笼内垫料轻度潮湿,手法排尿时可感觉到尿道口有阻力。
2.2 尿流动力学结果
与假手术组相比,模型组LPP 和MCC 均明显增高(P<0.01)。 详见表1。
表1 大鼠膀胱LPP、MCC 比较(±s)

表1 大鼠膀胱LPP、MCC 比较(±s)
注:与假手术组相比,**P<0.01。
MCC/mL 0.36±0.08 4.68±0.44**组别假手术组模型组n 12 12 LPP/mmHg 18.05±1.64 49.78±2.68**
2.3 HE 染色结果
HE 染色显示,假手术组大鼠膀胱颈组织层次清晰,排列整齐紧密,无炎细胞浸润,部分区域有水肿改变;模型组膀胱颈组织中可见大量炎细胞浸润、弹性纤维减少,肌层可见肌纤维增粗、平滑肌壁增厚,详见图1。假手术组大鼠脊髓组织结构完整、清晰,未见坏死神经元;模型组脊髓组织结构破坏、排列紊乱,有神经元崩解现象,坏死后空洞增多,神经胶质细胞增生,详见图2。
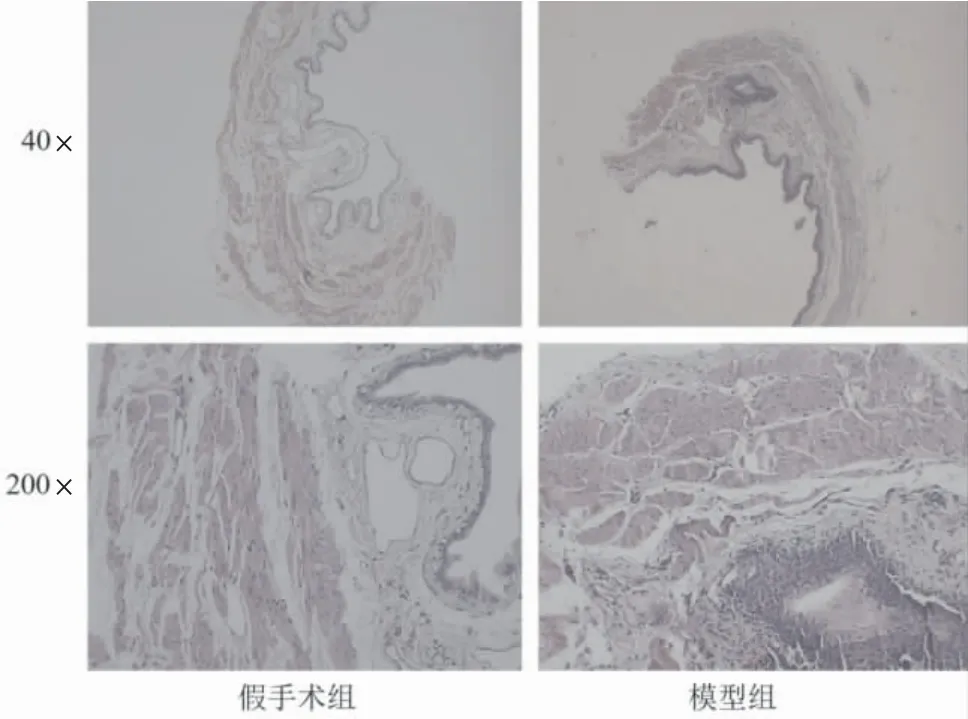
图1 各组大鼠膀胱颈组织病理形态学比较(HE 染色)
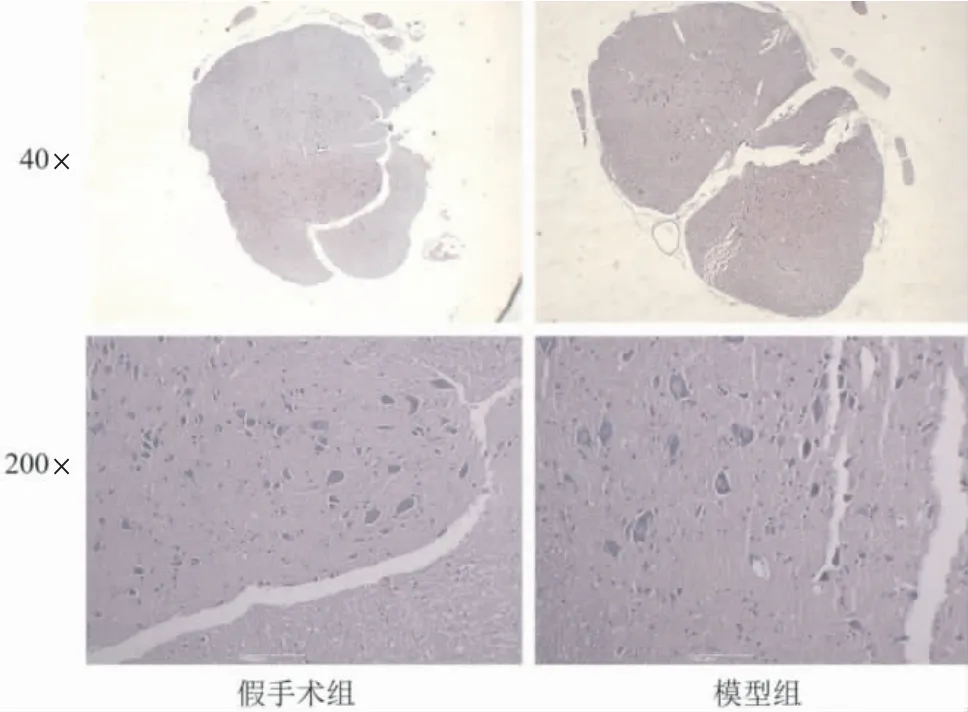
图2 各组大鼠T10~L2 脊髓组织病理形态学比较(HE 染色)
2.4 脊髓的TMT 定量蛋白质组学分析
采用TMT 定量蛋白质组学技术共检测到47 947个多肽,6684 个蛋白质,其中有3439 个可量化的蛋白质。 根据fc>1.2 或fc<1/1.2、P<0.05、unique peptide≥2 筛选出模型组与假手术组中T10~L2 脊髓组织的151 个DEPs,其中84 个表达升高、67 个表达下降,详见图3A。聚类分析直观地展示了DEPs 在假手术组和模型组之间的表达,详见图3B。
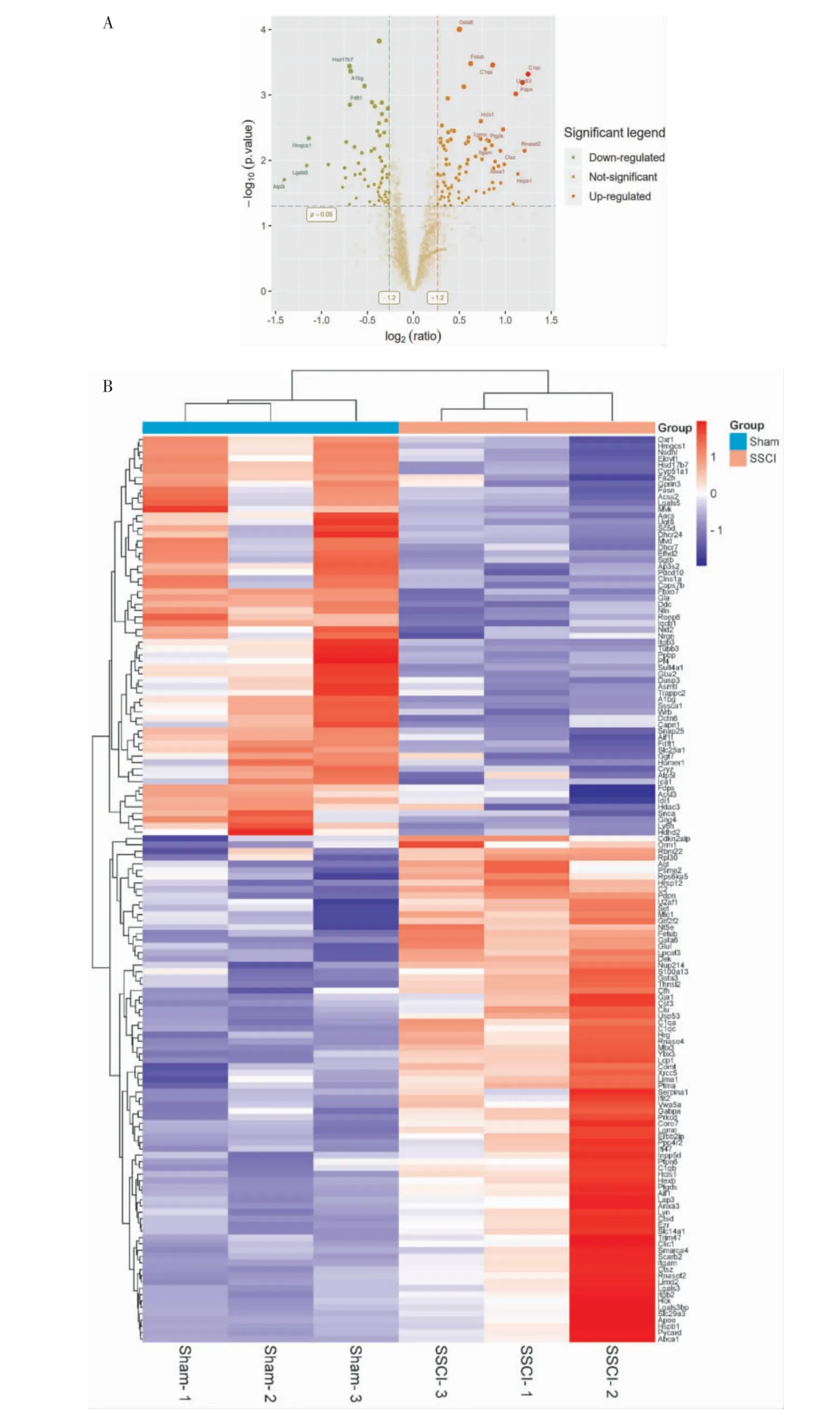
图3 151 个差异蛋白表达谱的火山图(A)和聚类分析结果图(B)
2.5 DEPs 的生物信息分析
2.5.1 DEPs 的KEGG 分析 使用KOBAS 3.0 对151 个DEPs 行KEGG 通路富集分析,设置P<0.01共筛选出前16 条KEGG 通路:肌动蛋白细胞骨架的调节、趋化因子信号通路、NOD-样受体信号通路、细胞坏死、细胞凋亡、多巴胺能神经突触和谷氨酸能突触等。 详见图4、表2。
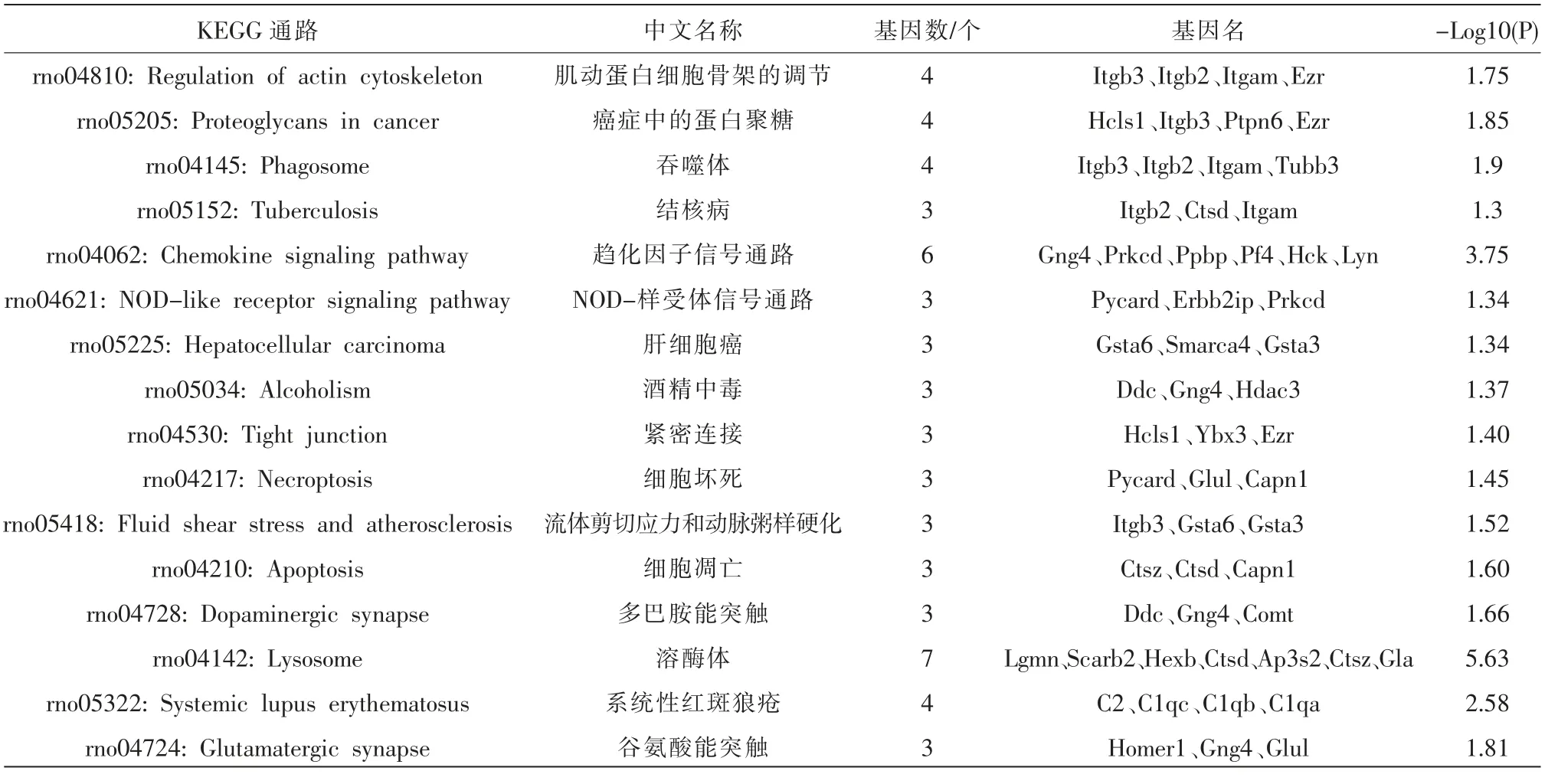
表2 151 个DEPs 的KEGG 通路分析结果
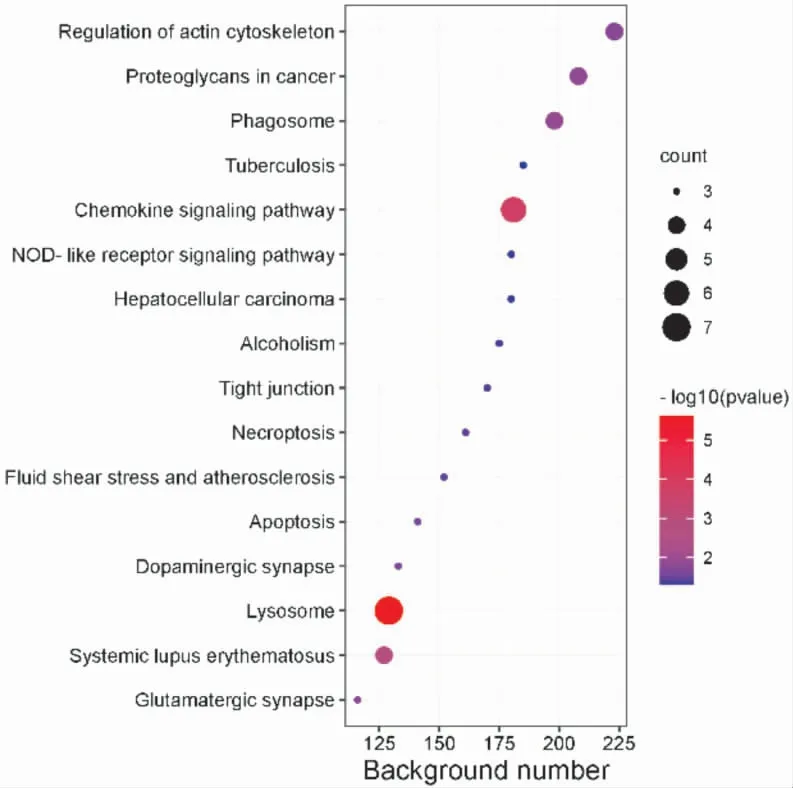
图4 151 个DEPs 的KEGG 通路分析结果
2.5.2 DEPs 的PPI 网络构建和关键靶点的筛选 采用STRING 数据库联合Cytoscape 软件构建151 个DEPs 的PPI 图。图中每个节点代表一个DEPs,去除无相互作用的DEPs,PPI 图中共有108 个节点和332 条边,详见图5。 使用cytoHubba 插件根据DEPs的Degree 值筛选出前35 位的关键DEPs, 详见图6A、表3。使用ClueGO 对35 个关键DEPs 参与的生物过程进行分析,发现35 个关键DEPs 主要参与了突触修剪、树突细胞分化、5-羟色胺运输、巨噬细胞活化、神经胶质细胞的激活、小胶质细胞的激活、神经炎症反应和活性氧代谢过程的正调控等生物学过程,详见图6B。

图6 35 个关键DEPs 的PPI 图(A)和参与的生物学过程(B)
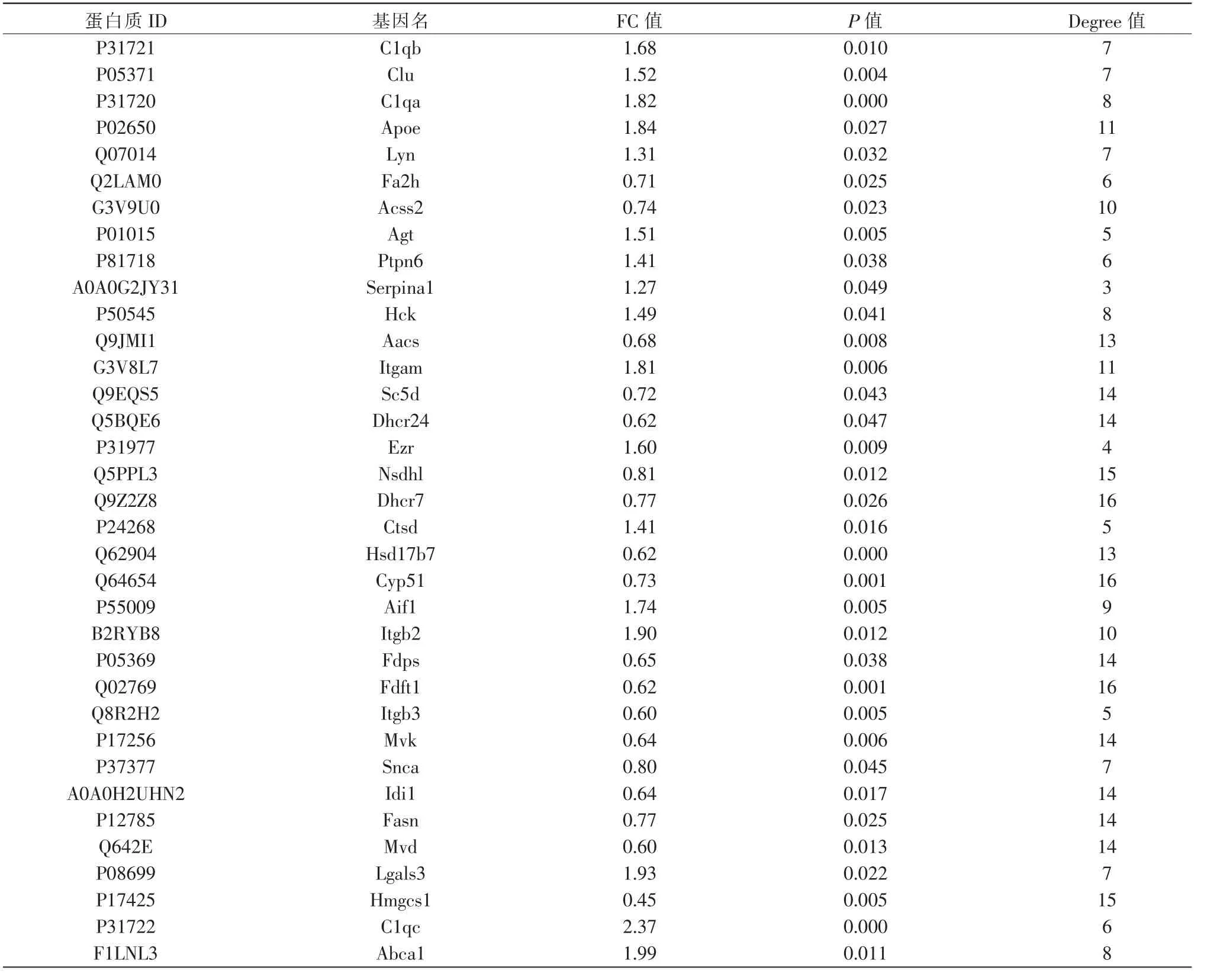
表3 35 个关键DEPs 的具体信息
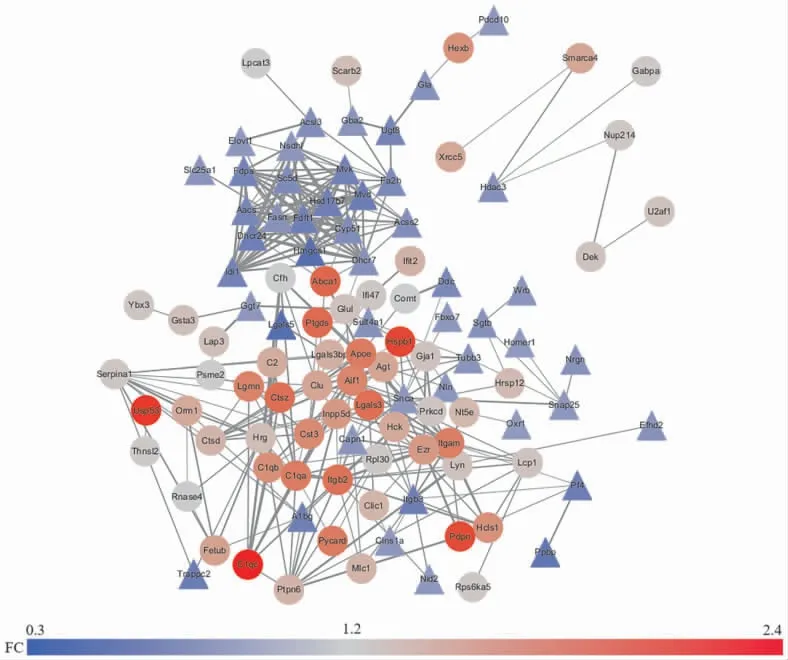
图5 DEPs 的PPI 图
3 讨论
BND 是T10 及以上脊髓损伤后临床干预的难点问题[17],其临床最大的危害在于排尿时,由于交感神经过度兴奋,膀胱括约肌持续收缩,膀胱内压持续升高,最终造成尿液反流和肾功能损伤[18]。
由于T10~L2 脊髓节段在排尿过程中有重要作用,临床上通常将其作为治疗BND 的目标靶位。因此,本研究团队制备了T10 脊髓节段横断性损伤后的BND 大鼠模型,选择T10~L2 脊髓节段作为本研究的观察对象。
本实验结果显示,模型组大鼠脊髓休克期过后BBB 评分为0 分;尿流动力学结果发现,较假手术组相比,模型组大鼠MCC 和LPP 均增大(P<0.01);HE 染色结果显示,模型组大鼠T10~L2 脊髓组织有神经元崩解现象、坏死后空洞增多、神经胶质细胞增生,模型组大鼠膀胱颈组织大量炎细胞浸润、弹性纤维减少,肌层可见肌纤维增粗、平滑肌壁增厚。 以上结果提示,通过横断T10 脊髓节段能够形成BND 大鼠模型。
利用TMT 定量标记技术筛选出模型组/假手术组的151 个DEPs,通过KEGG 分析挖掘出151 个DEPs 之间潜在的相互作用关系,结果发现富集到的KEGG 通路主要参与了炎症反应(趋化因子信号通路和NOD-样受体信号通路)、凋亡(细胞坏死和细胞凋亡)和突触传递(多巴胺能突触和谷氨酸能突触)。 利用Cytoscape 及其插件对151 个DEPs 进行可视化分析,筛选出了Lgals3、Apoe、Dhcr24、Snca 等35 个关键DEPs,利用ClueGO 对35 个DEPs 参与的生物过程进行注释来展示单个DEPs 的功能,结果发现35 个DEPs 主要参与了突触修剪、5-羟色胺运输、巨噬细胞活化、神经炎症反应、神经胶质细胞的激活和小胶质细胞的激活等生物过程。
脊髓损伤后周围炎细胞的浸润、星形胶质细胞和小胶质细胞的激活是引起脊髓继发性损伤的主要原因之一[19]。其中,被激活的小胶质细胞和星形胶质细胞释放多种氧化应激调节因子、趋化因子和炎症介质从而介导炎症反应[20]。有研究表明,在中枢神经系统中胶质细胞介导的慢性炎症会使神经组织损伤进一步加重,从而引起神经元损伤和脱髓鞘等病理改变[21]。 目前,针对炎症反应治疗继发性脊髓损伤,主要通过靶向CD11d/CD18 或α4β1 整合素的抗体来减少小胶质细胞/巨噬细胞的活化,最终减少脊髓组织的炎性损伤[20]。 本研究中对151 个DEPs 进行KEGG 分析,发现趋化因子信号通路和NOD-样受体信号通路等炎症相关途径显著富集。 此外,35 个关键DEPs 的生物过程分析结果发现,C1qa、Clu、Snca 主要参与了巨噬细胞活化、神经炎症反应、神经胶质细胞激活和小胶质细胞激活等生物过程。 因此,本次生物信息分析富集到的C1qa、Clu 和Snca可能是抑制脊髓炎性损伤的潜在治疗靶点。
此外,本次KEGG 分析富集到了细胞坏死和细胞凋亡两条信号通路。 151 个DEPs 中Pycard、Glul、Capn1 参与了细胞坏死通路,其中:Pycard 泛素化可以促进白细胞介素-1β 活化,加重组织的炎症反应,最终导致细胞坏死和凋亡[22];Glul 编码的谷氨酰胺合成酶活性的升高会增加活性氧(reactive oxygen species, ROS)的产生,最终导致脂质过氧化和细胞坏死[23];Capn1 通过激活半胱天冬酶-3 触发神经元细胞坏死和凋亡[24]。 此外,151 个DEPs 中Ctsz 和Ctsd参与了细胞凋亡途径,Ctsz 和Ctsd 编码的溶酶体半胱氨酸蛋白酶家族可通过降解BCL-2 蛋白从而启动细胞凋亡过程[25]。 细胞坏死和凋亡是脊髓继发性损伤的重要原因[26],因此,从抑制细胞坏死和凋亡的角度出发寻找潜在靶点是减轻脊髓继发性损伤的治疗思路之一。
在T10~L2 脊髓组织的KEGG 分析结果中,多巴胺能突触和谷氨酸能突触两条信号通路显著富集。 多巴胺(dopamine, DA)和谷氨酸是中枢神经系统中常见的神经递质, 二者在控制膀胱的排尿过程中发挥着重要作用[27-28]。 研究发现,在脊髓中存在能产生内源性DA 的多巴胺能神经元,在T10 脊髓完全横断后,脊髓中的多巴胺能神经元合成DA 的能力增强,脊髓中依然能够检测到内源性DA[29]。 已有研究发现,通过鞘内注射DA 信号药物可以改善脊髓损伤后逼尿肌-外括约肌协同失调型膀胱的排尿功能[30],而脊髓交感神经中枢中的DA 可以调节膀胱颈的功能[31]。本研究发现,参与多巴胺能突触通路中的Comt 在模型组脊髓中显著升高,Ddc 显著降低。 研究表明,Comt 具有降解DA 的功能[32],Ddc能加速DA 的合成[33]。 因此,多巴胺能突触以及参与该条信号通路的Ddc 和Comt 可能是治疗脊髓损伤后BND 的潜在治疗靶点。
谷氨酸是影响膀胱排尿的主要兴奋性神经递质,其通过与突触后膜上的谷氨酸受体结合促进排尿反射[34]。已有研究表明,腰骶脊髓节段副交感神经区的谷氨酸可激活膀胱逼尿肌从而促进膀胱排尿,目前,谷氨酸受体拮抗剂类药物已运用于膀胱逼尿肌过度活动的治疗中[35]。有研究发现,胸段脊髓交感神经区仍然有谷氨酸能突触[36],在谷氨酸能突触中,Gng4 可抑制突触前膜释放谷氨酸,从而降低突触间隙的谷氨酸浓度[37],而Homer1 有助于突触后膜上的代谢型谷氨酸受体与钙离子示释放偶联,从而发挥谷氨酸能突触作用[38]。 本次实验的KEGG 分析结果发现,谷氨酸能突触显著富集,此外151 个DEPs中,Homer1、Gng4 参与了该信号通路,相比于假手术组,模型组脊髓组织中Homer1 和Gng4 的表达显著下降。 这说明在T10 脊髓损伤后,由于Gng4 表达下降,T10~L2 脊髓组织中谷氨酸的释放增加,但由于Homer1 的表达明显下降,导致谷氨酸能突触不能发挥正常的生物学作用,这可能是T10脊髓损伤后出现下尿路功能障碍的原因之一。 目前,对于交感神经中的谷氨酸能突触是否能对膀胱颈的活动产生作用尚未有报道,因此从谷氨酸能突触的角度展开进一步研究对治疗T10 脊髓损伤后BND 是有意义的。
综上所述,C1qa、Clu、Snca、Pycard、Glul、Capn1、Ctsz 和Ctsd 可能是减轻T10 脊髓损伤后T10~L2 脊髓组织的炎症反应、保护神经细胞、降低脊髓继发性损伤风险的潜在治疗靶点;脊髓组织中DA 和谷氨酸的含量及相关受体的活性也可能是治疗T10 脊髓损伤后BND 的新思路。 本研究通过TMT 定量蛋白质组学技术筛选出了T10 脊髓节段损伤后T10~L2 脊髓组织的DEPs,然而并未对筛选出的潜在治疗靶点进行验证。 接下来,将会对筛选出来的DEPs展开验证工作,进一步探讨这些潜在靶点对T10~L2 脊髓组织及脊髓损伤后BND 起到的治疗作用。

