补肾益志方通过β 淀粉样蛋白和tau 蛋白调节大鼠阿尔茨海默病的实验研究
曹颖颖,张绍兰,杨 楠,李 青,李 红,王雪佼*
(昆明市中医医院,云南 昆明 650011)
认知障碍(cognitive impairment, CI)是指记忆、语言、视觉空间、行动、理解和判断等功能中的一个或多个方面存在障碍[1-2]。60%以上的CI 患有阿尔茨海默病(Alzheimer's disease, AD)[3]。 随着中国人口步入老龄化,AD 患者日益增多,但目前尚缺乏有效的治疗方法。 大量临床研究证实,中药可以改善AD患者的认知功能、情感状态,延缓β 淀粉样蛋白(βamyloid protein, Aβ)和tau 蛋白的病变,调节胆碱能神经递质的代谢,提高患者的生活质量[4-6]。 云南省名中医李青主任医师继承了明清以来医家对“痴呆”的认识,结合自身临床经验,提出了“痴呆从肾虚血瘀论治”的学术思想,认为老年人肾中精气亏虚、脑髓失充,同时又因年老体衰、正气不足、血运无力而致气血痰瘀互结,上犯颠顶,蒙蔽清窍,导致头脑灵性渐失,而成本病[7-8]。 本病病位在脑,病性为本虚标实、虚实夹杂,病理机制以肾气亏虚、肾精不足为本,以瘀血阻络、痰浊蒙窍为标,而益气补肾、活血益志为本病的基本治疗原则[9]。 补肾益志方理论上有助于本病的治疗,但是其发挥作用的机制尚不清楚。在长期的临床实践中,补肾益志方对AD 的认知功能改善的疗效得到很多患者的认可,但是其发挥治疗作用的具体作用机制尚有待进一步确定。 本研究旨在探索补肾益志方对AD 大鼠认知功能的影响及其与Aβ、tau 蛋白之间的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物 60 只12 月龄SPF 级SD 雌性大鼠,体质量230~280 g,购自北京维通利华实验动物中心,许可证号: SCXK(京)2020-0035。
1.1.2 主要药物、试剂与仪器 补肾益志方(何首乌15 g,黄精15 g,黄芪30 g,山茱萸15 g,熟地黄15 g,五味子15 g,当归15 g,丹参15 g,赤芍15 g)由本院制剂室提供。盐酸多奈哌齐片(重庆植恩药业有限公司,国药准字:H20010723,批号:HD008003,规格:5 mg×7 片);Aβ25-35(美国Sigma 公司,货号:131602-53-4);HE 染色试剂盒(上海碧云天生物技术有限公司,货号:C0105S);Aβ40 检测试剂盒(上海酶联生物科技有限公司,货号:ml003106);Aβ42 检测试剂盒(上海恒远生物科技有限公司,货号:H-11672);p-tau 蛋白ELISA 试剂盒(上海江莱生物科技有限公司,货号:JL46213-96T);兔抗Aβ40 多克隆抗体(货号:tcea11340)、HRP 标记的二抗(货号:C0151)均购自美国Cell Signaling Technology 公司;兔抗Aβ42多克隆抗体(英国Biorbyt 公司,货号:orb593224);兔抗p-tau 单克隆抗体 (美国Invitrogen 公司, 货号:MN1020)。 Morris 水迷宫实验系统(武汉一鸿科技公司,型号:YH-WM-M/R);凝胶成像系统(美国Bio Rad 公司,型号:DocTMXR+1708195)。
1.2 方法
1.2.1 分组与处理 将所有大鼠足料足水,适应性饲养1 周。随机分为6 组,每组10 只,分别标记为假手术组、模型组、补肾益志方低剂量组、补肾益志方中剂量组、补肾益志方高剂量组、阳性组。 除假手术组外,其余大鼠均进行AD 模型制造[10]。
大鼠AD 模型的制造方法:麻醉后的大鼠左右两侧的侧脑各注射5 μL 的Aβ25-35,留针3 min。结束后进行消炎,连续肌内注射青霉素3 d。 进行Morris 水迷宫实验和自主活动时间监测,造模组大鼠的逃避潜伏期、目标象限游泳时间、游泳总路程和自主活动时间均明显延长,则说明建模成功[11]。
给药方案:建模后,补肾益志方低、中、高剂量组分别采用补肾益志方(13.00、6.50、3.25 g/kg)每日灌胃给药1 次,连续60 d;阳性组采用多奈哌齐(10 mg/kg)灌胃,1 d/次,连续60 d;假手术组、模型组均每日灌胃等剂量的生理盐水,连续60 d。
戊巴比妥钠麻醉大鼠,眼眶静脉采血(-20 ℃保存备用),断颈法处死,剥离海马组织,液氮保存或4%多聚甲醛溶液浸泡。
1.2.2 Morris 水迷宫实验[12]大鼠末次给药的次日进行学习训练。 使用Morris 水迷宫实验系统对大鼠进行适应性学习,每天4 次(间隔至少20 min),连续训练5 d。第6 日开始记录大鼠的逃避潜伏期、目标象限游泳时间、游泳总路程,每组大鼠按照同样的方法测试,并记录成绩,取平均值。
1.2.3 自主活动时间检测[13]各组大鼠在末次给药后,用自主活动记录仪监测大鼠5 min 的自主活动情况。监测的前5 min 不记录,为大鼠适应时间。 后5 min 开始记录大鼠的活动时间,取平均值。自主活动的区域包括中央区、周边区、总区域。 自主活动包括大鼠的卫生清理、站立、采食饮水等。
1.2.4 HE 染色观察大鼠海马组织 取出4%多聚甲醛固定24 h 的海马组织,用浓度梯度的乙醇(30%、50%、70%、80%、90%、95%、100%) 脱水,二甲苯作透明剂置换出组织中的乙醇,再用溶化的石蜡包埋组织块,待蜡块冷却固定,用于切片、展片、脱蜡、染色。染色过程按照HE 染色试剂盒说明书要求操作,染色后用乙醇脱水,二甲苯透明,最后用树脂胶封固切片,显微镜下观察。
1.2.5 ELISA 法检测大鼠血清中Aβ40、Aβ42、p-tau的含量 将采集的新鲜大鼠血浆,3000 r/min 离心3 min(离心半径3 cm),取血清做样本,严格按照ELISA 试剂盒使用说明书操作要求操作,测定血清样本Aβ40、Aβ42、p-tau 的含量。
1.2.6 Western blot 法检测海马组织Aβ40、Aβ42、p-tau 蛋白 将无菌研磨的海马组织用RIPA 裂解
液充分裂解,提取总蛋白。 使用BCA 定量试剂盒测定蛋白浓度,沸水浴煮沸10 min 对蛋白进行变性。用变性后的蛋白上清进行SDS-PAGE 蛋白电泳上样。将胶上的蛋白用转膜仪湿转至NC 膜,并用含有2.5%脱脂奶粉的封闭液室温封闭处理2 h。洗膜后,滴加稀释的一抗溶液(兔抗Aβ40 多克隆抗体、兔抗Aβ42 多克隆抗体、兔抗p-tau 单克隆抗体,稀释比例均为1∶1000),4 ℃孵育过夜。洗膜,滴加稀释的二抗溶液(HRP 标记的二抗,稀释比例为1∶500),于37 ℃,孵育2 h。洗膜,滴加ECL 发光液显影,曝光。用目的条带的灰度值与内参GAPDH 条带的灰度值之间的比值表示目的蛋白的表达情况。
1.2.7 统计学处理 实验中的数据均使用统计学专用软件SPSS 22.0 进行统计分析,计量资料使用“±s”表示。 3 组以上的数据之间的比较使用单因素方差分析,组内两两比较采用LSD-t 检验。 P<0.05 表示差异具有统计学意义。
2 结果
2.1 补肾益志方对AD 大鼠学习记忆能力的影响
与假手术组相比,模型组大鼠逃避潜伏期、目标象限游泳时间、游泳总路程均显著升高(P<0.05);与模型组相比,补肾益志方低、中、高剂量组及阳性组大鼠逃避潜伏期、目标象限游泳时间、游泳总路程均显著降低(P<0.05);与补肾益志方低剂量组相比,补肾益志方中、高剂量组及阳性组大鼠逃避潜伏期、游泳总路程均显著降低(P<0.05),补肾益志方高剂量组及阳性组大鼠目标象限游泳时间显著降低(P<0.05);补肾益志方中、高剂量组及阳性组大鼠逃避潜伏期、目标象限游泳时间、游泳总路程比较,差异无统计学意义(P>0.05)。 详见表1。
表1 各组大鼠逃避潜伏期、目标象限游泳时间和总路程比较(±s,n=10)
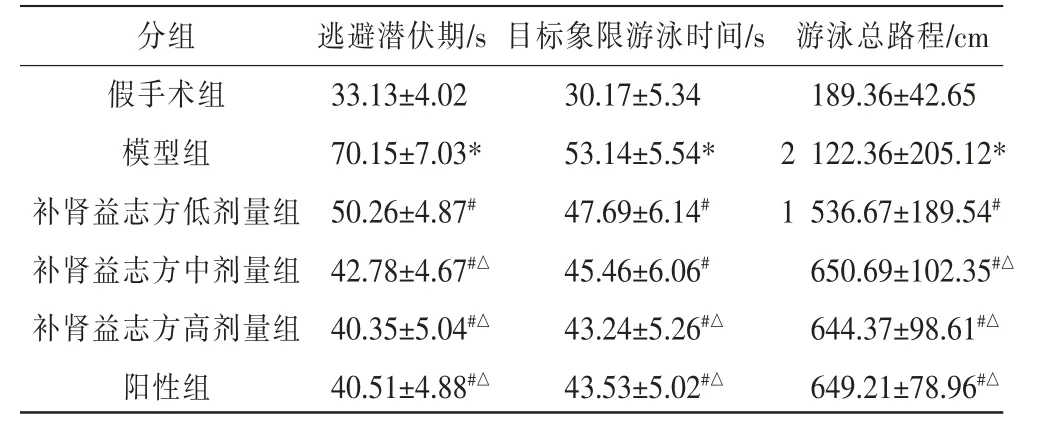
表1 各组大鼠逃避潜伏期、目标象限游泳时间和总路程比较(±s,n=10)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与补肾益志方低剂量组比较,△P<0.05。
分组假手术组模型组补肾益志方低剂量组补肾益志方中剂量组补肾益志方高剂量组阳性组逃避潜伏期/s 33.13±4.02 70.15±7.03*50.26±4.87#42.78±4.67#△40.35±5.04#△40.51±4.88#△目标象限游泳时间/s 30.17±5.34 53.14±5.54*47.69±6.14#45.46±6.06#43.24±5.26#△43.53±5.02#△游泳总路程/cm 189.36±42.65 2 122.36±205.12*1 536.67±189.54#650.69±102.35#△644.37±98.61#△649.21±78.96#△
2.2 补肾益志方对AD 大鼠自主活动时间的影响
与假手术组相比,模型组大鼠自主活动时间显著升高(P<0.05);与模型组相比,补肾益志方低、中、高剂量组及阳性组大鼠自主活动时间均显著降低(P<0.05);与补肾益志方低剂量组相比,补肾益志方中、高剂量组及阳性组大鼠自主活动时间均显著降低(P<0.05);补肾益志方中、高剂量组及阳性组大鼠自主活动时间比较,差异无统计学意义(P>0.05)。 详见表2。
表2 各组大鼠自主活动时间比较(±s,n=10)
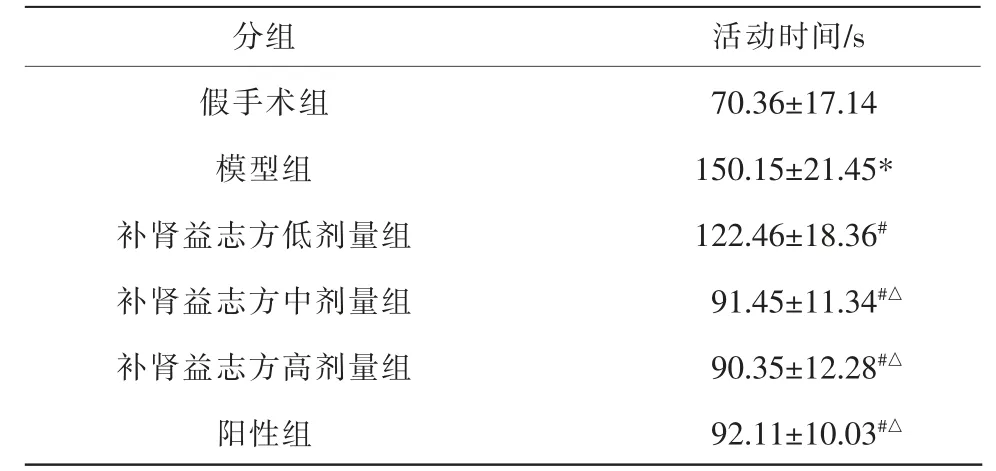
表2 各组大鼠自主活动时间比较(±s,n=10)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与补肾益志方低剂量组比较,△P<0.05。
分组假手术组模型组补肾益志方低剂量组补肾益志方中剂量组补肾益志方高剂量组阳性组活动时间/s 70.36±17.14 150.15±21.45*122.46±18.36#91.45±11.34#△90.35±12.28#△92.11±10.03#△
2.3 补肾益志方对AD 大鼠海马组织的影响
假手术组大鼠海马组织神经元排列紧密、规则;模型组大鼠海马组织神经元数量稀少,排列疏松,呈现空泡样变;补肾益志方低、中、高剂量组大鼠海马组织神经元排列紧密,补肾益志方高剂量组、阳性组大鼠海马组织神经元最接近假手术组。 详见图1。
2.4 补肾益志方对AD 大鼠血清中Aβ40、Aβ42、ptau 含量的影响
与假手术组相比,模型组大鼠血清中Aβ40、Aβ42、p-tau 的含量均显著升高(P<0.05);与模型组相比,补肾益志方低、中、高剂量组及阳性组大鼠血清中Aβ40、Aβ42、p-tau 的含量均显著降低 (P<0.05);与补肾益志方低剂量组相比,补肾益志方中、高剂量组及阳性组大鼠血清中Aβ40、Aβ42、p-tau的含量均显著降低(P<0.05);补肾益志方中、高剂量组及阳性组大鼠血清Aβ40、Aβ42、p-tau 的含量比较,差异无统计学意义(P>0.05)。 详见表3。
表3 各组大鼠血清中Aβ40、Aβ42、p-tau 含量比较(±s,n=9)
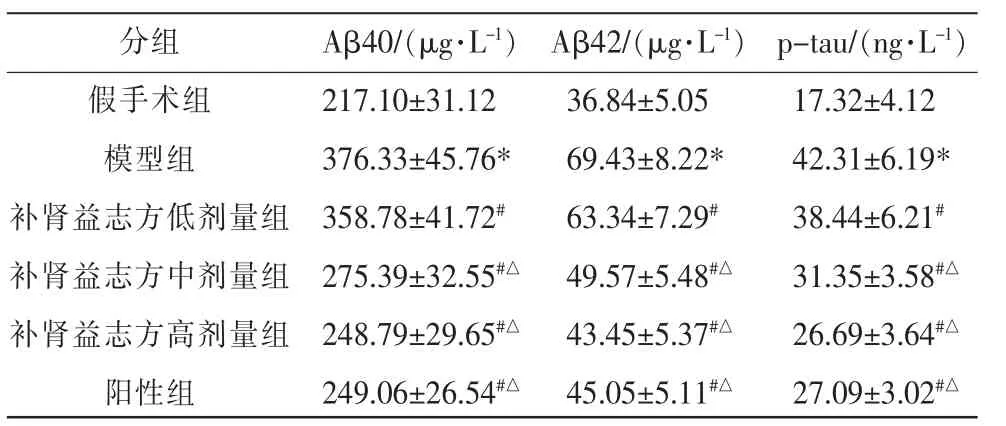
表3 各组大鼠血清中Aβ40、Aβ42、p-tau 含量比较(±s,n=9)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与补肾益志方低剂量组比较,△P<0.05。
分组假手术组模型组补肾益志方低剂量组补肾益志方中剂量组补肾益志方高剂量组阳性组Aβ40/(μg·L-1)217.10±31.12 376.33±45.76*358.78±41.72#275.39±32.55#△248.79±29.65#△249.06±26.54#△Aβ42/(μg·L-1)36.84±5.05 69.43±8.22*63.34±7.29#49.57±5.48#△43.45±5.37#△45.05±5.11#△p-tau/(ng·L-1)17.32±4.12 42.31±6.19*38.44±6.21#31.35±3.58#△26.69±3.64#△27.09±3.02#△
2.5 补肾益志方对AD 大鼠海马组织Aβ40、Aβ42、p-tau 蛋白表达量的影响
与假手术组相比,模型组大鼠海马组织Aβ40、Aβ42、p-tau 的蛋白表达量均显著升高(P<0.05);与模型组相比,补肾益志方低、中、高剂量组及阳性组大鼠海马组织Aβ40、Aβ42、p-tau 的蛋白表达量均显著降低(P<0.05);与补肾益志方低剂量组相比,补肾益志方中、高剂量组及阳性组大鼠海马组织Aβ40、Aβ42、p-tau 蛋白表达量均显著降低(P<0.05);补肾益志方中、高剂量组及阳性组大鼠海马组织Aβ40、Aβ42、p-tau 的蛋白表达量比较,差异无统计学意义(P>0.05)。 详见图2、表4。
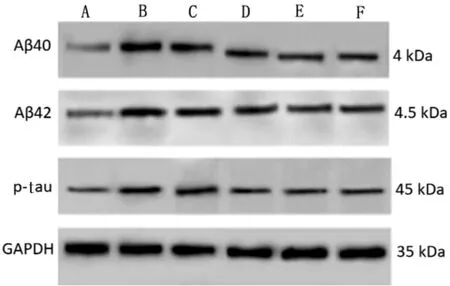
图2 各组大鼠海马组织Aβ40、Aβ42、p-tau 的蛋白条带图
表4 各组大鼠海马组织Aβ40、Aβ42、p-tau 蛋白表达量比较(±s,n=4)

表4 各组大鼠海马组织Aβ40、Aβ42、p-tau 蛋白表达量比较(±s,n=4)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与补肾益志方低剂量组比较,△P<0.05。
分组假手术组模型组补肾益志方低剂量组补肾益志方中剂量组补肾益志方高剂量组阳性组Aβ40 0.24±0.04 0.74±0.09*0.66±0.06#0.34±0.06#△0.29±0.04#△0.34±0.06#△Aβ42 0.33±0.05 0.65±0.03*0.49±0.06#0.41±0.06#△0.40±0.04#△0.48±0.05#△p-tau 0.17±0.04 0.42±0.05*0.35±0.06#0.23±0.05#△0.21±0.04#△0.27±0.06#△
3 讨论
据报道,山茱萸环烯醚萜苷对APP/PSI/tau 三转基因诱导的AD 老年小鼠具有十分显著的认知功能改善作用,并促进脑内突触相关蛋白的表达[14]。何首乌二苯乙烯苷和黄精对CI 均有治疗功效。在治疗CI 的处方中,当归、赤芍也是广泛使用的中药组合,有研究表明,当归芍药散用于治疗AD 等神经退行性疾病也具有较好的功效[15]。LIN 等[16]在对83 位AD患者的研究中报道,使用调补心肾方治疗后,患者痴呆综合征评分较对照组明显降低,临床上初步验证了中药复方制剂改善AD 患者CI 的有效性。 本研究所用补肾益智方在临床上给很多患者带来福音,但是其发挥作用的具体机制及药物成分尚不清楚。本研究建立了AD 大鼠模型,观察大鼠的学习记忆能力变化发现,模型组大鼠的逃避潜伏期、目标象限游泳时间、游泳总路程和自主活动时间都明显延长,说明建模成功。 而经过补肾益志方给药治疗后,大鼠的上述指标均明显降低,趋向假手术组,再次验证了补肾益志方对AD 患者的治疗价值。通过HE 染色观察大鼠海马组织发现,不同剂量补肾益志方治疗的大鼠海马组织都有不同程度的改善,并且补肾益志方高剂量组大鼠的海马组织恢复得最好。Aβ蛋白及tau 蛋白作为AD 的明星因子,猜测其有可能参与补肾益志方的药理作用机制。
AD 是一种进行性神经退行性疾病,其特征是记忆丧失和多种认知障碍[17-19]。 几十年的深入研究表明,多种细胞变化与AD 的发展有关,包括线粒体损伤、突触功能障碍、Aβ 和p-tau 的形成和积累[20]。最近大量研究表明,Aβ 和p-tau 诱导的缺陷性自噬和丝裂吞噬是AD 发病机制中的突出变化,并且Aβ 和p-tau 水平随年龄的增加而升高[21]。 多年来,普遍认可的AD 发病机制为Aβ 的沉积会加速疾病进程,并引发级联的有害反应,如tau 病理和神经退行性变[22]。有研究报道,基于调补心肾理论的益气补肾活血方对临床180 位老年轻度CI 患者有治疗作用,通过Western blot 法检测发现,治疗后患者血清中tau 蛋白的表达明显受到抑制[23]。 本研究通过ELISA法和Western blot法检测了大鼠海马中Aβ40、Aβ42、p-tau 的表达,发现补肾益志方给药的大鼠海马中Aβ40、Aβ42、p-tau 的表达均明显下降,且补肾益志方高剂量组大鼠海马最接近假手术组大鼠,说明补肾益志方有助于改善AD 患者认知功能,可能与抑制Aβ40、Aβ42、p-tau 相关。
综上所述,补肾益志方可减轻AD 大鼠的认知功能损害,其作用机制与抑制Aβ、p-tau 表达有关,为补肾益志方在AD 患者中的临床应用奠定了理论基础。

