5,5-二甲基乙内酰脲在化学镀铜中的作用
郑安妮,金 磊,杨家强,王赵云,李威青,杨防祖,詹东平,田中群
(厦门大学化学化工学院,固体表面物理化学国家重点实验室,厦门 361005)
非导电材料表面金属化方式(如喷涂导电涂料、真空沉积、金属溅射、火焰和电弧喷涂、化学气相沉积、化学镀等[1~3])众多. 化学镀铜是非导电材料(如塑料等)表面金属化处理的常用工艺之一[4~7]. 由丙烯腈-苯乙烯连续相和丁二烯分散相构成的热塑性塑料(ABS 塑料)是一种常用的非导电材料. 在ABS 塑料金属化表面处理过程中,通过溶解丁二烯结点,可使ABS 与金属镀层之间具有良好的结合力. 因此,ABS塑料表面金属化在电子、石油、汽车、日常家居和国防等领域具有广泛应用[8~11].
化学镀铜液主要有甲醛[12~15]、乙醛酸[16~18]和次磷酸钠[19~21]体系. 其中,以甲醛化学镀铜最为常用.以酒石酸钾钠(NaKC4H4O6·4H2O)和乙二胺四乙酸二钠(Na2EDTA·2H2O)为双配位剂,甲醛为还原剂的化学镀铜是常用的工艺之一. 在含有还原剂甲醛和氧化剂二价铜配位离子的热力学不稳定化学镀铜溶液中,甲醛在具有催化活性的基底表面发生氧化反应,而铜配位离子同时在基底表面发生还原沉积反应. 由于二价铜配位离子的还原过程中经历一价铜的中间过程,一价铜可能发生歧化反应(2Cu+==Cu2++Cu);一价铜也可能水解生成氧化亚铜(2Cu++2OH-==Cu2O+H2O). 镀液中产生的Cu 和Cu2O 微小颗粒表面,因具有催化活性而引发化学镀铜反应,从而导致镀液稳定性降低或分解[22,23]. 此外,Cu和Cu2O微小颗粒可能复合共沉积于铜镀层中,影响镀层的延展性和导电性等[24]. 甲醛化学镀铜研究已多有报道[25~28]. Jin等[29]采用紫外光照射聚萘二甲酸乙二醇酯(PEN)基片,采用甲醛化学镀铜体系,得到电阻率为5.063×10-2Ω·mm2/m 的铜平行板电极. Wang 等[15]研究了硫酸铜和甲醛的浓度以及溶液pH 值对Al2O3颗粒表面铜镀层均匀性的影响;扫描电子显微镜(SEM)、X 射线衍射(XRD)和沉积速率实验结果表明,当硫酸铜含量为30 g/L,甲醛浓度为24 ml/L,溶液pH为11.5~12.5时,得到细小、均匀的铜包覆Al2O3复合粉末. 溶液pH小于11时,化学镀铜反应难以发生;溶液pH为11.5~12.5时,引发化学镀铜反应的起镀时间为10~20 min;pH高于12.5时,起镀时间缩短,析氢副反应更加剧烈,将导致镀液分解. 针对镀液稳定性问题,Lu等[22]在开展甲醛化学镀铜研究中指出,含有离域π键结构的分子能与Cu+发生络合作用,抑制铜粉和Cu2O微小颗粒的产生,增加镀液的稳定性.
5,5-二甲基乙内酰脲(DMH)含有极性的N-杂环,具有较强的给电子能力和较低的吸附能量,能络合二价铜离子[30~33],还含有离域π键,能与Cu+发生配位作用,可望提高甲醛化学镀铜镀液的稳定性并细化镀层晶粒[34]. 基于此,本文采用扫描电子显微镜表征了镀层铜颗粒的形态和大小,采用紫光-可见光谱研究了DMH与Cu(II)之间的配位作用,采用线性伏安法研究了DMH对甲醛氧化和Cu(II)配位离子还原过程的影响,采用X射线衍射研究了镀层的结构,阐明了DMH在化学镀铜中的作用.
1 实验部分
1.1 试剂与仪器
ABS基材购自厦门建霖健康家居股份有限公司;CuSO4·5H2O、Na2EDTA·2H2O、NaKC4H4O6·4H2O、NaOH、Na2CO3、Na3PO4·12H2O、SnCl2·2H2O、Na2Cr2O7、AgNO3、氨水、OP-乳化剂、HCHO、HCl和H2SO4均为分析纯,购自国药化学试剂有限公司;5,5-二甲基乙内酰脲(DMH)、K4Fe(CN)6和2,2′-联吡啶均为分析纯,购自阿拉丁(中国)有限公司.
760e型CHI电化学工作站(上海辰华仪器有限公司),采用三电极体系,以直径为2 mm的铜电极为工作电极,面积为1 cm2的铂片电极为辅助电极,Hg/HgO(1 mol/L KOH)为参比电极. 实验在化学镀铜基础液中进行. 对于甲醛阳极氧化的线性伏安实验,起始电势为该溶液体系的开路电位,终止电势为-0.2 V,扫描速率为20 mV/s;对于铜配位离子的阴极还原线性伏安实验,起始电势为该溶液体系的开路电位,终止电势为-1.3 V,扫描速率为20 mV/s. HITACHI S-4800型扫描电子显微镜(SEM,日本日立公司),实验条件:加速电压15 kV,放大倍数20 kX. SmartLab-SE 型X 射线衍射仪(XRD,日本理学公司),实验条件:狭缝10 nm,电流15 mA,2θ=30°~100°,扫描速率10°/min. Cary 5000型紫外-可见分光光度计(UV-Vis,美国安捷伦公司),实验条件:扫描速率200 nm/min,扫描范围400~800 nm.
1.2 实验过程
将ABS 基材浸入65 ℃除油液中除油10 min 后,用去离子水清洗;然后浸入65 ℃粗化液中粗化25 min后,用去离子水清洗;再浸入45 ℃敏化液中敏化处理10 min后,用去离子水清洗;再浸入45 ℃活化液中活化处理10 min后,用去离子水清洗;最后浸入50 ℃化学镀铜液中金属化处理40 min.
除油液由50 g/L Na2CO3、50 g/L Na3PO4·12H2O、10 g/L NaOH 和1.5 mL/L OP-乳化剂组成;粗化液由20 g/L Na2Cr2O7和150 mL/L H2SO4组成;敏化液由20 g/L SnCl2·2H2O 和50 mL/L HCl 组成;活化液为向2 g/L AgNO3中逐滴加入氨水,直至沉淀消失得到[Ag(NH3)2]+的透明溶液;化学镀铜基础液由21.75 g/L CuSO4·5H2O、60 g/L NaKC4H4O6·4H2O、10 g/L Na2EDTA·2H2O、32 mL/L HCHO、10 mg/L 2,2′-联吡啶和5 mg/L K4Fe(CN)6组成,用25%(质量分数)NaOH调节溶液pH为13.0.
2 结果与讨论
2.1 DMH对镀层形貌和镀液稳定性的影响
采用不含和含5 g/L DMH的化学镀铜液获得的铜镀层的SEM照片分别见图1(A)和(B),形貌示于图1插图. 从图1(A)可以看出,不含DMH时的铜镀层表面分布着较为均匀的团簇状颗粒,颗粒尺寸约为1.5 μm,颗粒之间相互连接. 含5 g/L DMH时的铜镀层表面也分布着团簇状颗粒,颗粒尺寸相对细小,平均粒径约为0.9 μm[图1(B)];值得注意的是,铜镀层表面分布着大量细小的铜颗粒,表明在铜生长过程中既有小颗粒的长大,又有新的小颗粒的产生. 可见,DMH有利于细化铜颗粒.

Fig.1 SEM and appearance(inset)images of copper coatings without DMH(A)and with 5 g/L DMH(B)
在化学镀铜过程中,不含DMH 时的铜镀层外观为粉红色[图1(A)插图],铜沉积速率为2.23 μm/h;在50 ℃恒温水浴条件下反应40 min后,烧杯容器底部有大量的铜颗粒. 镀液中含有5 g/L DMH时,铜镀层外观呈光亮的紫铜色[图1(B)插图],沉积速率降至1.92 μm/h;在50 ℃水浴条件下反应40 min后,镀液透明而未见分解. 可见,DMH有利于提高镀液的稳定性和镀层的光亮度.
2.2 DMH对Cu(II)配位行为的影响

Fig.2 UV⁃Vis absorption spectra of different coordination agents and Cu(II)at different mole ratioscCu(II)=0.87 mmol/L;a. CuSO4;b. cCu(II)∶cC4H4O6=1∶1;c. cCu(II)∶cC4H4O6=1∶2;d. cCu(II)∶cEDTA=1∶1;e. cCu(II)∶cEDTA=1∶2;f. cCu(II)∶cEDTA∶cC4H4O6=1∶1∶1;g. cCu(II)∶cEDTA∶cC4H4O6∶cDMH=1∶1∶1∶0.5;h. cCu(II)∶cEDTA∶cC4H4O6∶cDMH=1∶1∶1∶1;i. cCu(II)∶cEDTA∶cC4H4O6∶cDMH=1∶1∶1∶2;j. cCu(II)∶cEDTA∶cC4H4O6∶cDMH=1∶1∶1∶4.
采用紫外-可见吸收光谱研究了DMH 与Cu(II)的配位行为. 分别配制摩尔比为1∶1,1∶2 的CuSO4和NaKC4H4O6混合溶液(cCu(II)=0.87 mmol/L,pH=13.0)、摩尔比为1∶1,1∶2 的CuSO4和Na2EDTA混合溶液(cCu(II)=0.87 mmol/L,pH=13.0),摩尔比为1∶1∶1 的CuSO4,Na2EDTA 和NaKC4H4O6混合溶液(cCu(II)=0.87 mmol/L,pH=13.0),摩 尔 比 为1∶1∶1∶0.5,1∶1∶1∶1,1∶1∶1∶2,1∶1∶1∶4 的CuSO4,Na2EDTA,NaKC4H4O6和DMH 混合溶液(cCu(II)=0.87 mmol/L,pH=13.0),不同配位剂与Cu(II)在不同摩尔比下的UV-Vis吸收光谱如图2所示. 可见,硫酸铜溶液中,在600~800 nm 范围出现对应于Cu2+离子的吸收光谱(图2 曲线a). 当铜离子和NaKC4H4O6共存时,在620 nm 处出现了吸收峰,说明铜离子和NaKC4H4O6发生了配位作用(图2 曲线b和c);且二者摩尔比1∶1 和1∶2 时的吸收峰强度一致,表 明cCu(II)∶cC4H4O6=1∶1 时,Cu(II)与NaKC4H4O6已达到化学计量比配位. 同样,当铜离子和Na2EDTA 共存时(图2 曲线d和e),在750 nm处出现了吸收峰,说明铜离子和Na2EDTA发生了配位作用;且二者摩尔比1∶1和1∶2时的吸收峰强度一致,表明cCu(II)∶cEDTA=1∶1 时,Cu(II)与Na2EDTA 已达到化学计量比配位. 进一步的实验结果 表明,在摩尔比为1∶1∶1 的CuSO4,Na2EDTA 和NaKC4H4O6溶液中(图2 曲线f),620 nm 处的Cu(II)与NaKC4H4O6配位吸收峰消失,而750 nm 处的Cu(II)与Na2EDTA 配位吸收峰依然存在. 可见,Na2EDTA 与Cu(II)的配位能力强于NaKC4H4O6. 值得注意的是,当DMH溶液与铜离子溶液以任何比例混合时,在pH=13.0条化下均发生化学沉淀反应. 含不同DMH浓度的溶液中(图2曲线g~j),仍只出现750 nm处的Cu(II)与Na2EDTA的配位吸收峰,且峰强度不发生变化,表明在pH=13.0条件下DMH与Cu(II)不发生强的配位作用.
2.3 DMH对甲醛阳极氧化及铜配位离子阴极还原的影响
采用线性伏安法(LSV)研究了DMH 对甲醛阳极氧化和铜配位离子阴极还原的影响. 铜电极在不含和含5 g/L DMH的化学镀铜基础液中,甲醛阳极氧化线性伏安曲线示于图3. 结果表明,不含DMH时(图3曲线a),甲醛在-0.75 V附近出现起波氧化电流,并在-0.4 V出现氧化峰;含5 g/L DMH 时(图3曲线b),甲醛初始氧化电位不变,而峰电位略正移至-0.37 V,峰电流减小. 可见,DMH不影响甲醛的初始氧化电位,但降低了甲醛的氧化速率. 这可能是由于DMH中含有—NH和C=O键,吸附在含有空轨道的铜原子上,抑制了甲醛氧化中间产物甲基二醇阴离子H2C(OH)O-中C—H键的断裂,导致甲醛的氧化速率降低[35]. DMH降低了甲醛的氧化速率,导致化学镀铜反应的沉积速率有所下降.
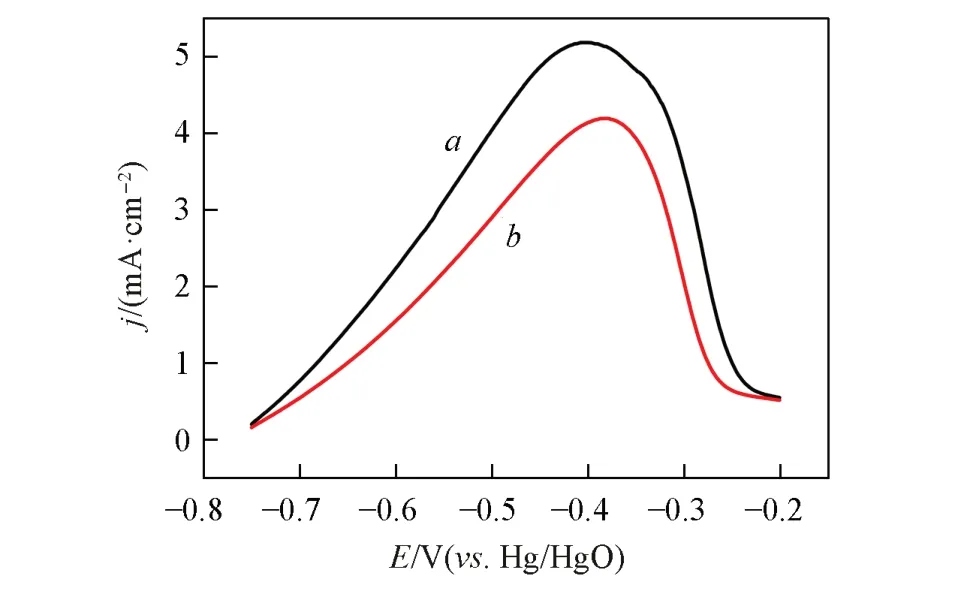
Fig.3 Linear voltammetry curve of anodic oxidation of formaldehyde in electroless copper plating base solution without DMH(a) and with 5 g/L DMH(b)(scanning rate:20 mV/s)
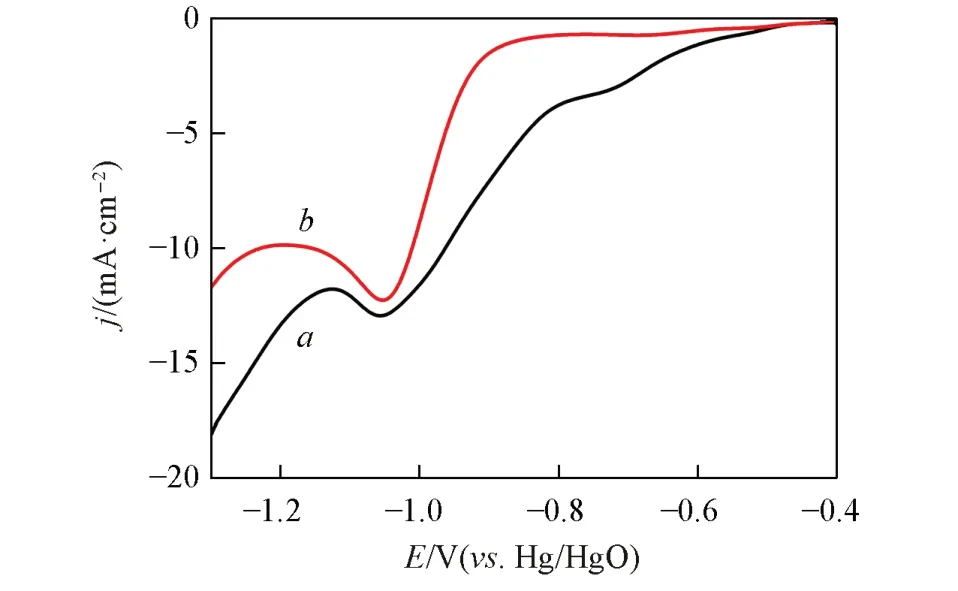
Fig.4 Linear voltammetry curve of cathodic reduction of Cu(II) coordination in electroless copper plating base solution without DMH(a) and with 5 g/L DMH(b)(scanning rate:20 mV/s)
铜电极在不含和含5 g/L DMH的化学镀铜基础液中,铜配位离子阴极还原的线性伏安曲线见图4.可见,不含DMH 时(图4 曲线a),Cu(II)配位离子出现两个明显的还原电流峰,峰电位分别为-0.6 和-0.8 V左右,归因于Cu2+还原为Cu+;并进一步还原为Cu0的过程;含5 g/L DMH时(图4曲线b),Cu(II)配位离子只出现一个还原峰电流峰,峰电位在-0.8 V 左右,峰电流略有减小,说明Cu2+直接还原为Cu0. 可见,DMH 能抑制Cu+产生或促进Cu+快速还原,从而提高镀液的稳定性.
2.4 DMH对镀层结构的影响

Fig.5 XRD patterns of copper coating from basic plating base solution without DMH(a) and with 5 g/L DMH(b)
图5 为在不含和含5 g/L DMH 的化学镀铜液中获得的铜镀层的XRD 谱图. 可见,在不含(图5 曲线a)和含5 g/L DMH(图5曲线b)的化学镀铜液中,铜镀层均在2θ=43.3°,50.3°,74.0°和89.8°处出现衍射峰,分别对应面心立方Cu(111),Cu(200),Cu(220)和Cu(311)晶面(标准卡片:PDF#04-0836).多个衍射晶面的出现,说明铜镀层为混晶结构. 此外,XRD谱图中未观察到Cu2O的衍射峰,说明铜镀层中无Cu2O夹杂或Cu2O夹杂量很低.
综上所述,在以酒石酸钾钠和乙二胺四乙酸二钠为双配位剂、甲醛为还原剂的化学镀铜液中,发现5,5-二甲基乙内酰脲有利于提高化学镀铜液的稳定性,归因于5,5-二甲基乙内酰脲能抑制Cu+产生或促进Cu+快速还原,避免了镀液中产生Cu和Cu2O微小颗粒,从而提高了镀液的稳定性. 研究结果对于发展高稳定性化学镀铜工艺,并理解稳定剂的作用机制具有重要的实际和理论价值.

