血清TK1,TSH,TG,TGAb检测联合TI RADS分类在甲状腺乳头状癌早期筛查中的应用价值
宋晓龙,宋 宇,魏 龙,周建平
(陕西省人民医院放射免疫中心,西安 710068)
甲状腺癌(thyroid cancinoma)是内分泌系统中发病率最高的肿瘤,其中甲状腺乳头状癌(papillary thyroid cancinoma, PTC)最为常见[1]。我国城市地区女性甲状腺癌发病率位居女性恶性肿瘤第4 位。随着甲状腺超声检查的广泛应用,60 岁以上人群甲状腺结节检出率为50%~70%[2]。甲状腺影像报告和数据系统(thyroid imaging reporting and data system,TI RADS)分类可提示恶性概率,但无法确诊。甲状腺细针穿刺细胞学检查在鉴别结节良恶性中受到广泛认可,但该方法为有创检查且对相关医师的技术水平要求较高,临床难以广泛开展,有10%~40%的结节性质仍无法判断[3]。因而,准确鉴别甲状腺结节的良恶性以避免不必要的手术治疗是目前临床的迫切需求。血清学检测具有方便、快捷、无创、患者易于接受等特点,是肿瘤早期筛查和诊断的主要方法。据文献报道,血清胸苷激酶1(thymidine kinase 1,TK1)可用于肝癌、乳腺癌等多种恶性肿瘤的早期诊断,但在甲状腺癌早期筛查和诊断中的应用鲜少报道。本研究通过分析PTC 组、甲状腺良性结节(benign thyroid nodules, BTN)组和健康对照(healthy control,HC)组间血清TK1,促甲状腺激素(thyroid stimulating hormone,TSH)、甲状腺球蛋白(thyroglobulin,TG)和甲状腺球蛋白抗体(thyroglobulin antibodies,TGAb)的浓度差异,联合甲状腺结节超声甲状腺影像报告和数据系统(thyroid imaging reporting and data system, TI-RADS)分类,探讨多指标联合应用在甲状腺结节良恶性鉴别中的临床价值。
1 材料与方法
1.1 研究对象 选取2021年1月~10月于陕西省人民医院初诊并行手术治疗的176 例甲状腺结节患者为研究对象,结节性质以术后病理为准。纳入标准:术前完成超声检查、一般常规检验及甲状腺功能检验;排除并发其他肿瘤以及严重器质病变者。PTC 患者116 例,其中男性21 例,女性95 例,平均年龄47.44±11.35 岁;BTN 患者60 例(结节性甲状腺肿52 例,甲状腺腺瘤8 例),其中男性12 例,女性48 例,平均年龄49.77±14.56 岁。选择同期健康体检人员60 例,其中男性11 例,女性49 例,平均年龄47.33±14.56 岁,纳入标准:一般常规检查及甲状腺超声检查无明显异常。三组研究对象间年龄、性别比较,差异无统计学意义,具有可比性(P>0.05)。本研究经医院伦理审查委员会批准,所有研究对象均签署知情同意书。
1.2 仪器与试剂 TK1 采用华瑞同康SSTKBIO 酶免疫点印迹化学发光分析仪及配套试剂盒进行检测;TG 应用迈瑞CL8000 型全自动化学发光免疫分析仪及配套试剂盒进行检测;TSH,TGAb 应用安图A2000 型全自动化学发光免疫分析仪及配套试剂盒进行检测;甲状腺超声检查应用飞利浦EPIC 7C 彩色多普勒超声诊断仪。
1.3 方法
1.3.1 血清学标志物检测:采集患者术前及健康体检人员空腹静脉血3 ml,离心完成后分离血清,及时上机检测或置于-20℃保存,1 周内应用相应仪器完成检测。
1.3.2 甲状腺超声检查:超声检查分别由 2 名医师完成,且结论一致者入组。依据2018年TI-RADS标准对结节进行分类,主要包括甲状腺结节的质地、回声、边缘、单发灶、微钙化、纵横比、大小及TI-RADS 分类[4]。将结节分为质地实性和非实性组,低回声和非低回声组,边界不清(边界模糊、毛刺样等)和边界清楚组,微钙化和非微钙化组;最大径为甲状腺结节的最长径;纵横比>1 和 ≤ 1 组;TI-RADS 分类 ≥ 4 类和<4 类组。当患者有多个甲状腺结节时,BTN 取TI-RADS 分类最高的结节纳入研究,PTC 取肿瘤最大径者纳入研究。
1.4 统计学分析 采用 SPSS 18.0 软件进行数据统计分析。计量资料为正态分布以均数±标准差(±s)表示,组间比较用t检验;非正态分布以中位数(P25,P75)[ M (P25,P75)]表示,组间比较用 Kruskal-WallisH检验;多组间数据比较采用单因素方差分析;计数资料采用卡方检验。采用ROC评价各指标单独检测时的诊断性能,并按照约登指数(youden index )的最大值选取临界值(cut-off值)。多因素联合分析采用 Logistic 回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 三组间血清学标志物浓度水平比较 见表1。PTC 组血清 TK1,TSH,TG 的水平较BTN 组及HC组明显增高,差异均有统计学意义(均P<0.05)。BTN 组血清TK1,TG 浓度高于HC 组,差异有统计学意义(t=5.00,4.43,均P<0.05)。PTC 组与BTN 组、BTN 组与HC 组间TGAb 水平差异无统计学意义(H=1.25, 2.64,P=0.264,0.105)。
2.2 PTC 组与BTN 组间甲状腺超声特征的比较见表2。分析PTC 组与BTN 组间甲状腺超声特征的结果显示,PTC 组患者结节的质地实性、低回声
、边界不清、微钙化、纵横比>1 及TI RADS 分类(≥4类)比例明显高于BTN 组,差异均有统计学意义(均P<0.05)。
表1 三组间血清学标志物浓度水平比较[±s,M (P25,P75)]
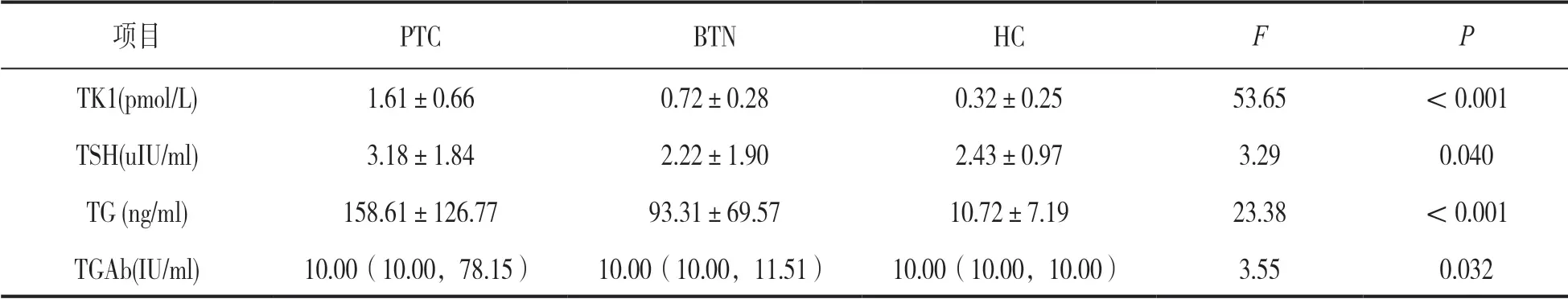
表1 三组间血清学标志物浓度水平比较[±s,M (P25,P75)]
注:TGAb 的检测下限是10,大部分患者的检测值都是检测下限,因而四分位数都是10。
项目PTCBTNHCFP TK1(pmol/L)1.61±0.660.72±0.280.32±0.2553.65<0.001 TSH(uIU/ml)3.18±1.842.22±1.902.43±0.973.290.040 TG (ng/ml)158.61±126.7793.31±69.5710.72±7.1923.38<0.001 TGAb(IU/ml)10.00(10.00,78.15)10.00(10.00,11.51)10.00(10.00,10.00)3.550.032
表2 PTC 组与BTN 组甲状腺超声特征比较[n (%),±s]
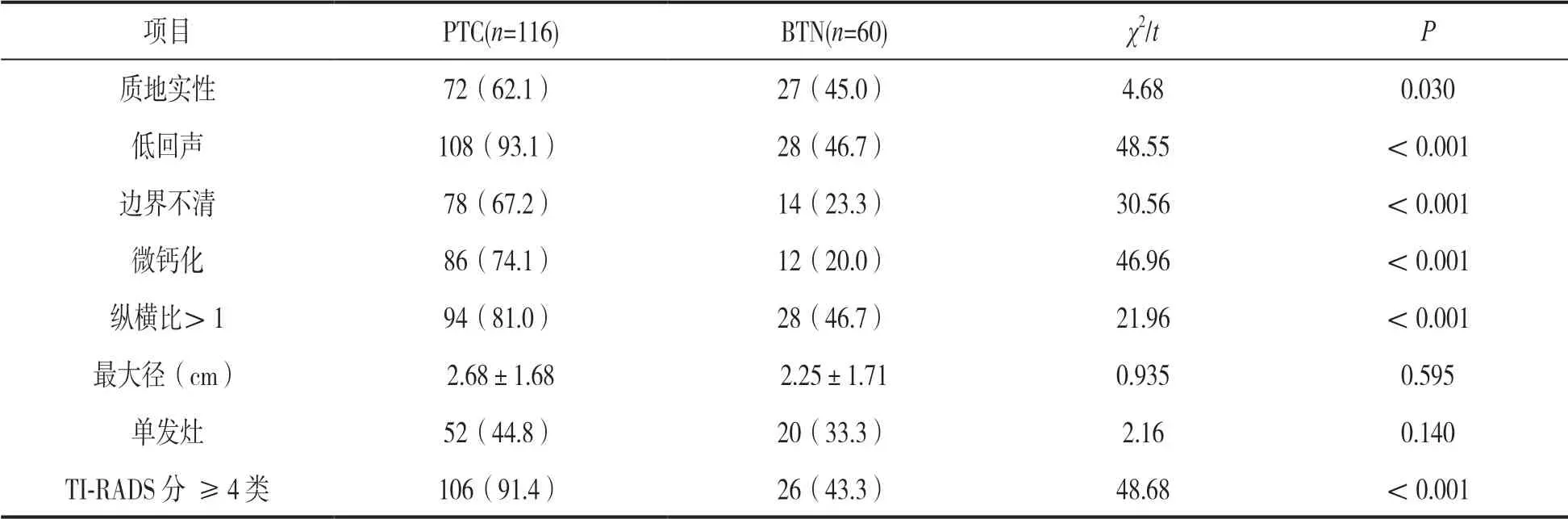
表2 PTC 组与BTN 组甲状腺超声特征比较[n (%),±s]
项目PTC(n=116)BTN(n=60)χ2/tP质地实性72(62.1)27(45.0)4.680.030低回声108(93.1)28(46.7)48.55<0.001边界不清78(67.2)14(23.3)30.56<0.001微钙化86(74.1)12(20.0)46.96<0.001纵横比>194(81.0)28(46.7)21.96<0.001最大径(cm)2.68±1.682.25±1.710.9350.595单发灶52(44.8)20(33.3)2.160.140 TI-RADS 分 ≥4 类106(91.4)26(43.3)48.68<0.001
2.3 多因素Logistic 回归分析 见表3。以血清学标志物及甲状腺超声特征为自变量,以是否确诊为PTC 为因变量,应用Logistic 回归分析后发现血清TSH,TG,sTK1 及B 超低回声、边界不清、单发灶、微钙化、纵横比>1,TI-RADS 分类为预测早期PTC 的独立风险因素。

表3 诊断早期PTC 的多因素Logistic 回归分析
2.4 多指标单独及联合检测在早期PTC 中的诊断效能 见表4 及图1。单独检测各指标筛查PTC 时,AUCTK1(0.827) >AUCTI-RADS(0.794) >AUCTG(0.664)>AUCTSH(0.661),均有一定的临床诊断价值(均P<0.05)。联合检测多项指标筛查PTC 时,AUC 升高至0.914,灵敏度和特异度分别为89.7%,80.00%。
3 讨论
甲状腺结节在临床诊断前常无明显症状和体征,在健康体检人群中的检出率为20%~67%,其中恶性结节占5%~15%[5]。临床常用于甲状腺疾病诊断的血清学指标有TSH,TG,TGAb 等。TSH 可促进甲状腺上皮细胞代谢与蛋白质合成。甲状腺癌细胞表面含有TSH 受体,可促进滤泡细胞与上皮细胞的生长[6],亦可通过 P21 活化激酶4信号转导通路(PAK4)诱导乳头状癌细胞的分化与增殖[7]。有研究[8]表明,PTC 患者血清 TSH 水平显著高于结节性甲状腺肿,且TSH 的高水平与PTC 的严重程度有一定相关性。TSH >1.85 mIU/L是预测甲状腺肿瘤复发的独立风险因素[9]。TG 在甲状腺疾病的良恶性鉴别中无特异度,但在甲状腺癌术后的风险评估、随访及预后判断中有一定价值,且与肿瘤淋巴结转移密切相关[10]。TGAb 是常用于桥本氏甲状腺炎、Graves 等的抗甲状腺自身抗体。

表4 单独检测各指标在早期PTC 诊断中的价值
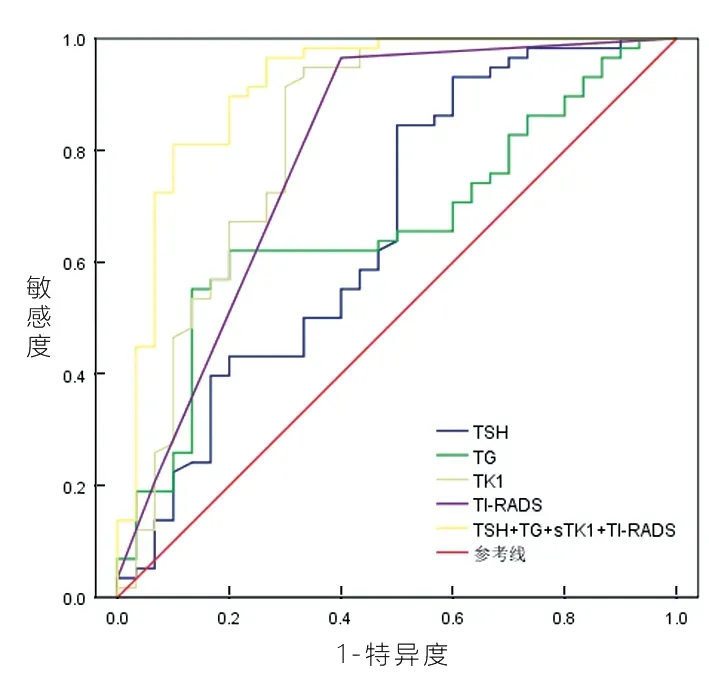
图1 单独及联合检测各指标在早期PTC 中的诊断效能
本研究结果显示,PTC 组TSH,TG 水平高于BTN 组及HC 组。TSH 水平可初步鉴别诊断甲状腺良恶性肿瘤,在甲状腺疾病早期筛查中具有重要的临床应用价值。TGAb 在PTC 与BTN 组间的水平差异与某报道不相符[11],可能由于本研究受试人员为TNM Ⅰ期患者,癌细胞生长浸润范围较小,未造成大面积组织细胞破坏,从而TGAb 无明显变化。TSH,TG 单独检测用于PTC 早期筛查时,AUC(0.661,0.664)显示有一定诊断效能,但灵敏度及特异度较低,无法满足临床需求。AUCTGAb为0.573,灵敏度仅49.7%,结果显示 TGAb 不能单独作为结节良恶性的预测指标,与RAKIB 等[12]研究结果相似。
TK1 是新近发现的肿瘤标记物,与细胞增殖密切相关,在肝癌、乳腺癌等多种恶性肿瘤患者血清中明显升高[13],与肿瘤临床分期有一定相关性[14],但在甲状腺癌中的相关研究较少。林琳等[15]研究发现TK1 水平与肿瘤的增殖度、恶变程度明显相关。本研究结果显示TK1 在PTC 组中呈高表达。单独检测用于诊断早期PTC 时,AUCTK1为0.827,灵敏度和特异度分别为72.4%,76.3%。从而TK1 可作为甲状腺结节良恶性鉴别的有效指标。有研究[16]证实,TK1 产生的促炎细胞因子能够加速T 细胞向Th1 细胞分化,最终导致肿瘤进展。
甲状腺超声用于诊断桥本甲状腺炎并发甲状腺乳头状癌的检出率为93.55%,准确度为85.29%[17]。虽然TI-RADS 分类越高,结节恶性概率越高,单独使用时仍有较高误诊率和漏诊率,并且容易受到医生的临床经验、仪器掌握程度等主观因素的影响。本研究发现甲状腺超声结果中的结节低回声、边界不清、单发灶、微钙化、纵横比>1、TI-RADS 分类可作为预测PTC 的独立风险因素。单独应用TI-RADS 分类诊断PTC 的AUC 为0.794,有较高诊断效能,灵敏度为86.00%,但特异度仅为60.00%。
应用ROC 曲线、Logistic 回归分析,本研究发现PTC 与血清TSH,TG,TK1 水平及TI-RADS分类有关。单独应用各指标诊断PTC 均有一定的临床价值,但灵敏度和特异度无法同时满足临床需求。联合应用各指标可显著提高PTC 的诊断效能,AUC 为0.914,灵敏度和特异度分别为89.70%,80.00%。
综上所述,血清TSH,TG,TK1 检测及TIRADS 分类可用于鉴别甲状腺结节良恶性,并且四项指标联合应用时可有效提高甲状腺乳头状癌的诊断效能,辅助临床进行早期诊断。本研究纳入受试对象有限,将继续收集相关临床资料,探讨sTK1在PTC 的不同TNM 分期中以及预后监测中的应用价值。

