多模态影像技术在前列腺癌靶向穿刺中的应用
苏春,宋宇,黄玉慧,付尧
1.南方医科大学南方医院超声诊断科,广东 广州 510515;2.大连医科大学附属第二医院超声诊断科,辽宁 大连 116023;3.首都医科大学附属北京朝阳医院超声诊断科,北京 100020;*通信作者 宋宇 yu19800309@sina.cn
前列腺癌是危害男性健康的常见恶性肿瘤之一,近年我国发病率呈逐年上升趋势[1]。前列腺癌在不同阶段差异很大,78%的局部癌患者5年生存率为100%,而转移癌患者5年生存率仅为30%[2],早期诊断前列腺癌对于提高患者的生存期有重要意义。目前临床常用的早期筛查手段包括前列腺特异性抗原(prostate specific antigen,PSA)、直肠指诊、经直肠超声成像(transrectal ultrasonography,TRUS)、MRI等,但前列腺穿刺活检病理是诊断“金标准”[3]。根据欧洲泌尿学协会最新指南[4],任何一种影像技术在前列腺癌诊断及穿刺靶点的选择上均存在一定局限性,不能完全取代系统性穿刺活检。本研究拟联合TRUS、经直肠实时超声弹性成像(transrectal real-time elastography,TRTE)、经直肠超声造影(transrectal contrast-enhanced ultrasound,TRCEUS)及MRI/TRUS影像融合等技术,在多模态影像技术下经直肠腔内超声引导前列腺癌靶向穿刺,探讨靶向穿刺是否可以有条件地替代系统性穿刺,寻找在前列腺癌诊断中更有意义的影像模态组合。
1 资料与方法
1.1 研究对象 回顾性分析2018年12月28日—2019年12月31日于大连医科大学附属第二医院就诊的疑似前列腺癌患者141例,年龄46~85岁,平均(69.3±7.9)岁。所有患者均检测血液总前列腺素特异抗原(T-PSA)、游离前列腺素特异抗原(F-PSA)、F/T(F-PSA/T-PSA),并采用TRUS测量前列腺体积。纳入标准:①T-PSA>4 ng/ml或F/T<0.16;②直肠指检可触及前列腺结节;③影像学检查提示可能存在前列腺癌;④签署前列腺穿刺知情同意书和(或)前列腺超声造影同意书。排除标准:①1年内进行相关前列腺疾病治疗;②患有严重心肺功能障碍、严重过敏、出凝血功能障碍。
1.2 分组 根据影像组合方式不同分为4组:A组为TRUS+TRTE+TR-CEUS+MRI,共40例,年龄46~81岁;B组为TRUS+TRTE+TR-CEUS,共19例,年龄56~83岁;C组为MRI/TRUS,共40例,年龄55~85岁;D组为TRUS,共42例,年龄54~85岁。患者均知情同意,本研究经医院医学伦理委员会审核批准(大医二院伦快审2021第37号)。
1.3 仪器与方法 采用Esaote MyLab Twice超声诊断仪,配备TRT33双平面直肠探头(频率4~9 MHz)及相应的穿刺引导设备,拥有超声弹性成像及造影功能;丹麦BK flex Focus800多普勒超声仪,配备Mim融合穿刺软件及双平面探头;GE MR750W 3.0T MR仪。患者进行相关检查及穿刺活检前做好相应的准备,严格把握禁忌证。MRI扫查序列主要包括T2WI、扩散加权成像(DWI)、表观扩散系数(ADC)。根据分组进行相应的TRUS、TRTE、TR-CEUS、MRI检查,针对不同影像技术的特点,记录可疑病灶的相关信息。
1.4 图像分析及诊断标准
1.4.1 TRUS 采用前列腺癌TRUS诊断标准[5-6],判断相应阳性征象及可疑征象,用于系统性穿刺的参考切面。
1.4.2 TRTE 采用Kamoi等[7]提出的弹性成像图像V级分类标准:本研究视弹性成像图像分级标准中的I~II级为阴性,III~V级为阳性。
1.4.3 TR-CEUS 根据欧洲超声医学与生物学联合会发布的前列腺造影指南及相关报道[6,8],本研究中出现典型征象的病灶为阳性,与周边正常腺体组织同步增强或周边出现环状增强的病灶为阴性。
1.4.4 MRI 依据欧洲泌尿生殖放射学会于2015年更新的前列腺成像、报告和数据系统(PI-RADS V2)[9],用5分评价表评估发现每个病灶为临床显著前列腺癌的可能性[10-12]。本研究将PI-RADS 1~3分的结节视为阴性,4~5分的结节视为阳性[13]。
1.5 前列腺穿刺活检 本研究中所有超声影像技术图像由2位经验丰富的超声医师采用双盲法评价,MRI由2位放射科高年资泌尿诊断医师采用双盲法按照PIRADS V2进行评分,结果有分歧时集体讨论并判断。前列腺穿刺采用经直肠超声引导下经会阴穿刺活检,穿刺方案选择10~12点系统穿刺和靶目标穿刺相结合。10~12点系统穿刺即前列腺双侧周缘区旁正中、正中、外部、外部偏前(10点系统性穿刺不包含)各1针和移行区内侧、外侧各1针;靶目标穿刺指在各影像技术所示前列腺异常声像图表现处穿刺2~3针。
1.6 病理检查 所有前列腺穿刺活检标本由1名经验丰富的泌尿方向病理医师采用Gleason评分系统[14]进行评判,按照HE切片中的主要和次要结构类型分别进行分级后,两者之和即为Gleason评分。如病理结果为前列腺腺癌,则归为恶性,其余情况均为良性。
1.7 统计学方法 采用SPSS 21.0软件,符合正态分布的计量资料以±s表示,组间比较采用单因素方差分析,经会阴前列腺穿刺活检得出的病理结果作为评价“金标准”,4组不同影像学组合方式引导前列腺穿刺活检与前列腺癌的检出率比较采用χ2检验,分别计算4组诊断前列腺癌的敏感度、特异度、准确度、阳性预测值、阴性预测值,绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC),采用Spearman相关分析A、B组影像技术中不同阳性个数与恶性率之间的相关性,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 4组患者年龄、T-PSA、F-PSA、F/T(F-PSA/T-PSA)及前列腺体积比较,差异均无统计学意义(P>0.05),见表1。
表1 4组患者基本临床资料比较(±s)
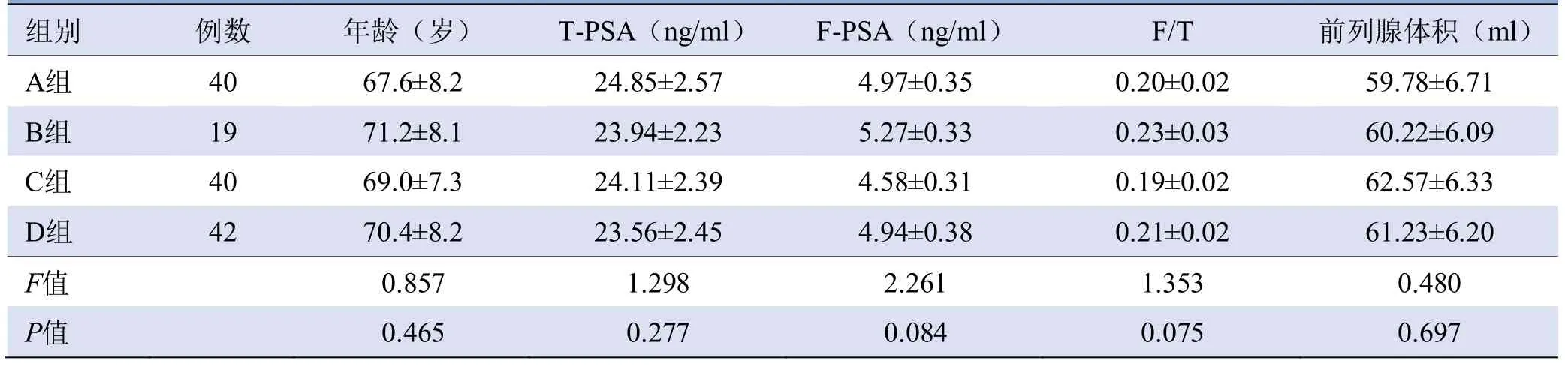
表1 4组患者基本临床资料比较(±s)
注:T-PSA:总前列腺素特异抗原;F-PSA:游离前列腺素特异抗原;F/T:F-PSA/T-PSA
组别例数年龄(岁)T-PSA(ng/ml)F-PSA(ng/ml)F/T 前列腺体积(ml)A组 40 67.6±8.2 24.85±2.57 4.97±0.35 0.20±0.02 59.78±6.71 60.22±6.09 C组 40 69.0±7.3 24.11±2.39 4.58±0.31 0.19±0.02 62.57±6.33 B组19 71.2±8.1 23.94±2.23 5.27±0.33 0.23±0.03 61.23±6.20 F值 0.857 1.298 2.261 1.353 0.480 D组42 70.4±8.2 23.56±2.45 4.94±0.38 0.21±0.02 P值0.465 0.277 0.084 0.075 0.697
2.2 病理结果 141例患者中,经会阴前列腺穿刺活检病理证实,良性72例,恶性69例,见表2。
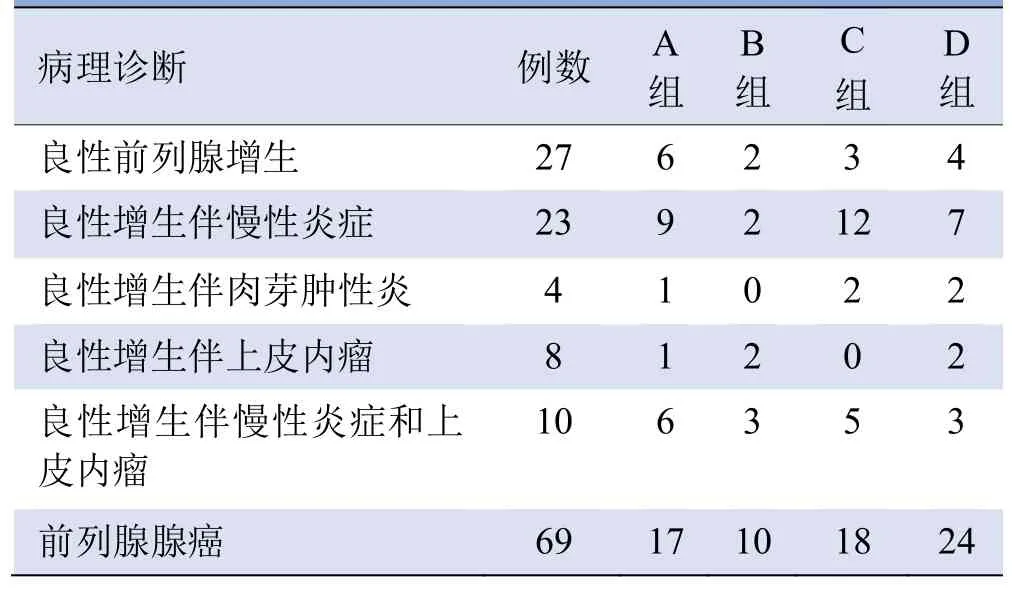
表2 141例患者前列腺活检病理诊断结果(例)
2.3 病理诊断与4组影像技术诊断结果比较 根据不同影像诊断技术的阳性评判标准进行诊断,以病理结果作为“金标准”,A组和D组的诊断敏感度、特异度比较,差异均有统计学意义(P<0.002),见表3。ROC曲线见图1。
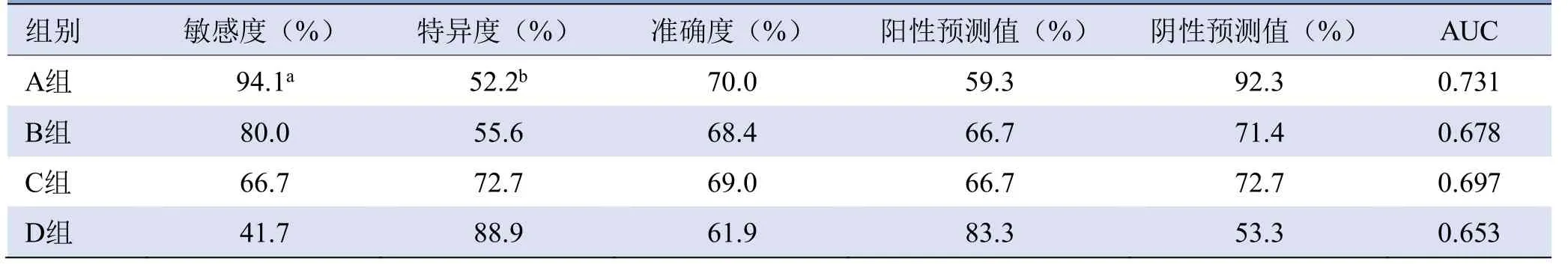
表3 4组影像技术对前列腺良、恶性病灶的诊断价值比较
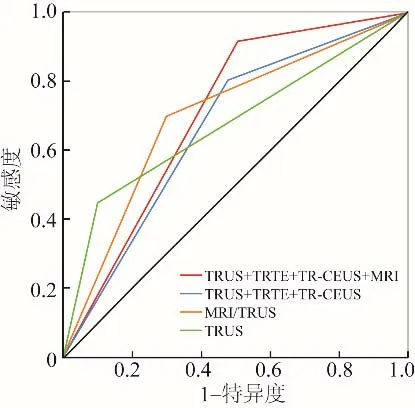
图1 4组不同影像技术诊断前列腺癌的ROC曲线
2.4 A、B组中不同阳性个数与Gleason评分的相关性A、B组影像技术中不同阳性个数与恶性率呈正相关(rA=0.567,PA=0.038;rB=0.463,PB=0.046),见表4。
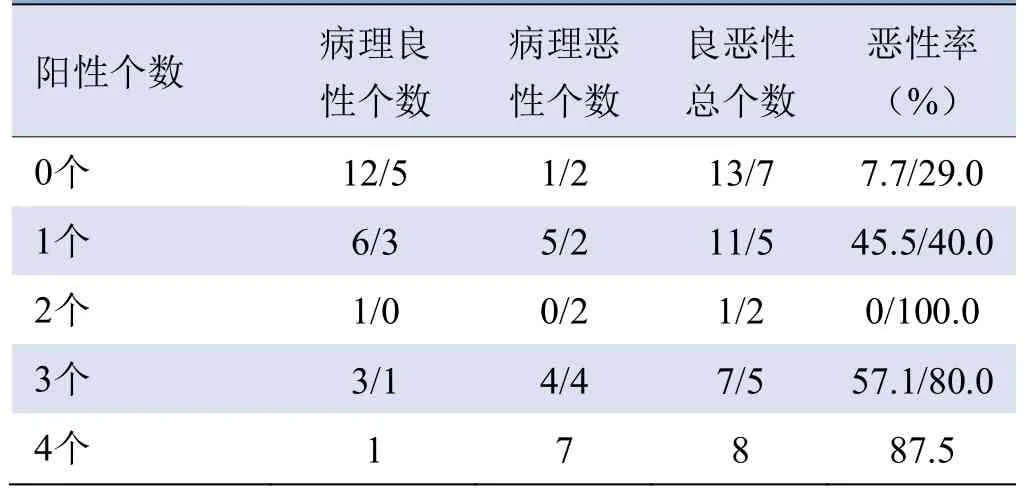
表4 A组/B组影像技术阳性个数
2.5 A、B、C组影像技术中系统性穿刺活检与靶向穿刺活检单针阳性率比较 A、B、C组影像技术中靶向穿刺与系统性穿刺活检单针阳性率比较分别为34.5%(38/110)比21.6%(99/458)、60.0%(30/50)比40.2%(82/204)、20.0%(21/105)比12.5%(58/464),差异均有统计学意义(χ2=9.55,PA=0.043;χ2=6.33,PB=0.048;χ2=7.80,PC=0.046)。A组中,当4个影像技术均阳性时,靶向穿刺对前列腺癌的检出率为100%(7/7),系统性穿刺对前列腺癌的检出率为85.7%(6/7),见图2。
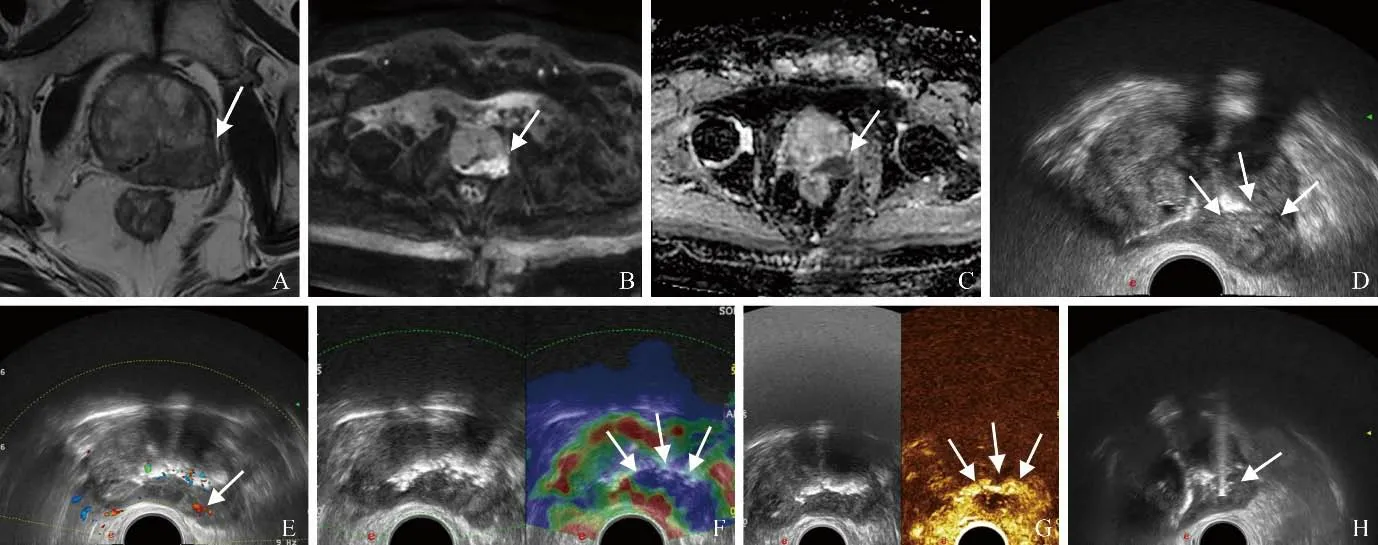
图2 男,79岁,PSA 52.8 ng/ml,经直肠超声引导下靶向穿刺病理活检证实为前列腺癌,Gleason评分4+4=8分。A. T2WI示前列腺偏左侧周缘区见片状低信号结节影(箭);B. DWI可见扩散减低的高信号结节影(箭);C. ADC可见局限性明显的ADC值减低区,PI-RADS评分5分(箭);D.二维超声图像示前列腺偏左侧周缘区增厚,呈不均质低回声(箭);E.彩色多普勒图像示局部彩色血流信号较丰富(箭);F.弹性成像图像示局部呈蓝色区域,弹性评分4分(箭);G.超声造影图像示动脉期呈高增强、快增强,内部伴无增强区(箭);H.经会阴靶向穿刺活检图像示穿刺针横断面伪影(箭)
3 讨论
近年来,针对前列腺癌的早期诊断,TR-CEUS、TRTE及MRI/TRUS融合成像等新技术飞速发展。既往研究显示,多模态影像技术下靶向穿刺的敏感度、特异度、准确度均高于单一使用某一种影像技术引导的靶向穿刺活检[15-16]。本研究结合多种影像技术,发挥各自优势联合诊断以及引导前列腺癌穿刺活检,探究在前列腺癌诊断中相对更有价值的影像模态组合。
3.1 单一影像技术诊断前列腺癌的局限性 本研究中,当使用TRUS、TRTE、TR-CEUS、MRI某单一影像技术进行诊断时,均出现误诊。Oliva等[17]发现利用TR-CEUS诊断前列腺癌时,其敏感度(70%)、特异度(48%)均较低。李丹丹等[18]提出部分良性前列腺增生也可出现与前列腺癌类似的“快进快出”造影表现。本研究中TR-CEUS误诊的病理类型为前列腺增生伴部分腺上皮增生活跃以及前列腺增生伴淋巴细胞浸润,腺体内的血流较正常组织丰富,推测因此得出假阳性结果,结论与上述研究结果相近。前列腺癌在二维超声上常表现为低回声病变,好发于外腺区,早期病灶较小,与部分增生结节易混淆,良、恶性征象在二维超声上存在交叉[19]。本研究中,TRUS误诊的患者图像上均表现为局灶性低回声病变,进一步证实单纯依靠灰阶超声不能准确诊断前列腺癌;Kanagaraju等[20]发现TRTE诊断前列腺癌的特异度与阴性预测值均偏低(56.25%,58.13%),其原因可能是部分前列腺内存在液化坏死灶或出现钙化[21],本研究也发现前列腺癌病灶常伴有微钙化这一特点,其弹性评分增加很大程度上受到微钙化的影响;在最新EAU指南[4]中,MRI被公认为诊断前列腺癌的最佳影像学方法。但既往研究显示,T2WI周缘区低信号并非前列腺癌的特异性表现,前列腺炎、前列腺出血、良性增生等部分良性病变也有类似改变[22-23]。本研究中MRI出现误诊的患者病理类型均为前列腺增生伴炎性改变及部分腺上皮增生活跃,T2WI均呈低信号,与前列腺癌表现类似。因此,当单纯依靠某一影像技术较难做出准确诊断时,应采取多种影像技术相结合以提高诊断准确性。
3.2 多模态影像技术诊断前列腺癌的优越性 当联合使用TRUS、TRTE、TR-CEUS、MRI技术时,诊断敏感度、准确度、AUC均高于其他影像模态组合,同时较上述单一影像技术研究报道的敏感度明显提高[5,24-25]。林舒婷等[26]联合使用TRUS、TRTE、TRCEUS诊断前列腺癌的AUC为0.773,高于本研究中联合使用以上3种影像技术诊断前列腺癌的AUC(0.678),可能与TRTE重复性较差、存在一定的主观性有关。同时本研究也发现,运用多模态影像技术提高前列腺癌诊断敏感度的同时,也增加了部分假阳性病灶,使得特异度相对降低,对这部分假阳性病灶行靶向穿刺活检增加了穿刺的针数和发生并发症的风险。因此,后续研究重点应该探究如何运用多模态影像技术提高前列腺癌诊断特异性的同时,减少穿刺针数,并降低并发症的发生率。
3.3 靶向穿刺活检与系统性穿刺活检对比 A、B、C组靶向穿刺单针阳性率与系统性穿刺单针阳性率相比明显更高,表明靶向穿刺用更少的针数达到与系统性穿刺相近的检出率,上述结论与既往研究结果[18,27]相近。Lu等[28]发现进行TR-CEUS靶向穿刺与系统性穿刺活检相比具有更高的单针阳性率。靶向穿刺发挥了TRTE、TR-CEUS、MRI对病灶的定性及定位优势,有的放矢,穿刺针数更少,阳性针数比重更高。探究多模态影像技术中不同阳性个数与恶性率之间的相关性发现,A、B组影像技术中不同阳性个数与恶性率呈正相关,表明随着影像技术阳性个数增多,恶性率呈不断升高趋势。A组中,当TRUS、TRTE、TR-CEUS、MRI均提示阳性时,可以有条件地单独使用靶向穿刺活检替代系统性穿刺活检,在提高检出率的同时减少并发症。
3.4 本研究的局限性 ①分组较细,导致组内样本量较小,尚需要大样本、多中心研究进一步验证;②认知融合图像匹配时可能会产生人为误差。
总之,TRUS+TRTE+TR-CEUS+MRI是前列腺癌诊断中相对更有意义的影像模态组合。当TRUS、TRTE、TR-CEUS、MRI联合使用均提示阳性时,可以有条件地单独使用靶向穿刺活检以替代系统性穿刺活检。

