百合GBSS基因RNAi载体构建
张进忠
(广西农业科学院花卉研究所,南宁 530007)
0 引言
食用百合鳞茎富含淀粉、营养丰富;部分品种药食同源,富含生物碱、多糖、皂苷类等活性成分,具有抗氧化、抗疲劳、抗癌、降血糖、镇静催眠、免疫调节等作用[1-2],是膳食药用佳品。百合鳞茎籽球质量对后期商品种球的生长影响较大,从小鳞茎生长到商品种球的形成一般需2~3 年时间,因此百合鳞茎籽球高质量繁殖非常重要。百合母鳞片通过淀粉代谢途径为其近鳞盘基端发育形成的小鳞茎提供碳源,小鳞茎再通过小分子糖到淀粉的转变积累逐渐膨大生长[3-4],小鳞茎的鳞片数增加、体积增大表明其以淀粉为主的营养积累增加,为后期生长提供了较多的能量物质。营养养分积累较少的再生鳞茎通常第一年不能形成主茎秆而成为基叶苗[3],延缓了种植生产。研究百合淀粉合成代谢、调控淀粉合成途径关键酶基因的表达机制对于理解鳞茎籽球的形成与膨大发育具有重要意义,据此开发出鳞茎籽球的生产调节技术对于百合种植产业更具重大意义。
在淀粉合成关键酶中,腺苷二磷酸葡萄糖焦磷酸化酶是淀粉合成的限速酶[5],催化反应生成的ADPG作为颗粒结合淀粉合成酶(GBSS)等相关酶的底物形成糖苷键延长合成淀粉。所以GBSS对于作物淀粉的形成与积累非常关键,对其编码基因的表达调节进行相关研究,探索出能提高淀粉产量、改善淀粉品质的技术有利于作物生产的提质增效。GBSS具有glgA保守结构域,该结构域是淀粉合成酶的特征结构,作用底物为ADPG,具有GT1_Glycogen_synthase_DULL1_like保守结构域,该域结构包含ADP-binding pocket 与同二聚体界面2个特征位点,前者为化学结合位点,可与ADP 结合的一些残基间接结合,后者为多肽结合位点。该家族蛋白与糖基转移酶GT1家族关系密切,以ADPG 为底物,催化形成α-1,4-糖苷键,实现葡萄糖骨架的形成和延伸。
研究发现,玉米GBSS胚乳特异启动子受ABA 正调控,对诱导培养的玉米胚乳进行ABA 处理后,其表达量明显提高,促进了GBSS表达,而GA3处理后的该启动子表达量下降[6],这为通过激素等外界因子调控基因表达而改变作物淀粉品质提供了途径。在对作物进行GBSS反义表达或抑制表达中,人们发现其直链淀粉含量急剧下降[7-9],例如抑制水稻GBSSⅠ表达导致胚乳直链淀粉大幅度降低[10];利用RNAi 技术沉默GBSSⅠ在小麦中的表达导致了GBSSⅠ酶活下降及直链淀粉的大幅度下降[11];这为GBSS 具有催化直链淀粉合成的生物学功能提供了证据。食用百合淀粉合酶相关基因研究较少,在其鳞茎形成、膨大发育繁殖过程中伴随着淀粉的大量合成积累,为其后续的营养生长积蓄能量物质;因此研究GBSS 调控淀粉合成代谢有助于理解百合鳞茎形成发育机制,也对研发调控百合淀粉含量与品质的生产技术提供参考。本研究利用Gateway 技术,构建GBSS保守区域干扰表达载体,旨在为进一步开展基因沉默、研究该基因功能提供思路。
1 材料与方法
1.1 材料
1.1.1 植物材料 兰州百合(Lilium davidiivar.unicolor)组培苗培养于广西农业科学院作物遗传改良重点实验室。
1.1.2 菌株与质粒载体 大肠杆菌DH5α,克隆载体pDONR221,目的载体pJawohl8-RNAi,具有GBSS保守区域(登录号KP751445)的pMD18-T克隆质粒由笔者所在实验室保存。
1.2.3 主要试剂Gateway®LR Clonase®enzyme mix,规格20T,货号11791019(Invitrogen);5×BP Clonase enzyme mix,Gateway BP Clonase II enzyme mix,规格100T,货号11789100(Invitrogen);RNA提取试剂Trizol购于Invitrogen;逆转录试剂RevertAid First Strand cDNA Synthesis Kit 购于Fermentas;Taq DNA 聚合酶、限制性内切酶购自TAKARA,DNA 凝胶回收试剂盒AP-GX-50 购于Axygen;其余常规试剂为进口或国产分析纯。
1.2 方法
1.2.1 目的序列的扩增 根据基因序列,选择保守区域300 bp作为干扰片段,利用Primer 5.0设计引物,引物由上海生工生物技术有限公司合成;以带有目的片段的质粒为模板进行PCR,1%琼脂糖凝胶电泳检测PCR 产物。GBSS I F:5’-ATTCggtaccGGGAGGAAAATCAA TTGGATGAAG-3’,酶切位点Acc65I;GBSS I R:5’-CGCActcgagTGTGGAATGTCTGGGTCAACAGGA-3’酶切位点XhoI。
1.2.2 构建入门克隆 按文献[12]克隆含有attB接头的干扰片段attB-PCR产物。
(1)BP 重组反应。attB-PCR 产物5 μL(>10 ng),pDONR221(150 ng/μL)1 μL,5×BP Clonase enzyme mix 2 μL,TE Buffer 4 μL;反应体系放于25℃下温育10 h,反应产物应为含有目的片段的入门克隆pDONR221-GBSS。
(2)转化。取100 μL DH5α感受态细胞,加入至上述反应体系中,冰上30 min,然后42℃保持90 s,迅速放于冰上2 min,涂布到含有氨苄青霉素的LB 固体培养皿上,37℃培养15 h。将LB 平板倒置,常温下随机挑选平板上的阳性克隆,PCR 法筛选重组克隆,凝胶电泳检测PCR产物。
1.2.3 构建干扰表达载体
(1)LR重组反应、将pDONR221-GBSS(≥100 ng/μL)3 μL、LR ClonaseTMReaction Buffer 4 μL、5×LR ClonaseTMenzyme mix 4 μL、pJawohl8-RNAi(≥300 ng/μL)1 μL、ddH2O 8 μL于冰盒中溶解混匀,混匀后短暂离心,置于25℃下孵育过夜。反应物应为含有正反向目的片段且中间有内含子的干扰表达载体pJawohl8-RNAi-GBSS,取5 μL用于转化。
(2)转化。取100 μL DH5α感受态细胞,加入至上述反应体系中,冰上孵育30 min,然后42℃90 s,迅速回放于冰上2 min,涂布到含有氨苄青霉素的LB 固体培养皿上,37℃培养15 h。将LB 平板倒置,常温下随机挑选平板上的阳性克隆,PCR 法筛选重组克隆,电泳检测PCR 产物,选择出含目的片段的阳性克隆,再进行Acc65I、NheI与SpeI酶切鉴定。挑选阳性克隆接种到5 mL 含氨苄青霉素的LB 液体培养基中,37℃搖床培养15 h,提取质粒测序。
2 结果与分析
2.1 目的序列克隆
选定的序列是GBSS基因保守区域300 bp 序列。图1 泳道1、2 显示的为PCR 扩增出来的片段条带,该条带约为300 bp,符合预期大小,表明扩增出了所选的GBSS基因干扰片段。
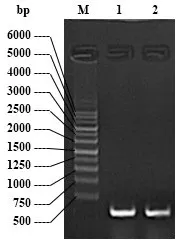
图1 目的基因GBSS干扰片段
2.2 GBSS干扰片段装入到入门载体后菌液PCR
attB-GBSS与pDONR221 进行BP 反应,发生特异性位点重组形成入门克隆pDONR221-GBSS与副产物。图2 为BP 反应后的菌液PCR,其泳道2、3 具有约400 bp(目的片段与接头引物)的清晰条带,表明入门载体pDONR221-GBSS已构建成功。

图2 BP反应后菌液PCR结果
2.3 LR 反应后干扰表达载体pJawohl8-RNAi-GBSS 酶切验证
入门载体pDONR221-GBSS与目标载体pJawohl8-RNAi的LR反应后转化大肠杆菌培养,干扰序列转入到目的载体,形成了所需的干扰表达载体pJawohl8-RNAi-GBSS,为进一步确定结果可靠性,需做酶切实验检测。
选择重组质粒载体上Acc65I、NheI与SpeI酶切验证。如图3所示,泳道1为pJawohl8-RNAi目的载体约9000 bp;泳道2 为pJawohl8-RNAi 的NheI 与SpeI 双酶切,显示有约4300 bp 与4700 bp 条带,NheI 与SpeI 分别在质粒的8084 bp 与3803 bp 位置,其计算结果与条带大小相符,因其长度大小太相近,2条条带接近在一起;泳道3为pJawohl8-RNAi的Acc65I酶切,因该载体无Acc65I 酶切位点,所以还是呈现与泳道1 大小一样的条带,所构建的pJawohl8-RNAi-GBSS干扰表达载体,其大小约6500 bp;泳道4 为pJawohl8-RNAi-GBSS干扰表达载体NheI 与SpeI 双酶切结果,考虑到上述NheI与SpeI酶切位点,所以应具有约4280 bp与2260 bp条带,泳道4 条带与结果相符;泳道5 为pJawohl8-RNAi-GBSS干扰表达载体Acc65I酶切结果,应具有约1020 bp与5500 bp条带,其大小与结果一致。泳道4、5的结果表明pJawohl8-RNAi-GBSS干扰表达载体构建成功。图4 显示了最终成功构建的pJawohl8-RNAi-GBSS质粒图谱。
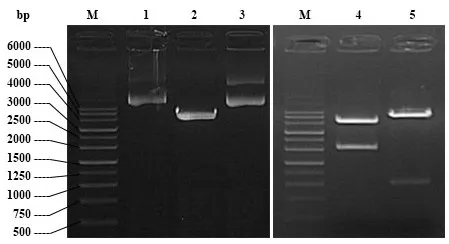
图3 干扰表达载体pJawohl8-RNAi-GBSS酶切结果
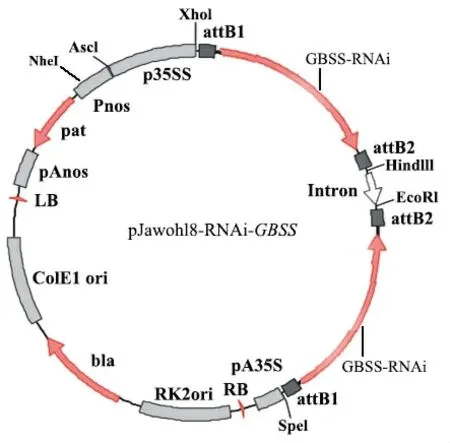
图4 最终构建的pJawohl8-RNAi-GBSS质粒图谱
2.4 干扰表达载体pJawohl8-RNAi-GBSS中目的片段测序结果
图5 为GBSS基因中300 bp 测序峰图结果,波峰、波谷清晰,峰与峰之间距离均匀,底部没有杂峰干扰,结果较好。
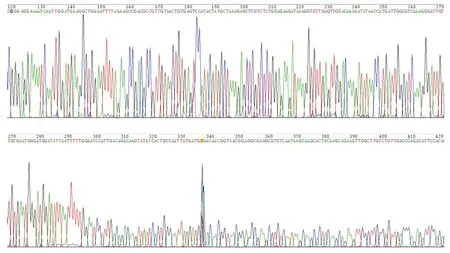
图5 目的干扰片段测序结果
3 讨论
食用百合组培鳞茎的形成发育与膨大生长是当前研究的热点。生产上需要较大的再生鳞茎作为种植籽球,以缩短基叶苗时期,种植收获期望较大的商品种球以增加经济效益,如何在籽球阶段做好其膨大发育对种植产业显得尤为重要。将复杂因素单一化的植物组培技术为研究百合鳞茎发育提供了良好环境。封闭的培养环境中百合组培苗对蔗糖碳源的吸收利用因不同调控因子对相关基因表达的影响,而使百合组培苗的生长发生方向性的变化,主要方向为愈伤丛生芽的增殖生长与鳞茎的形成发育膨大生长,除碳源浓度因子强烈影响鳞茎形成与膨大外,植物生长调节剂对基因表达调控也强烈影响鳞茎发育。GBSS是淀粉合成途径的主要酶类之一,其编码基因表达差异可能会对鳞茎发育生长所需的淀粉积累产生影响,因此对百合GBSS基因功能通过过表达或缺失表达研究以及环境因子对其调控机理研究有助于理解百合组培鳞茎的形成发育与膨大生长。
植物GBSS基因型通常有GBSSⅠ与GBSSⅡ[9,13-16],两者在基因序列和表达特异性等方面具有较大的不同。GBSSⅠ与GBSSⅡ两个异构型分别在种子、胚、胚乳、鳞茎等存储器官和根、茎、叶等非存储组织营养器官的淀粉合成中发挥作用[17-19]。本研究中设计的干扰片段是前期实验中克隆到的GBSSⅠ基因保守区域(登录号KP751445),该基因在鳞茎鳞片形成发育过程中有较高表达[20];通过Gateway 技术成功构建pJawohl8-RNAi-GBSS表达载体,为下一步进行遗传转化百合,干扰GBSS转录、鉴定相关功能提供了基础。后续进行农杆菌介导转化及转化株鉴定与功能分析将更直接阐明GBSS作用机理;同时还应进行过表达相关研究及调控GBSS表达差异因子研究,全面理解调控因子、基因表达、鳞茎膨大发育等之间的内在作用机制。
——一道江苏高考题的奥秘解读和拓展

