草莓枯萎病拮抗菌JM-3的鉴定及生防效果评价
姜莉莉,孙守民,杨 帅,武 冲,孙瑞红
(1山东省果树研究所,山东泰安 271000;2山东农业大学植物保护学院,山东泰安 271018)
0 引言
草莓(Fragaria ananassaDuchesne)为蔷薇科草莓属宿根性草本植物,其果实汁多味美、营养价值高,深受消费者喜爱,是中国重要的园艺作物[1]。近年来,随着草莓产业的发展,种植面积不断扩大,连作问题日益凸显[2],土壤微生物区系恶化,草莓枯萎病菌等土传病害发生普遍,危害程度也逐年加重[3]。草莓枯萎病病原菌为半知菌亚门瘤座菌科尖孢镰刀菌草莓专化型(Fusarium oxysporumf.sp.Fragariae),其可通过菌丝体或厚垣孢子随病残体在土壤中越冬。该病原菌从根部侵染草莓,在植株体内增殖、蔓延,堵塞维管束组织,破坏植株正常输导机能,引起植株萎蔫[4]。
对于草莓连作所致枯萎病的防治,主要包括化学防治、抗病育种和生态防控等手段[5],其中化学防治具有较高的环境生态代价和抗药性风险[6],而抗病育种则存在育种周期长、成本较高等问题[7]。随着2020 年农药“零增长”战略的全面实施,生态防控已成为作物病虫害防治领域的研究热点。生防菌因具有成本低、环境友好等特点而受到国内外植保工作者的广泛关注[8]。卜春亚等[9]通过自然选育、紫外-微波诱变获得草莓根腐病拮抗细菌GF-16,并进行了发酵条件优化。Sun 等[10]报道生防菌解淀粉芽孢杆菌L-1 对梨轮纹病的防效达76.55%,且可提高梨果实的POD 酶和CAT酶活性。刘程程等[11]从森林土壤中筛选出1株对草莓炭疽病菌具有较强拮抗活性的萨拉曼卡假单胞菌Pseudomonas helmanticensis,但尚未用于生产实践。目前,对于草莓枯萎病的拮抗菌报道较少,且多处于实验室研究阶段。为丰富草莓枯萎病生物防治资源,助力草莓病害节药防控,作者前期从山东省泰安市岱岳区大棚草莓根际分离得到1株对草莓枯萎病菌具有较高拮抗效果的生防菌株JM-3,已在中国微生物菌种保藏管理委员会普通微生物中心进行菌种保藏(No.15444)。本研究拟通过形态学、生理生化和分子生物学手段对生防菌JM-3进行鉴定,并对菌液进行初步加工,评价其对草莓枯萎病的防治效果,为新型生防制剂的开发及草莓可持续绿色生产提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 草莓枯萎病菌采自山东省烟台市招远市枯萎病发生严重的草莓大棚,经分离、纯化、柯赫氏法则鉴定后供试。生防菌株JM-3 采自山东省泰安市岱岳区房村镇种植年份长、长势较好的草莓大棚,经分离、纯化后供试。
1.1.2 供试培养基PDA 培养基用于草莓枯萎病菌的平板培养,PD 培养基用于草莓枯萎病菌的液体培养,LB培养基用于生防菌的培养和保存。
1.2 试验方法
1.2.1 生防菌株JM-3 的形态学鉴定 在超净工作台上将活化好的JM-3 菌株接种于LB 固体培养基,28℃黑暗培养24 h,目测菌落的颜色、大小、形状、透明度、边缘整齐性等,并进行扫描电镜观察[12]。
1.2.2 生防菌株JM-3 的生理生化鉴定 采用青岛海博生物技术有限公司的HBIG14 微生物生化鉴定条,进行V-P、明胶液化、柠檬酸、D-甘露醇、革兰氏染色、硝酸盐还原、吲哚、淀粉水解等鉴定。
1.2.3 生防菌株JM-3 的分子鉴定 在超净工作台上挑取生防菌JM-3 单菌落,接种到LB 液体培养基中,28℃、150 r/min 摇床培养24 h。采用北京天根生化科技有限公司的细菌基因组DNA 提取试剂盒抽提生防菌JM-3 的基因组DNA。采用细菌通用引物27F/1492R 进 行16S rDNA 序 列扩增,采用L100/R836 和UP1/UP2r特异性引物分别进行gyrA和gyrB基因序列扩增[7],引物序列见表1。PCR产物委托上海生工生物股份有限公司进行测序,序列上传NCBI 并进行BLAST 同源性比对,以MEGA6.0 构建菌株的系统发育树(Bootstrap=1000)[13]。
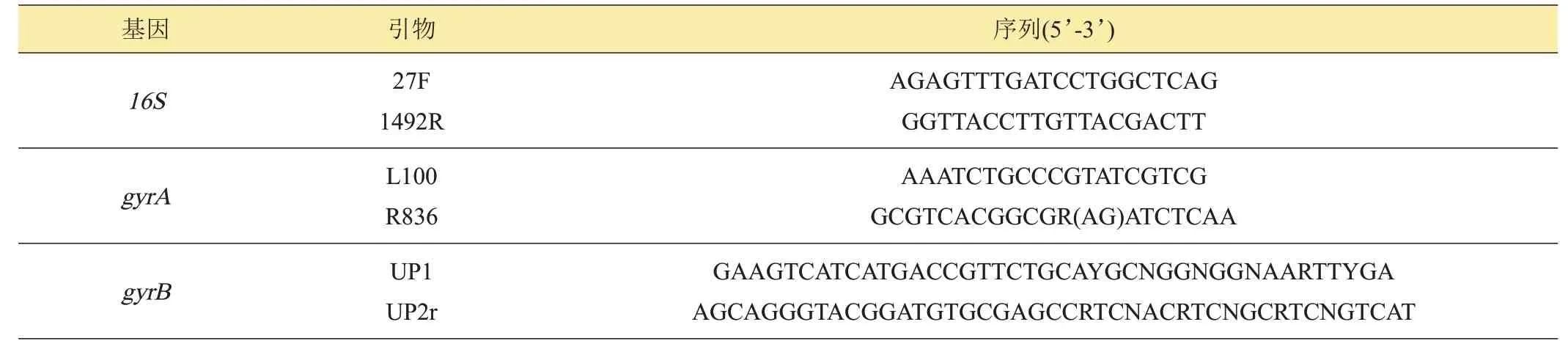
表1 扩增基因及引物序列
1.2.4 菌剂加工 以接种环挑取JM-3菌株单菌落,接种于100 mL LB液体培养基中,28℃、150 r/min摇床培养24 h 制备种子液。将1 L 种子液接种至装有50 L LB液体培养基、总容积为100 L的发酵罐(上海百仑生物科技有限公司,BLBIO-100SJ)中,30℃、溶氧量100%、转速300 r/min发酵24 h制备二级发酵液。菌液离心,取沉淀物与载体(黄腐酸钾:硅藻土:腐殖酸=1:1:3)混合、搅拌、过筛,以平板菌落计数法[14]测定菌量,制备菌体浓度为2×108CFU/g的粉末状固体制剂。
1.2.5 生防菌JM-3 的室内抑制率测定 采用平皿对峙法[15],将保存的草莓枯萎病菌活化,在菌落边缘打取直径7 mm的菌饼,接种于PDA培养基平板中央,以灭菌牙签挑取拮抗菌JM-3 菌落接种于距离菌饼圆心2 cm的4 个方位上。同时设空白对照,每个处理设4 个重复,每个重复1 皿。28℃培养5 天后,采用十字交叉法测量草莓枯萎病菌菌落直径(mm),计算抑制率。

1.2.6 生防菌JM-3 对草莓枯萎病的盆栽防效测定 在直径9 cm 的PDA 培养基平板中央接种直径7 mm 的菌饼,28℃黑暗培养5天后,移取每皿全部菌丝及孢子于20 mL 灭菌去离子水中,制得病原菌液。将土壤120℃灭菌30 min后冷却,装于直径15 cm的塑料花盆中,每盆约1 kg,接种20 mL病原菌液,移栽5叶1心草莓幼苗,品种为‘丰香’。处理1:每盆草莓根际浇灌20 mL菌体浓度为2×108CFU/mL的生防菌JM-3菌液;处理2:每盆草莓根际拌土处理20 g 菌体浓度为2×108CFU/g的生防菌JM-3固体制剂;处理3:每盆草莓根际施用20 mL 50%多菌灵可湿性粉剂1000倍液;处理4:对照组不进行处理。每个处理重复3次,每个重复10盆。采用常规栽培管理,分别于移栽后30、60、90天调查各处理的草莓枯萎病病情指数,并计算相对防效。
草莓枯萎病的田间发病程度可分为5 级[16]:0 级——无任何症状;1级——茎基部稍显病斑或稍变色;2 级——茎基部有病斑,但未连成片;3 级——茎基部病斑连片发生,但面积小于1/2;4 级——病斑环绕茎基部;5级——植株死亡。

以上试验在山东农业大学农药毒理与应用技术省级重点实验室,于2018年9月—2019年8月进行。
1.2.7 生防菌JM-3 对草莓的田间应用效果 田间试验选址于山东省泰安市岱岳区房村镇的连作草莓大棚,枯萎病发生较重。试验共设4个处理,每个处理重复3次。每个小区长10 m,宽2 m,面积20 m2,约种植草莓240株。处理1:按照240 mL/m2剂量灌施1.2.4所述的生防菌JM-3液体制剂;处理2:按照240 g/m2剂量撒施1.2.4所述的生防菌JM-3固体制剂;处理3:按照240 mL/m2剂量灌施50%多菌灵可湿性粉剂1000倍液;处理4:对照组未处理。随机区组排列,处理间设保护行。
2019 年8 月27 日移栽5 叶1 心期草莓幼苗,采用常规栽培管理,每隔30天调查1次各小区的草莓枯萎病发病株数,统计发病率,并计算相对防效,连续3次。11月27日采集草莓果实测定单果重、糖酸比和可溶性固形物含量。各小区草莓果实随成熟随采收,并统计累积产量。

2 结果与分析
2.1 生防菌JM-3的形态学鉴定
在LB 培养基上28℃培养24 h,JM-3 菌株单菌落呈乳白色,半球状隆起,不透明,表面湿润,边缘光滑,单菌落直径为1.31~3.42 mm(图1)。扫描电镜发现,菌体为杆状,表面有褶皱(图2)。
图1 JM-3菌落形态

图2 JM-3电镜图片
2.2 生防菌JM-3的生理生化鉴定
由表2 可以看出,生防菌JM-3 为革兰氏阳性细菌,V-P 反应、明胶液化、柠檬酸、淀粉水解、硝酸盐还原、接触酶、氧化酶、D-甘露醇试验均为阳性,吲哚试验为阴性。

表2 生防菌JM-3的生理生化鉴定结果
2.3 生防菌JM-3的分子鉴定
通过16s rDNA 序列测定,得到长度为1413 bp 的基因序列片段,NCBI 登录号为MG841149,经过序列比对,与模式菌株Bacillus velezensisB-41580(NCBI登录号EU138484)相似度最高(图3)。通过gyrA和gyrB序列测定,分别得到长度为717 bp和1258 bp的基因片段,NCBI 登录号分别为MT634152 和MT634153。经过序列比对,分别与贝莱斯芽孢杆菌B.velezensisQ3B3(NCBI 登录号MK775701)和K2(NCBI 登录号MN365038)相似度最高(图4 和图5)。因此,将菌株JM-3鉴定为贝莱斯芽孢杆菌B.velezensis。
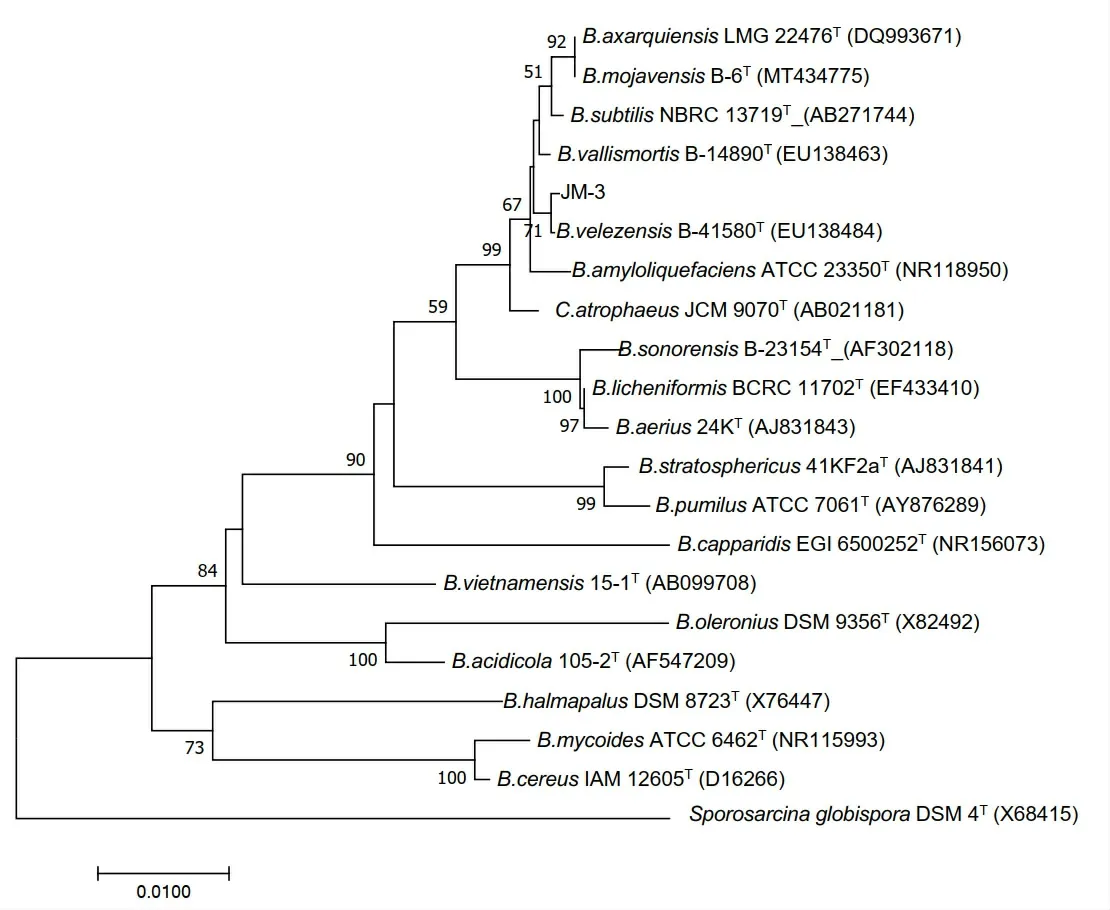
图3 JM-3菌株16S系统发育树
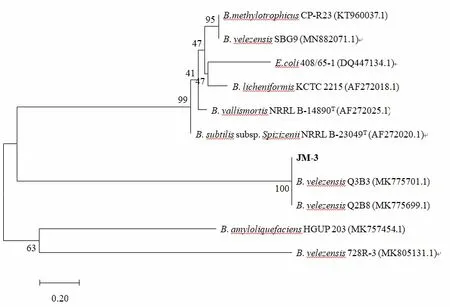
图4 JM-3菌株gyrA系统发育树

图5 JM-3菌株gyrB系统发育树
2.4 生防菌JM-3对草莓枯萎病菌的抑制率
生防菌JM-3 与草莓枯萎病菌的对峙效果如图6所示,拮抗作用显著。由表2 可知,生防菌JM-3 对草莓枯萎病菌的抑制率为57.42%。
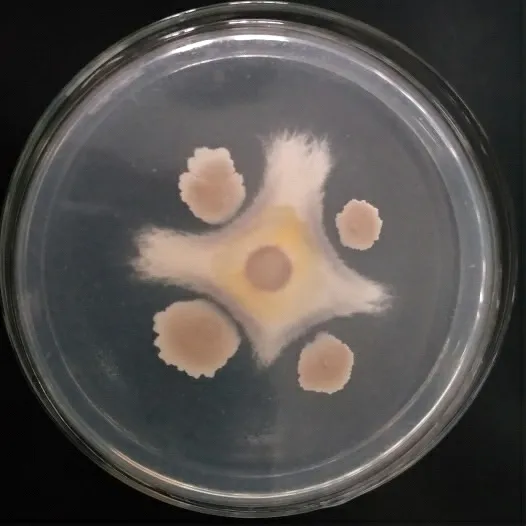
图6 生防菌JM-3对草莓枯萎病菌的抑制效果
2.5 生防菌JM-3对草莓枯萎病的盆栽防效
由表4可知,在室内接种草莓枯萎病菌的情况下,对照组的病情指数随时间推移逐渐升高。处理后30天,多菌灵拌土的防效为80.00%,高于生防菌JM-3菌液和固体制剂的66.67%和73.33%;处理后60天,固体制剂的防效为75.86%,高于菌液和多菌灵的68.97%和72.41%;处理后90天的结果与60天相似,固体制剂的防效最高,为83.02%,菌液和多菌灵的防效分别为75.47%和77.36%。由此可见,生防菌固体制剂的持效性最高。
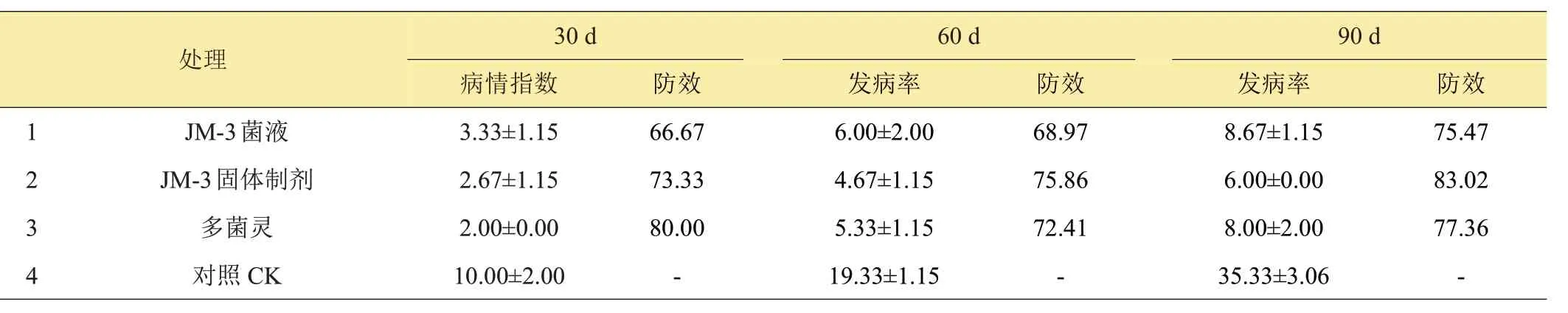
表4 生防菌JM-3对草莓枯萎病的盆栽防效
2.6 生防菌JM-3对草莓枯萎病的田间防效
生防菌JM-3 微生物制剂对草莓枯萎病发病率的田间防效如表5所示。移栽后30天,多菌灵土壤处理对草莓枯萎病的防效最高,为70.98%;移栽后60 天和90 天,生防菌固体制剂的防效最高,分别为79.83%和80.00%,多菌灵次之,分别为77.22%和76.86%。可见生防菌JM-3 固体制剂土壤处理对草莓枯萎病的防效具有较长持效期。
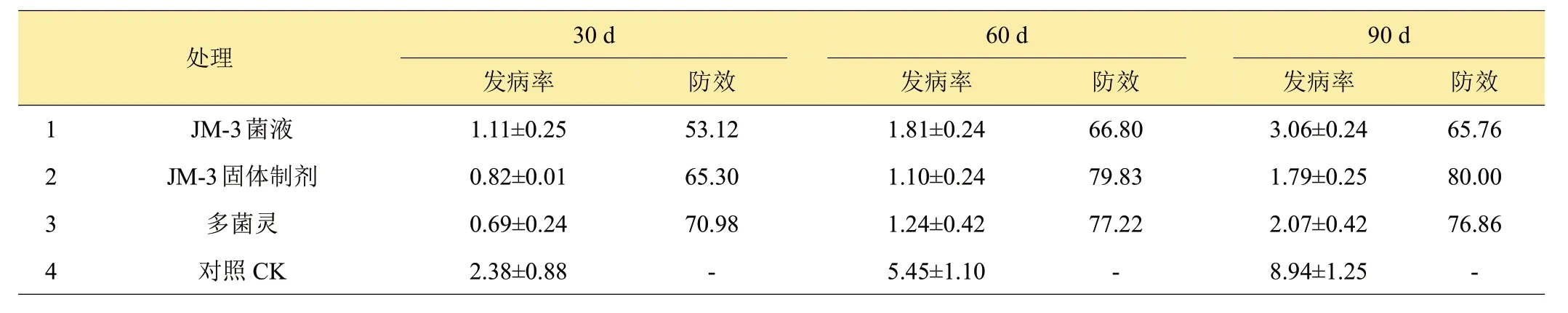
表5 生防菌JM-3对草莓枯萎病的田间防效 %
2.7 生防菌JM-3对草莓果实品质及产量的影响
由表6可以看出,生防菌JM-3液体和固体制剂处理的草莓果实糖酸比分别为8.88 和8.90,显著高于多菌灵处理的8.49 和对照的8.20;生防菌JM-3 液体、固体制剂和多菌灵处理的小区产量分别为49.47、51.37和51.93 kg,显著高于对照的36.90 kg。同时,生防菌JM-3 对草莓果实单果重和可溶性固形物含量无显著影响。
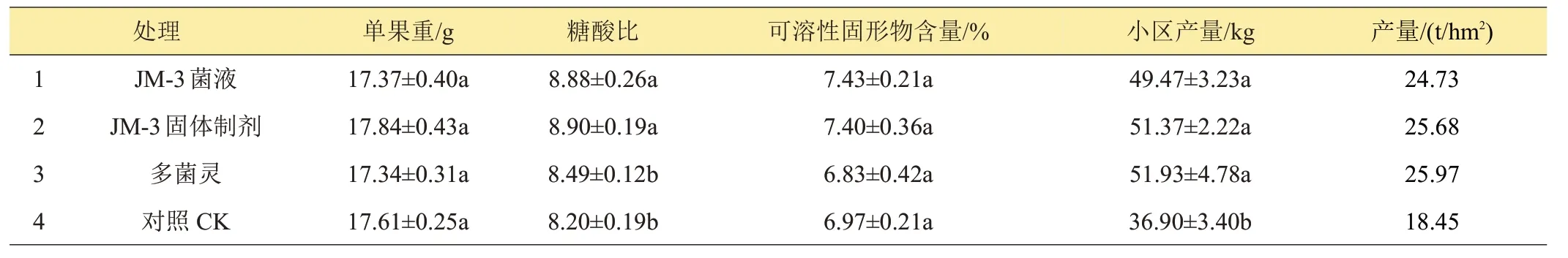
表6 生防菌JM-3对草莓果实品质和产量的影响
3 讨论与结论
对于同源性较高的细菌,不能仅通过16S 测序进行种属鉴定。研究表明,编码蛋白质基因具有较高的遗传变异,可用于密切相关种群的分类与鉴定[17]。gyrA和gyrB作为系统发育鉴定标记,可有效弥补16S序列的不足[18-19]。本研究通过形态学、生理生化特征分析和16S、gyrA及gyrB基因序列比对,将筛选得到的拮抗菌JM-3 鉴定为贝莱斯芽孢杆菌B.velezensis,鉴定结果较为可靠。
贝莱斯芽孢杆菌是芽孢杆菌中的一个新种,近年来作为益生菌在农业、食品、环保、医学等领域被广泛研究,其中在农业领域可被用于拮抗病原微生物和促
进作物生长[20]。张琼等[21]报道,贝莱斯芽孢杆菌SZAD1 种子浸泡和灌根处理对棉花黄萎病的防效分别为60.10%和56.00%。刘雪娇等[22]报道,贝莱斯芽孢杆菌3A3-15对尖孢镰刀菌孢子萌发抑制作用较强,且可导致菌丝扭曲、膨大和畸形。张小利等[23]报道,贝莱斯芽孢杆菌NSZ-YBGJ001 对草莓白粉病的叶部防效达86.64%,果实防效达71.08%。目前,贝莱斯芽孢杆菌用于草莓枯萎病的防治尚未见报道。本研究采用平板对峙试验发现,分离鉴定得到的贝莱斯芽孢杆菌JM-3 对草莓枯萎病菌的拮抗作用显著,抑制率为57.42%,可有力地丰富草莓枯萎病的生物防治资源。
生防菌制剂化对菌体的定殖能力及生防效果的发挥影响较大[24]。黄洁雪等[25]报道,添加有机物料可以提高生防微生物制剂的稳定性及其对草莓灰霉病的防治效果。本研究前期筛选确定了生防菌JM-3 菌体浓度为2×108CFU/g 的粉末状固体制剂,盆栽病情指数试验发现,处理后90天,拮抗菌JM-3固体制剂对草莓枯萎病病情指数的防效为83.02%,高于菌液和多菌灵处理的75.47%和77.36%。田间试验发现,移栽后60天和90 天,生防菌JM-3 固体制剂对草莓枯萎病发病率的防效最高,分别为79.83%和80.00%,可见该拮抗菌的固体制剂化可提高菌株的持效性和防治效果。

表3 生防菌JM-3对草莓枯萎病菌的室内抑制作用
大量研究表明,生防菌株在拮抗有害生物的同时,还具有促生和增产的作用[26]。王星等[27]报道,生防菌株L1对水稻细菌性条斑病的防效较高,且可使水稻增产10%以上。王夏雯等[28]报道,解淀粉芽孢杆菌B1619 对西瓜枯萎病具有较高的防效,还可提升西瓜果实品质。本研究发现,生防菌JM-3液体和固体制剂处理的草莓果实糖酸比分别为8.88 和8.90,较多菌灵处理和对照显著提高,但不同制剂间差异不大,可见该菌株对草莓果实品质有一定的提升作用。产量测定发现,生防菌JM-3液体和固体制剂处理与多菌灵处理间差异不大。在后续研究中,将通过进一步改良载体配方、优化菌剂加工工艺、制定配套措施等手段,提升菌株JM-3 制剂在草莓枯萎病防治及促生方面的应用效果,助力草莓绿色生产。
综上,草莓枯萎病拮抗菌JM-3经生理生化和分子生物学鉴定为贝莱斯芽孢杆菌B.velezensis,其对草莓枯萎病菌的平板对峙抑制率为57.42%。盆栽病情指数试验和田间发病率试验结果一致表明,该拮抗菌对草莓枯萎病具有较高的防效,且固体制剂化可提高菌株的持效性和防治效果。同时,该菌株液体和固体制剂均可显著提高草莓果实的糖酸比,提升草莓品质,具有较好的应用前景。

