多菌灵在果园白三叶青贮中的降解及其对微生物群落的影响
戈建珍,傅文慧,张露,蔺宝珺,赵帅,白玛噶翁,寇建村
(西北农林科技大学草业与草原学院,陕西杨凌 712100)
果园生草是草本植物与果树协调共生的生态果园地面管理模式,作为现代果园土壤管理先进技术,近年来大量研究表明果园生草在农业生态系统中具有十分重要的作用[1-3]。随着现代果园生草种植在我国快速发展,果园生草资源利用得到广泛的关注,研究主要集中在果园生草刈割后返园或堆肥[4-5]。但果园生草不及时刈割,或直接返园后易引发病虫害[6],果园白三叶(Trifolium repens)刈割后通过埋置或覆盖的方式返园,其降解速度较慢,需时较长[7]。因此,高效科学地利用这些物质资源具有重要意义,而将果园覆盖白三叶作为动物饲料来利用是一种重要的途径。果园生草是重要的饲料来源,由于果树管理过程中大量使用农药,使得果园覆盖植物作为饲料有很大的健康风险。因此,采用科学有效的方法降低果园覆盖植物白三叶上的农药残留,将其作为动物饲料来利用具有重要的意义。
多菌灵广泛应用于果园生产中的病害防治,能有效防治由真菌(如多子囊菌、半知菌)引起的病害,但也是一类典型的降解缓慢、水溶性低、持久性强的有机污染物[8],因其结构稳定性较高,半衰期较长以及不科学合理地使用,导致土壤环境、动物饲草料和动物源食品中多菌灵农药残留含量较高[9]。青贮可以降解多种农药,青贮微生物在饲料发酵过程中起着决定性的作用,是饲草调制成高品质青贮饲料的关键,对青贮过程中原料营养成分的保留[10]、pH 的降低[11]、青贮有害菌的抑制[12]、青贮饲料有氧稳定性[13]以及污染物降解转化[14]等有重要意义。发酵过程中微生物对化学物品的生物降解是许多有机化合物分解的最重要机制之一[15]。同时,青贮微生物多样性及其代谢产物也反映了青贮饲料发酵的基本状况[16]。而多菌灵作为杀菌剂,在青贮发酵过程中能否对青贮微生物产生一定的影响,进而影响青贮发酵的品质,尚未报道。
目前,关于多菌灵农药与微生物关系的研究主要集中在土壤中多菌灵降解菌的筛选[17]、多菌灵降解的微生物群落[18],以及多菌灵对土壤微生物的毒性[19]等方面。关于青贮发酵对多菌灵农药的降解及其对青贮发酵过程中微生物群落的影响研究甚少。本研究以黄土高原优势果园草—白三叶为材料,喷施不同浓度多菌灵为处理,在青贮60 d 后对多菌灵残留、乳酸、乙酸、丙酸、pH、氨态氮、干物质、粗蛋白和粗纤维等一系列指标进行了检测,同时,测定了青贮发酵关键期(0,3,60 d)的微生物群落。旨在研究青贮发酵条件下,不同浓度多菌灵的降解情况及其对微生物群落的影响,为果园覆盖植物资源作为青贮饲料利用的安全性以及为种养结合、“林-草-畜”可持续发展循环农业模式提供新思路和理论依据。
1 材料与方法
1.1 试验区概况
白三叶采自陕西省咸阳市杨凌区现代农业创新园苹果试验基地(108°02'E,34°18'N)。试验区苹果园年平均气温12.9 ℃,无霜期211 d,年平均降水量635.1 mm,年均日照时数2163 h,年总太阳辐射量480.90 kJ·cm-2,日照充足,昼夜温差大。苹果园占地5.3 hm2,土壤为黑垆土。试验区种植果树品种为“长富2 号”,果树行间距4 m,株间距2 m,行间种植白三叶。
1.2 青贮前处理
由于缺乏适当的监督和监管,多菌灵农药的使用量远超出建议施用的水平[20],所以本试验用2.0(RU-)、2.5(RU)、3.0 g·L-1(RU+)多菌灵对处于盛花期白三叶进行农药喷施,喷施等量水作为对照(CON),待各组叶面所喷液体自然挥发后,割取白三叶放到无菌袋中,迅速带回实验室,将所取材料切至2~3 cm 长,添加2%蔗糖(20 g)混合均匀后,装入1 L 青贮罐中,每瓶约800 g,压实后密封,重复3 次,放置到室温下青贮,用于检测农药残留及营养指标的测定。对喷施3 g·L-1多菌灵处理进行微生物群落测定,在青贮当天(0 d)取样标记为A 组;第3天取样,不喷多菌灵记为B 组,喷施多菌灵记为C 组;第60 天开罐取样,喷多菌灵记为D 组,不喷施多菌灵记为E组,3 次重复,用16S MetaVx™方法检测各处理中主要微生物菌群在青贮过程中的群落动态变化。
1.3 青贮后取样
白三叶青贮60 d 时,从瓶中取出青贮饲料、混匀,称20 g,加180 mL 蒸馏水,搅拌均匀,用封口膜封口,于4 ℃静置24 h,四层纱布过滤,再用漏斗过滤,用于pH、有机酸、可溶性糖(water soluble carbohydrates,WSC)及氨态氮的测定;取样150 g 于65 ℃烘箱烘至恒重后粉碎,用于测定干物质(dry matter,DM),粗蛋白(crude protein,CP),粗纤维(crude fiber,CF),酸性洗涤纤维(acid detergent fiber,ADF),中性洗涤纤维(neutral detergent fiber,NDF),含水量。在青贮第0,3,60 天开罐取样,用超纯水浸泡并不断搅拌,用细菌滤膜过滤,全程在无菌条件下进行,在-80 ℃冰箱保存用于测定微生物群落。
1.4 测试及分析
通过梅特勒-利多DELTA320 pH 计(上海仪电科学仪器股份有限公司,上海)测定pH,通过高效液相色谱法测定青贮饲料中的有机酸含量,采用苯酚-次氯酸钠比色法测定氨态氮含量,采用蒽酮-硫酸比色法测定可溶性碳水化合物含量,通过凯氏定氮法测定青贮饲料的粗蛋白含量,酸碱消煮法、中性洗涤剂法、酸性洗涤剂法测定青贮饲料粗纤维、ADF、NDF 含量,烘干法测定干物质含量,用残余法(SOX406 脂肪测定仪)测定粗脂肪含量,进行青贮后化学成分分析[21],采用液相色谱-串联质谱法测定多菌灵农药残留量[22]。高通量测序文库构建和Illumina MiSeq 测序是由GENEWIZ 公司(中国苏州)使用MetaVx™文库构建试剂盒(GENEWIZ,南平原,新泽西州,美国)来构建测序文库。采用包含“CCTACGGRRBGCASCAGKVRVGAAT”序列的上游引物和包含“GGACTACNVGGGTWTCTAATCC”序列的下游引物扩增V3 和V4 区。另外,通过PCR 向16S rDNA 的PCR 产物末端加上带有Index 的接头,以便进行高通量测序(next generation sequencing,NGS)测序。
1.5 数据处理
用SPSS 22 和Microsoft Office Excel 2010 软件对数据进行处理,单因素方差分析采用One-way ANOVA,采用Duncan 平均值多重比较分析法对农药降解率、品质指标等数据进行分析。对原始数据进行去接头和低质量过滤处理,然后去除嵌合体序列,得到有效序列后进行聚类分析,每一个聚类称为一个物种操作单元(operational taxonomic units,OTU),对OTU 的代表序列作分类学分析,得到各样本的物种分布信息。基于OTU 分析结果,对各个样本进行多种α 多样性指数分析,得到各样本物种丰富度和均匀度等信息;基于分类学信息,在各个分类水平上进行群落结构的统计分析;通过计算Unifrac 距离、构建UPGMA 样本聚类树、绘制PCoA 图等,直观展示不同样本或分组之间群落结构差异。
2 结果与分析
2.1 不同浓度多菌灵对白三叶青贮品质及其营养成分的影响
本研究中,没有检测到丁酸,与对照相比,不同浓度多菌灵处理均显著提高了白三叶青贮发酵乳酸、乙酸、丙酸的含量(P<0.05),乳酸在多菌灵RU-、RU、RU+浓度下分别增加了47.55%、63.24%、71.08%,乙酸分别增加了24.49%、44.90%、46.94%,丙酸分别增加了66.67%、187.50%、250.00%,并随着多菌灵喷施浓度的增加而增加。在RU+浓度下乳酸、乙酸、丙酸含量最高,pH 的变化与乳酸、乙酸、丙酸含量变化趋势相吻合,随着有机酸的增加pH 值减小(表1)。

表1 多菌灵对果园白三叶青贮饲料品质及营养价值的影响Table 1 Effect of carbendazim on the quality and nutritional value of white clover silage in orchard
喷施多菌灵的白三叶青贮60 d 后的DM 含量表现为RU、RU+处理显著低于对照,RU-处理低于对照,但差异不显著(P>0.05)。不同浓度处理的CP 含量均显著高于对照(P<0.05),表现为RU+>RU->RU>对照。氨态氮含量与CP 含量变化趋势相反,RU-、RU+处理下氨态氮含量均显著低于对照(P<0.05)。CF 表现为RU+处理显著高于对照。在不同浓度多菌灵处理下,ADF、NDF 含量均高于对照;ADF 含量随着农药浓度的增加先增后减,在RU 处理下含量最高;NDF 含量随着农药浓度的增加逐渐减小,喷施多菌灵对白三叶青贮粗脂肪无显著影响。
2.2 白三叶青贮发酵后不同浓度多菌灵的降解
为了确定青贮后不同浓度多菌灵农药的降解程度,在实验室进行了模拟筒仓青贮发酵的试验。将含有初始浓度为37.52,46.88,56.28 mg·kg-1多菌灵的白三叶进行青贮发酵,在发酵后,多菌灵降解情况如图1 所示。可以看出,RU-浓度多菌灵处理下经过60 d 青贮发酵后多菌灵残留为15.15 mg·kg-1,RU 处理浓度下多菌灵残留浓度为16.30 mg·kg-1、RU+处理为16.50 mg·kg-1。3 个处理浓度下(RU-、RU、RU+)多菌灵的降解率分别为59.62%、65.23%、70.68%,并随着多菌灵浓度的增加降解率逐渐增加。
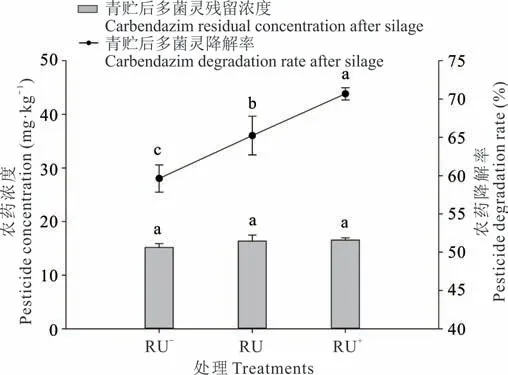
图1 果园生草白三叶青贮发酵过程对不同浓度多菌灵降解率的影响Fig. 1 The effect of the fermentation process of orchard grass white clover silage on the degradation rate of different concentrations of carbendazim
2.3 果园生草白三叶青贮过程中微生物群落动态变化
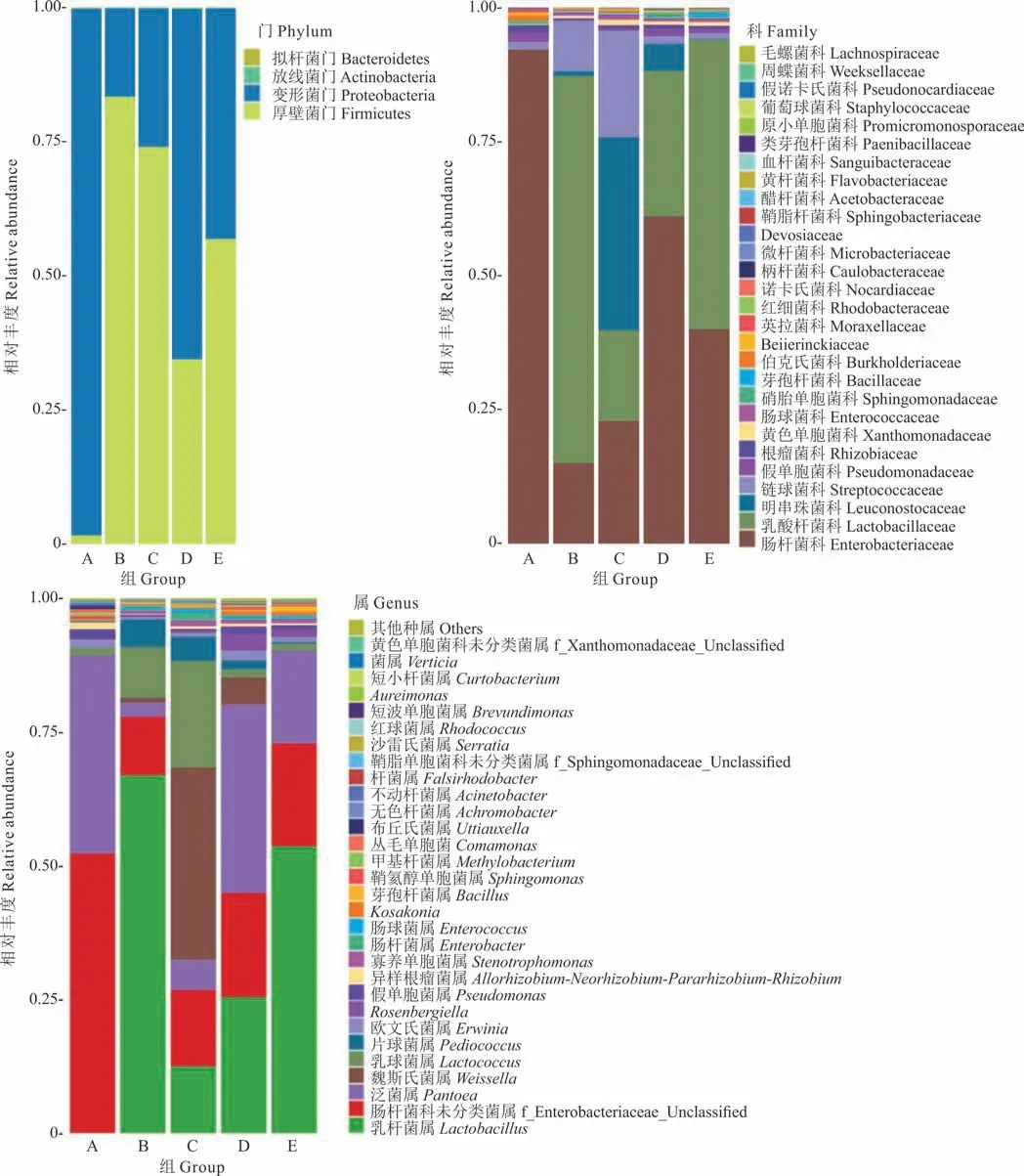
2.3.1序列数据预处理及微生物群落结构多样性分析 分别取青贮第0,3,60 天的青贮样品DNA,用16S MetaVx™方法检测各处理中主要微生物菌群在青贮过程中的群落动态变化。为了得到更高质量及更准确的生物信息分析结果,对测序原始数据进行优化处理。本试验中的5 个样品共获得了337551 条有效序列,经过优化选择了301819 条去除嵌合体后有效序列,平均每个样品约60364 条序列。在97%的序列相似性标准下,共得到了433 个OTUs,分属于5 个门,6 个纲,17 个目(表2),A、B、C、D 和E 组分别有2、0、2、1 和1 个独特的OTU(图2)。
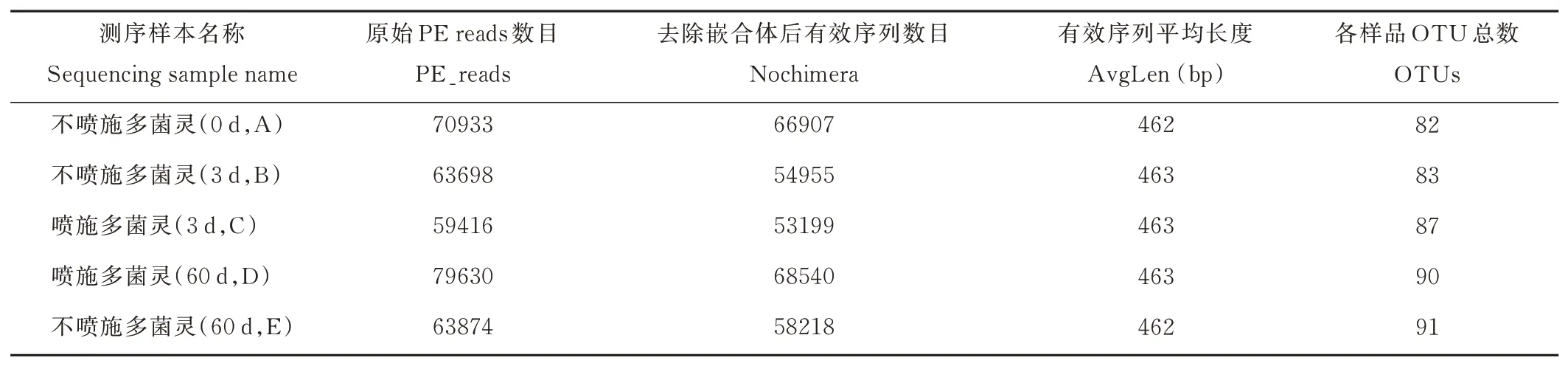
表2 优化后数据质量统计Table 2 Data quality statistics after optimization
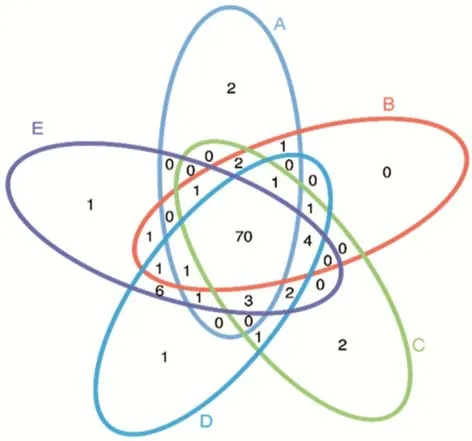
图2 OTU 韦恩图Fig.2 OTU Venn diagram
2.3.2微生物群落α 多样性分析 在本研究中,用Chao 1 指数显示菌群丰富度(community richness)(图3a),用Shannon 指数显示菌群多样性(community di‐versity)(图3b)。结果表明,青贮3,60 d 时菌群丰度、多样性均高于0 d,青贮3 d 时喷施多菌灵处理组(C)菌群丰度、多样性均高于不喷多菌灵处理组(B),青贮60 d 时喷施多菌灵处理组(D)菌群丰度与不喷多菌灵处理组(E)无差异,喷施多菌灵处理组菌群多样性显著高于不喷施多菌灵处理组。添加多菌灵白三叶青贮60 d 与3 d 相比,菌群丰度表现为C>D、多样性表现为C 图3 DNA 序列数据和微生物多样性指数分析Fig.3 DNA sequence data and microbial diversity index analysis 2.3.3喷施多菌灵的白三叶青贮发酵过程中菌群结构分析 图4 中PC1、PC2 和PC3 轴分别可以解释46.73%、24.87% 和13.44% 的微生物群落结构差异,3 个主成分累计解释了样品中细菌群落组成变化的85.04%。5 个不同处理青贮样品点分布较为分散,说明各处理间微生物群落构成存在差异。青贮3 d时,喷施多菌灵处理组(C)与不喷施多菌灵处理组(B)样本点距离较远,说明微生物群落结构差异较大。随着时间的推移,在青贮60 d 时,喷施多菌灵处理组(D)与不喷施多菌灵处理组(E)样本点距离出现显著聚合现象,说明微生物群落结构差异减小。 图4 基于Unifrac 距离的PCoA 分析Fig.4 PCoA analysis based on Unifrac distance 在不同的分类水平上分析了多菌灵对白三叶青贮中细菌的群落组成和结构的影响(图5)。青贮细菌菌群门水平分布包括4 个门(phylum),主要由拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)组成。5 个处理组中变形菌门、厚壁菌门占比较多,青贮3 d 时,B与C 组相比,多菌灵的喷施减少了厚壁菌门的相对丰度,增加了变形菌门的相对丰度。青贮60 d 时,D 与E组相比,菌群丰度变化与青贮3 d 时变化趋势一致。青贮60 d 与3 d 相比,喷施多菌灵处理主要菌群表现为变形菌门丰度增加,厚壁菌门丰度减少。 图5 细菌群落分布Fig.5 Bacterial community distribution 青贮细菌菌群科水平分布包括28 个科(family),包括乳酸杆菌科(Lactobacillaceae)、明串珠菌科(Leuconostocaceae)、链球菌科(Streptococcaceae)、肠杆菌科(Enterobacteriaceae)、假单胞菌科(Pseudomonadaceae)和芽孢杆菌科(Bacillaceae)等主要菌群。青贮3 d时,B 与C 组相比,多菌灵的喷施减少了乳酸杆菌科、链球菌科的相对丰度,增加了明串珠菌科、肠杆菌科、假单胞菌科、芽孢杆菌科的相对丰度。青贮60 d 时,D 与E 组相比菌群丰度变化与青贮3 d 时趋势一致。青贮60 d 与3 d相比,喷施多菌灵处理主要菌群表现为乳酸杆菌科、肠杆菌科丰度增加,假单胞菌科、芽孢杆菌科、链球菌科、明串珠菌科丰度减少。 青贮细菌菌群属水平分布包括53 个属(genus),主要包括:泛菌属(Pantoea)、乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)、片球菌属(Pediococcus)、Rosenbergiella、假单胞菌属(Pseudomonas)、寡养单胞菌属(Stenotrophomonas)、肠杆菌属(Enterobacter)、芽孢杆菌属(Bacillus)等菌群。青贮3 d 时,B 与C 组相比,多菌灵的喷施减少了乳杆菌属、片球菌属的相对丰度,增加了乳球菌属、魏斯氏菌属、泛菌属、Rosenbergiella、假单胞菌属、寡养单胞菌属、肠杆菌属、芽孢杆菌属的相对丰度。青贮60 d 时,D 与E 组相比,菌群丰度变化与青贮3 d 时趋势一致。青贮60 d 与3 d 相比,喷施多菌灵处理主要菌群表现为泛菌属、乳杆菌属、Rosenbergiella丰度增加,片球菌属、乳球菌属、魏斯氏菌属、寡养单胞菌属、肠杆菌属、芽孢杆菌属丰度减少。 青贮发酵过程中产生有机酸的含量是评价青贮饲料发酵品质的重要因素[23],而青贮过程中pH 值的降低是由一些菌株通过发酵产酸来实现的[24]。研究结果中不同浓度多菌灵处理均显著提高了白三叶青贮发酵乳酸、乙酸、丙酸的含量,可能是因为多菌灵喷施增加了乳杆菌属等产酸微生物活性导致乳酸含量增加,例如有研究表明杀菌剂百菌清对苹果酸-乳酸发酵具有一定的促进作用[14,25]。前人研究表明,青贮发酵开始的前几天,好氧细菌比较活跃,随着时间推移,发酵体系中氧气被消耗完,乳杆菌属大量繁殖产生乳酸并降低pH,有利于抑制青贮的好氧细菌[24]。本研究中,青贮60 d 与3 d 相比,喷施多菌灵处理主要菌群表现为泛菌属、乳杆菌属、Rosenbergiella丰度增加,与前人研究一致。同时杀菌剂可以降低酵母的活性,促进乳酸菌等产酸微生物的代谢,例如He 等[26]研究表明杀菌剂百菌清可以有效抑制酵母发酵产生酒精。 CP 的降解是评估青贮饲料质量的重要标准之一,CP 降解脱氨生成氨态氮[27],芽孢杆菌属中专性厌氧菌的生长或蛋白水解酶的活性是导致青贮饲料CP 降解的主要因素[28]。本研究中喷施多菌灵农药处理较对照中芽孢杆菌属的相对丰度减少,这可能是氨态氮含量低于对照,而CP 含量高于对照的原因。而在不同浓度多菌灵处理下,CF、ADF、NDF 的研究结果可能是因为多菌灵农药的喷施影响了降解纤维微生物的代谢活性,或者是因为多菌灵的喷施导致乙酸含量增加,间接影响降解纤维微生物的活性。前人研究表明,梭菌属、纤维杆菌属、杆菌属、瘤胃球菌属是可以有效降解纤维的微生物[29],Fang 等[30]的研究表明杀菌剂戊唑醇可以显著抑制土壤中梭菌属微生物活性,Kato 等[31]的研究表明乙酸可以抑制5 种能有效降解纤维的微生物(Clos-tridium straminisolvensCSK1,Clostridiumsp. strain FG4,Pseudoxanthomonassp. strain M1-3,Brevibacillussp. strain M1-5,Bordetellasp.strain M1-6)的降解作用,本研究中多菌灵处理乙酸含量显著高于对照与之相吻合,但具体原因还需进一步研究。 多菌灵农药广泛应用于各种作物,农药使用不当、过量造成环境污染并对牲畜及人类健康产生危害。世界各国或各组织对多菌灵含量的最低要求不同,例如:欧盟的标准是200 μg·L-1,澳大利亚的标准则是不超过10 μg·L-1,美国的标准是不超过80 μg·L-1,我国标准高于欧美检测,为5000 μg·L-1[32]。本研究中果园生草白三叶喷施多菌灵后经过青贮发酵,农药残留虽显著减少(P<0.05),但残留量还是高于安全标准。 本试验结果可能是因为青贮发酵是多种微生物及化学物质共同作用的复杂反应过程,青贮微生物对农药的吸附作用和一部分细菌将农药作为氮源等能量利用,来促进微生物代谢过程,从而降解农药,高浓度多菌灵较低浓度可以显著降低pH,为微生物提供更好的降解环境,从而更好地降解多菌灵。例如:蒲丹等[33]从成都彭州蔬菜基地土壤中分离出能以多菌灵作为唯一碳氮源生长的细菌GRPD-1,鉴定其为假单胞菌属(Pseudomonassp.),该菌株在以多菌灵为唯一碳氮源的基础上,在培养基中培养6 d 对50 mL 多菌灵的降解率达60%。Xu 等[34]筛选出的红球菌属能以多菌灵为唯一碳、氮源生长,在2~3 d 内,可以完全降解100 mg·L-1的多菌灵,降解率高达55.56 mg·L-1·d-1。如Dord 等[35]研究发现与低浓度毒死蜱相比,高浓度毒死蜱可以更好地促进干酪乳杆菌的代谢,从而提高毒死蜱的降解率。李杰等[36]研究表明多菌灵易溶于酸水不溶于碱水,所以在酸性条件下比在碱性条件时降解的更好。 通过测定不同浓度多菌灵农药对白三叶青贮发酵的影响以及发酵后不同浓度多菌灵降解情况,结果表明多菌灵农药对白三叶青贮发酵无负面影响,但青贮后多菌灵农药残留较高,可能是因为多菌灵对微生物群落的变化及微生物生长活性有一定抑制作用[37]。为了探究青贮后多菌灵残留量高是否与多菌灵对白三叶青贮过程中微生物群落动态变化影响有关,因此选择RU+浓度多菌灵进行研究。在群落生态学中,α 多样性可以反映微生物群落中的物种数量,并且可以通过一系列统计指标来探索环境群落的物种丰度和多样性的估计[38]。研究结果中菌群丰度、多样性增加可能是因为青贮前期一部分细菌将多菌灵作为氮源等能量来源来促进微生物繁殖[34],从而导致农药降解的同时菌群丰度及多样性得到增加。青贮60 d 喷施多菌灵处理组菌群多样性显著下降可能是多菌灵青贮后残留浓度较高的原因之一。Zhang 等[39]的研究表明喷施毒死蜱显著降低大肠杆菌和酵母数量,导致农药残留较高。 为进一步了解多菌灵对白三叶青贮发酵过程中菌群结构的影响,对不同处理样品进行主成分分析后,发现随着时间的推移,多菌灵被降解,残留浓度减少,导致多菌灵对青贮细菌菌群的结构影响减小。肖丽等[40]的研究表明不同时间内多菌灵处理对土壤细菌群落结构影响有显著差异,当多菌灵及其中间产物完全降解时,120 d 后多菌灵处理的细菌群落恢复到初始水平。青贮60 d 与3 d 相比,喷施多菌灵处理主要菌群表现为变形菌门丰度增加,厚壁菌门丰度减少,这与前人研究一致,Fang 等[41]的研究发现变形菌门是土壤中降解多菌灵农药的主要细菌门类。而添加多菌灵使得厚壁菌门微生物丰度下降,这说明变形菌门微生物可能对多菌灵具有耐受性,多菌灵的添加有利于它们生长繁殖,而对厚壁菌门微生物有抑制作用。青贮60 d 与3 d 相比,喷施多菌灵处理主要菌群表现为乳酸杆菌科、肠杆菌科丰度增加,假单胞菌科、芽孢杆菌科、链球菌科、明串珠菌科丰度减少。这可能是因为青贮环境有利于明串珠菌科的生长。Gharechahi 等[25]的研究表明明串珠菌科在玉米(Zea mays)青贮中起主导作用。而肠杆菌科、假单胞菌科、芽孢杆菌科作为多菌灵的降解菌,可利用多菌灵作为能量来源来生长繁殖,从而提高丰富度。但随着农药的降解,以及青贮环境的改变,假单胞菌科、芽孢杆菌科丰度下降。这可能也是多菌灵残留较高的原因。青贮60 d 与3 d 相比,喷施多菌灵处理主要菌群表现为泛菌属、乳杆菌属、Rosenbergiella丰度增加,片球菌属、乳球菌属、魏斯氏菌属、寡养单胞菌属、肠杆菌属、芽孢杆菌属丰度减少。结果与科水平细菌菌群变化一致。多菌灵的喷施导致细菌群落结构的变化。由于青贮环境的影响以及青贮优势微生物的竞争抑制作用,导致可以降解多菌灵,如寡养单胞菌属、肠杆菌属、芽孢杆菌属等的细菌丰度的减少,故在生产中可以通过添加一定寡养单胞菌属、肠杆菌属、芽孢杆菌属等多菌灵降解菌,在青贮前期最大限度地降低多菌灵的残留浓度,从而达到安全标准。 1)青贮后,多菌灵降解率为59.6%~70.7%,随着农药浓度的增加降解率显著增加,喷施多菌灵农药的白三叶青贮后农药残留未达到安全饲用标准;与对照相比,不同浓度多菌灵处理对白三叶青贮发酵过程中乳酸、乙酸、丙酸的产生有显著促进作用,均显著降低了青贮环境的pH 值,与低浓度相比,高浓度多菌灵处理中乳酸、乙酸、丙酸含量均显著增加;多菌灵处理的白三叶青贮后DM、CP、氨态氮含量与农药浓度有关。2)高通量测序结果显示多菌灵喷施显著改变了白三叶青贮菌群群落构成,增加了青贮的菌群丰度、多样性,多菌灵的喷施减少了乳杆菌属、片球菌属的相对丰度,增加了魏斯氏菌属、泛菌属、假单胞菌属、寡养单胞菌属、肠杆菌属的相对丰度,不利于青贮发酵;随着多菌灵的降解菌群丰度、多样性慢慢恢复,多菌灵的喷施刺激了乳球菌属、魏斯氏菌属、泛菌属、Rosenbergiella、假单胞菌属、寡养单胞菌属、肠杆菌属、芽孢杆菌属菌群的繁殖。青贮过程中,寡养单胞菌属、肠杆菌属、芽孢杆菌属等具有降解多菌灵功能的菌群随着青贮时间的推移丰度减少。多菌灵通过对青贮发酵有害菌、多菌灵降解菌群丰度及青贮微生物多样性产生影响,导致青贮后多菌灵残留高于欧洲食品安全局规定的作物类动物饲料中农药最大残留量,达不到饲用标准。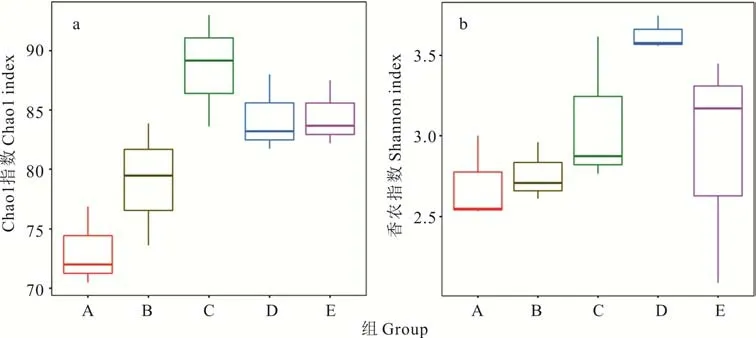

3 讨论
3.1 不同浓度多菌灵对白三叶青贮发酵的影响
3.2 白三叶青贮发酵对多菌灵的影响
3.3 多菌灵对果园生草白三叶青贮过程中微生物群落的影响
4 结论

