干旱区盐碱地食叶草根系形态分布适应策略研究
杨志新,郑旭,陈来宝,于泳鑫,张凤华,李鲁华,王家平,3*
(1. 石河子大学农学院,新疆 石河子 832000;2. 绿洲作物高效生产与农业环境保护国家国际科技合作基地,新疆 石河子 832000;3. 新疆生产建设兵团绿洲生态农业重点实验室,新疆 石河子 832000)
中国盐碱地面积为9.91×107hm2,其中新疆盐碱地面积达2.81×107hm2,占全国盐碱地面积近1/3[1]。由于盐离子大量聚集,致使土壤溶液渗透压升高,易造成植物根系缺水并产生毒害,胁迫植物生长。农业盐碱地改良是创造适宜植物生长的耕层环境或适宜盐碱环境的作物,减轻盐碱环境对作物生长的抑制[2-3]。物理方法“灌水排盐”是改良盐碱地行之有效的方法,但因新疆干旱缺水,灌排工程施工量大,成本高,研究者考虑利用具有一定经济价值的盐生植物补偿生长来治理盐碱地[4]。盐生植物通过吸收盐分并排出体外等多种方式以抵御盐碱胁迫造成的损害,根系作为盐生植物与盐碱地的直接接触器官,首先遭受盐碱胁迫危害,是决定植物适应盐碱环境的关键因素之一。因此,探索盐生植物根系分布与土壤盐碱程度关系对实现盐碱地有效利用具有重要的意义。
近年来,种植盐生植物已成为盐碱地改良与持续利用的重要措施[5-6]。盐生植物通过根系吸收离子,影响土壤孔隙分布和根层结构等土壤因素,适应盐碱土壤环境。研究发现植物通过根系交错、穿插、网络固结以及根土黏结等作用,在生长过程中或死亡后会在土壤中形成根孔,改善土壤孔隙分布、结构和土壤理化特性[7-9]。Xiao等[10]研究指出,植物根系影响土壤团聚体的稳定性,其与比根长显著相关。王慧等[11]发现盐碱地土壤中全磷和速效铁含量与柽柳(Tamarix chinensis)细根比根长显著相关。除此之外,根系分泌物有利于根际微生物产生,在土壤生化循环和养分转化中起重要作用,同时也对所处生境产生响应[12]。严青青等[13]研究发现,随着盐浓度增加,海岛棉(Gossypium barbadense)根长、根体积及根表面积均降低,抑制了海岛棉根系生长。而盐生植物具有适应盐碱环境的能力,可以降低盐碱地表层土壤盐离子的聚集,具有持续改良能力和自我维持等优点[14-16]。
食叶草(Rumex hanus)是一种宿根草本植物,直根系,具抗旱、耐盐碱、抗逆能力强等特性,可作牧草或粗蛋白使用,具有较高经济价值。根系的生长发育状况对植物的耐盐能力至关重要,研究发现食叶草根系生长集中在盐碱地0~40 cm 土壤[17-18]。干旱区盐碱地植物根系受水分亏缺和盐碱胁迫两种因素影响,目前对干旱区盐碱地盐生草本植物根系形态适应策略的研究较少。张科等[19]分析研究盐生植物的形态适应机制首先表现在根系的变化,形态特征上可表现出盐生植物抵御盐、旱胁迫的丰富途径。盐生植物的根系首先感受盐碱胁迫,根系形态和分布格局可以有效反映盐碱地对植株的影响,明确食叶草根系的形态适应策略对盐碱地生态治理意义重大。
盐生草本植物根系对盐碱胁迫的响应表现在生理和形态上,干旱区盐碱地上植物受到水分、盐分两种不利因素制约,食叶草在盐碱地中具有强抗逆能力,而其对盐碱环境的适应机制和生长策略尚不清晰。本研究围绕干旱区盐碱地可持续利用和生物治理的重点问题,通过研究盐碱地不同时期食叶草根系形态特征及空间分布规律,明确食叶草根系在盐碱胁迫所表现的形态适应策略,为干旱区盐碱土壤改良和土壤盐渍化治理提供实践依据。
1 材料与方法
1.1 试验区概况
试验于2020 年6-11 月在新疆石河子市总场五分场进行。地理坐标为44°36′1.75″N,85°57′35.72″E,地处天山北麓中段,准噶尔盆地南部,海拔高度为900~1100 m,属温带大陆性气候,年均降水量120~210 mm,蒸发量约1200 mm,日照时数约2800 h,无霜期为170 d,光热资源丰富。试验区土壤质地为灰漠土,0~20 cm 土壤有机质、全氮、全磷、全钾平均含量分别为5.6 g·kg-1、0.28 g·kg-1、0.75 g·kg-1、21.2 g·kg-1。
1.2 试验设计
供试材料为食叶草,由北京军信泉盛环境科学技术研究院提供。选取3 年生食叶草植株,行距60 cm,株距40 cm,小区面积36 m2(3.6 m×10.0 m),共3 小区。采用地表滴灌灌水方式,灌水周期10 d,灌水量150 m3,随水滴施尿素15 kg·hm-2,刈割周期27 d,刈割后作绿肥均匀翻耕还田。病、虫、草管理按照当地常规方式。
1.3 测定指标与方法
1.3.1根系采集方法 使用剖面采样法(图1)采集根系样品,共于2020 年7、10 月两次采样。试验区内选择生长一致的食叶草植株,去除地上部分后以植株为中心在水平方向上划分50 cm×50 cm 的正方形区域,垂直方向以10 cm 土壤深度为一层,根系所至范围内将带根土壤区域切分为若干个体积为1000 cm3(10 cm×10 cm×10 cm)的正方体土块并依次挖出装袋,取样深度视根系生长范围而定,7 月取至80 cm,10 月取至110 cm 左右,至无根为止。各小区均采集3 株,每株食叶草采集225 个以上体积为1000 cm3的正方体土块,依次编号并带至实验室进行后续处理。
图1 剖面法根系采集示意图Fig. 1 Schematic diagram of root collection by profile sampling method
1.3.2根系形态指标及生物量测量 依据编号顺序,使用镊子将土体内食叶草根系尽数挑拣取出,经清水洗净,使用纱布擦去根外表水分,置入EPSON平板彩色扫描仪(Perfection V370 photo,印度尼西亚)进行扫描,使用Win RHIZO pro 2012 根系分析软件得到各根系形态指标数据,计算相关根系形态指标。根系样品经扫描分析后,将细根(d≤2 mm)和其他直径根系区分整理,分装置于105 ℃烘箱进行30 min 杀青,后经85 ℃烘干至恒重,冷却后使用万分之一天平称重,测定根系干重。
1.3.3土壤电导率测定 选取食叶草主根附近根际土及植株边缘非根际土,风干至恒重。过0.20 mm筛网,以水土比5∶1 制备土壤浸提液,振荡5 min 后静置4 h,上清液经定量滤纸过滤后使用台式电导率仪(DDSJ-308A,中国)测定电导率。
1.4 数据处理
采 用 Microsoft Excel 2016 和 IBM Statistics SPSS 22.0 进行数据处理和统计分析,通过One-way ANOVA 进行单因素方差分析显著性检验,采用Sigma Plot 12.5 软件绘制图形。
2 结果与分析
2.1 盐碱地不同时期食叶草根际和非根际土壤电导率剖面分布特征
盐碱地土壤电导率随根系密集程度提高而降低,随土层加深呈现下降趋势。0~40 cm 土层电导率较高,可达2260.28 ms·cm-1,40~110 cm 土层电导率较低,仅在192.06~457.35 ms·cm-1(图2)。7-10 月,各土层电导率均有不同程度降低,0~40 cm 土层降幅较高,根际和非根际土壤电导率分别降低了72.89%和53.98%,其中30~40 cm 土层电导率降低了80%以上。

图2 不同时期食叶草根系土壤电导率剖面分布特征Fig. 2 Profile distribution of soil electrical conductivity in the root system of R. hanus in different months
2.2 盐碱地食叶草根系垂直方向形态特征与分布格局
2.2.1食叶草根长和根体积形态特征与分布 盐碱地食叶草根系最深至110 cm 土壤内,主要分布于0~40 cm 土层,其占总根长71.96%~82.37%,占总根体积90.13%~97.37%(图3),7-10 月,总根长、总根体积分别增加56.28%、48.83%,根长随土层加深有先减后增再减的规律,根体积则随土层加深逐渐减少。0~20 cm 土层内根长、根体积显著增加(P<0.05),分别增加41.98%和71.26%。20~30 cm 土层内根长、根体积变化不显著,30~60 cm 土层内根长显著增加(P<0.05),而根体积增加幅度较小,未达显著水平。从各土层根系分布比例来看,0~40 cm 土层内根长、根体积占比降低,其中20~40 cm 土层降幅较高,根长、根体积占比分别降低5.69%、8.31%。而40~60 cm 土层内比例提高,根长、根体积占比分别增加8.26%和3.87%。

图3 不同深度土壤食叶草根长和根体积变化特征Fig.3 Root length and volume characteristics of R. hanus in different soil depths
2.2.2不同深度土壤内食叶草细根长度和生物量比例特征 食叶草细根长度随土层增加而递减,主要分布在0~50 cm 土层,该土层中细根占植株细根长度84.74%~85.52%(图4)。7-10 月,0~60 cm 土层细根长度显著增加(P<0.05),其中0~10 cm 土层增量最大,为1964.09 cm,而40~50 cm 土层增幅最高,为272.31%。7-10月,0~20 cm 和60~100 cm 土层内细根长度占比未发生显著变化,20~30 cm 土层内细根长度占比降低,而40~50 cm 土层细根长度占比大幅提高,较7 月增加6.43%。

图4 食叶草不同深度细根长度变化特征Fig. 4 Variations of fine root length for R. hanus at different soil depths
如表1 所示,食叶草细根生物量比例在不同月份均表现出随土层加深先提高后降低再提高的规律,细根长度比例变化规律为7 月随土层加深先提高后降低再提高,10 月则先降低后提高。7 月各土层间细根长度比例差异小,均未达到显著差异,细根生物量比例在0~60 cm 土层内随土壤深度增加不断显著提高(P<0.05),60~100 cm 土层内变化幅度较小。10 月20~90 cm 土层内细根长度比例较低,在70~80 cm 土层达最小值83.62%。各土层细根生物量比例变化幅度大,40~50 cm 和90~110 cm 土层比例较高,0~40 cm 比例较低。7-10 月,细根长度在0~20 cm 土层比例提高,在20~100 cm 比例降低,细根生物量在0~10 cm 土层比例提高,10~100 cm 生物量比例降低。

表1 不同深度土壤内食叶草细根长度和生物量比例Table 1 The length and biomass ratio of fine roots of R.hanus in different soil depths(%)
2.3 盐碱地食叶草根系水平方向形态特征与分布格局
2.3.1食叶草根长和根体积形态特征与分布 水平方向上,食叶草根系主要分布距植株0~25 cm 内(图5),占比88.14%以上。随着距离增加,各土层根长均呈现先增加后减少的趋势,根体积在0~20 cm 土层快速下降,其余土层根体积呈先上升后下降的趋势。7-10 月,0~20 cm 土层食叶草根长、根体积在水平距离5~25 cm 内增长迅速,其中水平距离5~15 cm 内根体积增幅高达587.31%。20~40 cm 土层中,根长在水平距离0~5 cm 内增长迅速,但根体积变化幅度较小。40~80 cm 土层中,根长和根体积在各水平距离内均快速增加。总体而言,水平距离0~25 cm 内食叶草根系生长较快,但不同土层根系生长速度不同,同一土层根体积和根长的变化趋势存在差异。

图5 不同水平距离食叶草根长和根体积变化特征Fig. 5 Root length and volume characteristics of R. hanus at different horizontal distances from plants
2.3.2食叶草水平方向土壤内细根长度比例特征 随着距植株水平距离增加,细根长度比例呈先增高后降低趋势(表2),细根主要集中在水平距离5~25 cm,比例范围在82.21%~96.06%,其余范围细根长度比例较低。7-10 月,0~40 cm 土层内,水平距离0~5 cm 内细根长度比例显著提高(P<0.05),水平距离25~35 cm 细根长度比例显著降低(P<0.05)。40~80 cm 土层内,水平距离5~15 cm 细根比例显著提高(P<0.05),15~35 cm 细根比例显著降低(P<0.05)。

表2 距植株水平距离0~35 cm 内食叶草细根长度比例Table 2 Ratio of the fine roots length of R.hanus within 0-35 cm from the horizontal distance of the plant
2.4 盐碱地食叶草不同直径根系长度分布特征
各土层中,直径0~0.5 mm 根系累积长度最高,直径大于2 mm 根系累积长度最低(图6)。10 月0~20 cm 和40~60 cm 土层中直径0~1 mm 根系长度较7 月显著增加(P<0.05),20~40 cm 和60~80 cm 土层中直径大于2 mm 根系长度显著增加(P<0.05)。0~20 cm 土层中(图6a),直径0~0.5 mm 根系约占植株根系的70%,直径1~1.5 mm 根系仅约占植物根系的4.5%。7-10 月,直径0~1 mm 根系长度显著增加(P<0.05),其中直径0~0.5 mm 根系长度增量最高,达2645 cm,增幅为52.19%。20~40 cm 土层中(图6b),不同直径根系分布与0~20 cm土层相似,但只有直径大于2 mm 根系长度显著增加(P<0.05),其余直径根系长度增加不显著。40~80 cm 土层(图6c 和d),不同直径根长增加趋势与0~20 cm 表层土层相似。
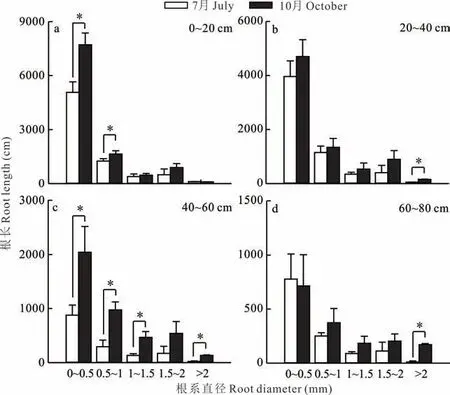
图6 不同直径根系长度的变化Fig. 6 Variation of root system length with different diameters
2.5 盐碱地食叶草根系生物量剖面变化特征
食叶草根系在0~110 cm 深度土壤中均有分布,且随土壤深度增加根系生物量逐渐降低(图7a),主要分布在0~40 cm 土层,占总根生物量97.43%~98.26%,尤以0~10 cm 土层最为集中,根生物量范围在64.94~84.07 g,占总根生物量43.33%~44.18%。7-10 月,0~10 cm 和30~40 cm 土层根生物量分别增加19.13 和13.08 g,差异显著,30~40 cm 土层增幅达240.88%,其余土层根生物量增加不显著。从累积比例看,0~40 cm 土层根生物量累积比例占总根生物量95%以上,10 和7 月各土层生物量累积比例之间差异不显著。食叶草细根生物量随土层加深先增加后减少,7 月于10~20 cm 土层达最大值,10 月于20~30 cm 土层达最大值(图7b)。细根主要分布在0~50 cm 土层,该土层中细根占植株细根生物量82.48%~83.89%。7-10 月,细根生物量峰值土层由10~20 cm 变化为20~30 cm,同时0~10 cm 和30~50 cm 土层细根生物量显著增加(P<0.05),尤其是40~50 cm 土层,增幅达234.38%,但10~20 cm 土层细根生物量大幅降低。7-10 月,细根生物量累积比例在0~10 cm 土层内提高,其余土层均降低。

图7 不同深度食叶草根系生物量及其累积比例变化特征Fig. 7 Variations of root biomass and cumulative ratio of R. hanus in different soil depths
3 讨论
植物会根据外部环境调整自身的资源分配,从而增强对环境的适应能力[20],根系是植物吸收水分、养分的重要器官,其与土壤直接接触,是植物感受逆境胁迫的首要部位,易受到土壤环境的影响[21]。研究发现耐性植物与敏感植物根系在逆境中的生长和分布具有不同的响应机制,大多数耐性植物通过增加根系吸收面积以提升抵御逆境的能力[22-23]。盐碱地食叶草的根系能够抵达1 m 以下土壤,主要分布在0~50 cm 深度,根系向更深层土壤延伸,从而获取更多土壤水分资源。生长季内,30~40 cm 土层根生物量的增幅最高,且根系生长速率高。这可能是由于干旱区蒸发强烈,盐碱地土壤盐分随水分上行并聚集在表层[24],导致表层土壤生境较为恶劣,迫使根系进行规避高盐环境的资源配置策略。因此不同深度土壤食叶草根系生物量分配的差异性,是食叶草根系构建的资源配置模式应对盐碱胁迫的结果。
盐生植物根际土壤的异质性是其与环境产生相互关系的综合体现,能反映出盐生植物的生态适应性及其对环境的修饰作用[25]。研究表明,根据盐生植物种类及所处生境的不同,根际土壤盐分有不同的变化趋势,高盐环境下部分盐生植物根际产生了明显的盐分富集特征[26]。也存在盐生植物主根附近形成低盐环境的报道[27-28]。这种差异可能与盐生植物对盐离子的吸收途径和转运机制有关[29]。本研究中,大量盐离子聚集至0~40 cm 土层,但食叶草根系周围土壤盐分都随时间增加产生不同程度下降,在根系密集区域尤为明显。土壤电导率和根系特征相关性分析表明(表3),土壤电导率减少量与根长增加量和根生物量增加量显著正相关,说明食叶草根系生长有效降低了盐碱地土壤含盐量。这种现象的形成原因一方面是由于根系吸收了土壤盐离子,积累在叶片肉质化组织[30]。另一方面可能由于根系产生物理穿插作用,改善土壤孔隙度,或通过根系分泌物影响土壤团聚体结构,形成孔隙通道并促进离子随水分淋洗[31]。盐生植物具有适应高盐环境的能力,根系生长的同时还对环境修饰,植物抵抗盐胁迫的机制及其盐分转移机理仍需进一步研究。

表3 土壤电导率与食叶草根系指标相关性分析Table 3 Correlation analysis of root indicators of R.hanus and soil electrical conductivity
盐胁迫下植物根系形态、结构的调整对评估植物耐盐性具有重要意义[32]。弋良朋等[33]研究发现一定浓度的盐分可以促进盐生植物生长,较高浓度盐胁迫则抑制其生长,且抑制效果更多表现在根系上。本研究中食叶草根长、根体积在0~20 cm 和30~60 cm 土层内快速增加,在20~30 cm 土层则生长受到抑制,与前人研究结果相同[17,34]。自然条件下,土壤中盐分分布大多具有区块性,植物根系具有通过调配资源以提高抵抗力的逆境适应机制,盐碱地中根系分布和生长的差异性与之相关。0~20 cm 土层内食叶草根长和根体积均大幅增加,这是由于地表附近主根粗壮,并且生长较快所导致。20~30 cm 土层含盐量高,同时距地表较远,水分、养分、氧气的供应条件较差,产生相对恶劣的生境,可能是导致根系生长缓慢的主要原因。30~60 cm 土层根长大幅增加的同时根体积增幅较小,且根长的增加主要体现在细根上。此结果与有关学者的研究结果相似,王树凤等[35]发现盐胁迫下弗吉尼亚栎(Quercus virginiana)根系总长度、总表面积和总体积在盐胁迫下均有不同程度增加,且根系总长度的增加主要来源于细根的增加。
逆境下,根系通过改变形态与土壤中的分布格局,从而增强抵御胁迫的能力[36]。研究显示,盐胁迫下盐敏感植物侧根的生长受到抑制,却能刺激耐性强的植物侧根生长[37-38]。可见,盐胁迫下不同植物根系的调节模式不同。根系的生长是土壤水分、温度和养分等综合作用的结果,既表现在不同的土壤层次之间,又表现在距植株水平方向上[39]。目前对食叶草根系水平分布特征的报道甚少,本研究结果发现,食叶草根系在水平距离上的分布在各土层间差异较大,表层0~20 cm 土壤内根体积集中在水平距离0~5 cm 内。20~80 cm 土层内根体积集中在水平距离5~15 cm 内,食叶草总根长在水平距离5~25 cm 内分布有75%以上。这种现象与根系的趋水性及避盐性有关[40]。生长期内根系水平距离增加主要发生在距植株5~25 cm 处,根体积的增速大于根长,同时细根比例降低。可能由于以下几个原因:1)植物通过提高根系密集程度以增加对土壤水分、养分的吸收能力,从而提升区域土壤的利用效率并降低胁迫损害[41];2)植株限制了根系对土壤空间的占据和利用量,避免开拓远离植株的高盐区域,可以减少对土壤盐离子的吸收[21];3)通过根系通气组织的发育来降低盐碱胁迫带来的缺氧损伤和生长抑制效果[42-43]。
细根(d≤2 mm)是植物吸收水分和养分的主要途径,在生态系统净初级生产力的分配中占有重要地位[44-45]。植株通过扩大细根与土壤的接触面积从而有效获取水分、养分,食叶草植株为增强自身适应能力,提高了深层土壤中根系生物量分配比例,主要体现为细根快速增加,从而在规避表层盐分聚集区的同时拓展水分、养分的吸收区域。干旱区盐碱地中土壤盐分随水势梯度扩散进行运动,盐碱胁迫是影响细根分布的重要因素,而细根在维持养分吸收和供应方面起重要作用。以往研究表明,粗根由于保持土壤水分的能力较弱,导致根际附近土壤水分蒸发较快,使盐分易于在根系周围积累[46]。低浓度盐碱胁迫下强耐盐能力植物的细根长度和体积存在一定程度增加,说明植物通过提高根系吸收水分和养分的能力从而适应盐碱环境[47]。与之相似,本研究中细根的根长和根体积在0~110 cm 深度土壤中迅速增加,细根长度比例始终保持在90%以上,且直径0~0.5 mm 的根系长度占比最高。说明食叶草植株将大量资源向细根分配,致使其快速增加,提高了根系对土壤水分、养分的获取能力,能有效利用光合积累物,从而提高植株对盐碱环境的适应力。王庆惠等[48]研究发现盐分胁迫抑制了棉花(Gossypiumspp)根系生长,但棉花通过提高细根的资源占有比例,从而减缓胁迫对根系生长的抑制,增强根系觅养能力,提高根系对逆境的适应力。
4 结论
通过对干旱区盐碱地不同时期食叶草根系进行测量分析,发现食叶草根系明显降低了土壤电导率,根系密集区域降幅较高,0~40 cm 土层内根际土壤电导率降低了72.89%,且土壤电导率的降低与根长、根系生物量的增加显著正相关;食叶草各层根系中细根比例均在90%以上,且直径0~0.5 mm 根系最多,根长增幅也最高。根系在土壤垂直方向上随土层加深而递减,可至1 m 以下,主要分布在0~40 cm 土壤,占比71.96%以上。水平方向上,食叶草根系可分布至距植株35 cm 处,集中在0~25 cm 内,占比88.14%以上,7-10 月,表层(0~20 cm)和深层(30~80 cm)土壤内根系增加迅速,表层根体积增幅高达587.31%,同时深层区域根系占比提高,中间层(20~30 cm)根系生长速度较慢,除表层土壤外,细根比例均小幅度下降;水平方向5~25 cm 内根系增加迅速,根长增幅44.59%,根体积增幅97.25%,而水平距离25~35 cm 内根系生长缓慢。食叶草根系分布方式可提高根系对植株附近低盐区域的营养吸收能力,增强根系应对盐碱胁迫的适应性,体现了其环境适应策略,为今后盐生草本植物种植与管理提供了理论基础。

