钙盐胁迫对3 份葛藤种质种子萌发及幼苗生理特性的影响
谢文辉,黄莉娟,赵丽丽,王雷挺,赵文武
(贵州大学动物科学学院草业科学系,贵州贵阳 550025)
钙(Ca)是植物生长发育期的必需营养元素,是构成植物细胞壁和细胞膜等结构的必需物质,在维护细胞的正常结构与功能、减少或延缓膜损伤等方面具有重要作用。在植物种子萌发期,Ca2+通过改变相关作用酶活性,调控种子出苗速度与发芽率。研究发现,一定浓度的Ca2+在幼苗生长期可以缓解干旱[1]、盐害[2]、冷害[3]和细菌[4]等对植物的影响,促进植物幼苗的健康生长。植物体内Ca2+浓度过高或过低均会影响植物的正常生长代谢,植物体内Ca2+浓度过低影响植物细胞壁形成,抑制细胞分裂,破坏原生质膜结构,严重时会导致植物枯死[5];Ca2+浓度过高导致大量Ca2+与PO43-在植物体内形成沉淀,影响Ca2+信号的正常传导,损伤植物叶绿体膜结构,光合作用无法正常进行,从而影响植物的正常生长代谢[6-7]。
“中国南方喀斯特”在地质地貌、生物生态、民族文化等方面的世界价值长期以来得到国内外的广泛重视和认同,该区域面积达1762.28 km²,贵州省碳酸盐岩山地面积约12.9 km2,占全省总面积的73.6%[8-9]。可溶性岩石(碳酸盐岩、石膏、岩盐等)长期受水的化学溶蚀作用,导致该生态系统中土壤Ca2+含量高于非岩溶地区[10]。该地区土壤钙含量高达1%~3%,是同纬度硅酸盐地区的2~3 倍[11],因此,土壤Ca2+含量成为限制该地区植物生长的因素之一[12]。
葛藤(Pueraria lobata)作为一种豆科多年生优良饲草,其嫩茎和叶片适口性好,茎叶除富含粗蛋白外,含有丰富的Mg、Ca 元素及微量元素Cu、Zn、Fe 等,是牛、羊、猪喜食的牧草之一。目前对葛藤的研究主要集中在其根部含有的异黄酮[13]、葛根素[14]等次生代谢产物的合成途径、提取工艺及药用效果上,有关葛藤作为水土保持及饲草的研究较少,以饲草及水土保持为利用目的的葛藤品种选育的相关研究较少。李安定等[15]通过研究喀斯特地区群落组成类型,发现葛藤在喀斯特石漠化生境中生态位宽度较大,适应能力与抗逆性较强。因此,葛藤具有成为岩溶区优良草种的巨大潜力。研究钙盐胁迫对葛藤幼苗生长、生理的影响,对栽培和选育适宜西南岩溶区耐高钙盐草种,开展石漠化生态恢复,缓解牧草资源紧张等方面具有重要意义。
种子萌发及幼苗生长是植物生长发育的重要且敏感时期,是影响葛藤大规模种植的关键期。因此,本研究通过不同浓度梯度的CaCl2溶液模拟钙盐环境,研究外源钙胁迫对3 份葛藤种质种子萌发及幼苗生长的影响,初步揭示葛藤适应钙盐的萌发及生理机制,为葛藤耐钙盐品种的选育及其在西南岩溶区的成功建植提供理论依据。
1 材料与方法
1.1 试验材料
葛藤3 份种质材料来源信息详见表1。经贵州大学赵丽丽教授鉴定,均为蝶形花科葛属植物葛藤种子。

表1 3 份葛藤种质的资源信息Table 1 Resource information of the three P.lobata germplasms
1.2 试验方法
1.2.1萌发试验 试验于2020 年9 月至2021 年1 月在贵州大学动物科学学院草业科学系实验温室进行。结合我国西南喀斯特区土壤含Ca 量[11],设置50、100、150、200 mmol·L-1这4 个CaCl2浓度梯度,蒸馏水处理组为对照(CK)。选取籽粒饱满、大小一致、无霉变及病虫害的种子,10% NaClO 溶液消毒15 min,去离子水冲洗3~5 遍后,整齐摆放于铺有2 层滤纸的培养皿,每皿摆放30 粒种子。在摆好种子的培养皿中分别加入10 mL 不同浓度的CaCl2溶液,每个处理均设3 次重复,25 ℃恒温培养。为保持恒定溶液浓度,每天采用称重法补充蒸发失去的水分,并定时记载萌发种子数,以胚根长度大于种子的50%视为种子萌发。7 d 萌发试验结束后每个处理随机挑取5 粒发芽种子测量胚根长,计算种子发芽率、发芽势、发芽指数、活力指数。其中:

式中:Gt 表示第t 天的种子发芽数;Dt 为种子发芽天数;Sx 表示种子平均胚根长。
1.2.2苗期试验 预先通过种子萌发培育出3 份葛藤种质幼苗,以改良霍格兰营养液为基础液,从每份种质幼苗中选取生长一致、健康的幼苗进行水培。当幼苗生长至二叶一心,营养液中分别加入0(CK)、50、100、150、200 mmol·L-1的CaCl2溶液开始胁迫,每个处理取30 株,重复3 次。胁迫最后1 d 测定株高、叶长、叶宽、生物量(地下部干重和地上部干重)。每个重复随机选取5 株葛藤,采用直尺法测量绝对株高。随机取葛藤从上至下第3片完全展开功能叶测量叶形态(叶长、叶宽),每个重复测定5 片叶。从根茎处将植株剪断分为地上部和地下部,105 ℃杀青30 min,75 ℃烘干至恒重后称地下和地上部干重。
1.2.3生理指标测定 胁迫试验结束,每个处理取新鲜叶片测定生理指标。采用愈创木酚法测定过氧化物酶(peroxidase,POD)活性,氮蓝四唑法测定超氧化物歧化酶(superoxide dismutase,SOD)活性[16],紫外吸收法测定过氧化氢酶(catalase,CAT)活性,磺基水杨酸法测定脯氨酸(proline,Pro)含量[16],采用Yoshiyuki 法[17]测定抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性,硫代巴比妥酸法测定丙二醛(malondialdehyde,MDA)含量[18],蒽酮比色法测定可溶性糖含量。电导率用Bante-901 测定,称取绿色幼嫩叶片0.5 g,将各处理叶片剪成小段分别放入不同试管,每个试管加10 mL 超纯水,室温下测定其电导率EC1,将材料煮沸10 min,冷却至室温后测定其电导率EC2,相对电导率(%)=(EC1-EC0)/(EC2-EC0)×100,EC0为超纯水电导率。采用植物激素酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定叶片中脱落酸(abscisic acid,ABA)、生长素(auxin,IAA)、赤霉素(gibberellin A3,GA3)及玉米素(Zeatin,ZT)含量[19]。每个样品均重复测定3 次。
1.2.4模糊隶属函数综合评价法 采用模糊隶属函数法计算3 份葛藤种质种子萌发及幼苗生长阶段的耐盐隶属函数值,据此对3 份葛藤种质的耐盐性进行综合评价[20]。计算公式如下:

式中:μ(Xj)代表第j个指标的隶属函数值;Xj代表第j个指标值;Xmin代表第j个指标的最小值;Xmax代表第j个指标的最大值;耐盐性与指标呈正相关时采用公式(1)计算,呈负相关时则采用公式(2)进行计算。
1.2.5单项指标主成分分析 为筛选葛藤耐盐性的主要对比指标,对3 份葛藤种质各单项指标的耐盐系数ω分别进行主成分分析[21],计算耐盐系数(ω)公式如下:

1.3 数据处理
使用IBM SPSS Statistics 21 软件作数据处理与分析,SigmaPlot 12 软件作图,所有数据结果均以“平均值±标准差”表示。
2 结果与分析
2.1 钙盐胁迫对3 份葛藤种质种子萌发的影响
从图1 可知,随CaCl2胁迫浓度升高,AUS 和JS 种质种子发芽率、发芽势、发芽指数和活力指数均呈逐渐降低趋势。HN 种质种子在CaCl2浓度为50~150 mmol·L-1时发芽率、发芽势与CK 相比差异均不显著,当CaCl2浓度达到200 mmol·L-1时,其4 个发芽指标相比CK 均显著降低。HN 种子发芽率、发芽势、发芽指数和活力指数在CK 时显著低于其他2 份葛藤种质种子,当CaCl2浓度达到200 mmol·L-1,AUS 葛藤发芽率、发芽指数和活力指数显著高于其他2 份种质。当CaCl2浓度为50 和100 mmol·L-1时,HN 葛藤种子发芽率、发芽势(除100 mmol·L-1)、发芽指数和活力指数均显著低于其他2 份葛藤种质种子。
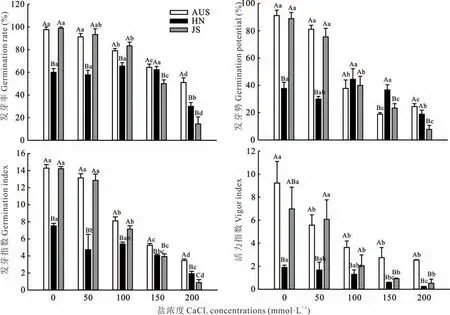
图1 钙盐胁迫对3 份葛藤种质种子发芽指标的影响Fig.1 Effects of calcium salt stress on seed germination indexes of three P. lobata germplasms
HN 种质种子活力指数在CK 下显著低于AUS 种质。AUS、JS 及HN 种质种子活力指数在CaCl2浓度分别为50、100 和150 mmol·L-1时,与CK 相比开始产生显著差异。AUS、HN 和JS 种质种子活力指数在CaCl2浓度为200 mmol·L-1时均达到最低,与CK 相比分别降低72.53%、87.84%和92.61%。
2.2 钙盐胁迫对3 份葛藤种质幼苗生长的影响
由表2 可知,3 份葛藤种质幼苗叶长、叶宽和株高均随CaCl2胁迫浓度的提高呈降低趋势。50 mmol·L-1CaCl2胁迫下,HN 种质幼苗株高与CK 相比显著降低,100 mmol·L-1CaCl2胁迫下,AUS 种质幼苗叶长、株高和JS 种质幼苗叶长与CK 相比显著降低,150 mmol·L-1CaCl2胁迫下,AUS 和HN 种质叶宽均显著低于CK,JS 种质幼苗株高在此胁迫浓度开始显著低于CK。200 mmol·L-1CaCl2胁迫下HN 种质幼苗叶长与JS 种质幼苗叶宽显著低于CK。AUS 种质幼苗叶长和株高降低幅度最大,相比CK 降低39.77%和47.44%,JS 种质幼苗叶宽降低幅度最大,为30.77%。

表2 钙盐胁迫对3 份葛藤种质幼苗生长指标的影响Table 2 Effects of calcium salt stress on seedling growth indexes of three P.lobata germplasms
由表2 可知,随胁迫浓度升高,3 份葛藤种质幼苗地上部与地下部干重均表现为降低趋势。与CK 相比,AUS种质幼苗地上部干重降低幅度最大,降低46.00%,HN 种质幼苗地下部干重降低幅度最大,降低66.67%。50 mmol·L-1CaCl2胁迫下,AUS、HN 和JS 种质幼苗地上部干重相比CK 降低6.00%、12.50%和4.76%。3 份葛藤种质的地上、地下部干重在50 mmol·L-1CaCl2浓度下均与CK 无显著差异。
2.3 钙盐胁迫对3 份葛藤种质相对电导率、丙二醛和渗透调节物质含量的影响
由图2 可知,伴随钙盐胁迫浓度升高,3 份葛藤种质相对电导率和MDA 含量的变化趋势基本相同,均随着胁迫程度的增强整体呈升高趋势。整个处理过程中,AUS 种质相对电导率(除CK 和50 mmol·L-1)和MDA 含量始终高于JS 和HN 种质。AUS 种质相对电导率变化幅度最大,JS 种质变化幅度最小,AUS、HN、JS 种质最大相对电导率与CK 相比分别显著升高85.14%、67.10%和77.35%。3 份葛藤种质幼苗叶片Pro 含量随胁迫浓度的增加,表现为先增后减的趋势。AUS 种质在胁迫浓度为100 mmol·L-1,JS 和HN 种质均在胁迫浓度为150 mmol·L-1时,叶片Pro 含量达到最大值且显著高于CK。3 份葛藤种质幼苗叶片可溶性糖含量整体呈先升后降的相似趋势,但3 份种质叶片可溶性糖含量达到最高时的CaCl2胁迫浓度不同,JS 为50 mmol·L-1、AUS 和HN 均为100 mmol·L-1。与CK 相 比,JS 的 可溶 性 糖含 量 变化 幅 度 最 大,为CK 的2.21 倍。CaCl2胁迫 浓 度为200 mmol·L-1时,AUS 种质可溶性糖含量最低,而JS 种质最高。
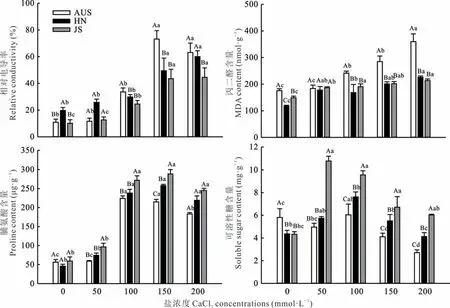
图2 钙盐胁迫对3 份葛藤种质相对电导率、丙二醛和渗透调节物质含量的影响Fig. 2 Effects of calcium salt stress on relative conductivity,malondialdehyde and osmotic adjustment substance contents of three P. lobata germplasms
2.4 钙盐胁迫对3 份葛藤种质抗氧化酶活性的影响
由图3 可知,随钙盐胁迫浓度升高,AUS 和HN 种质叶片POD 活性表现为先升后降的趋势,JS 种质表现为不断上升趋势。其中AUS 种质的变化幅度最大,其叶片POD 活性在CaCl2浓度为150 mmol·L-1时,相比CK 显著增高82.83%,CaCl2胁迫浓度为200 mmol·L-1时,AUS 种质的POD 活性显著下降,JS 和HN 种质则无显著变化。3 份葛藤种质叶片CAT 活性整体变化趋势为先升后降。3 份葛藤种质叶片CAT 活性均在CaCl2浓度为50 mmol·L-1时达到最高。3 份葛藤种质叶片SOD 活性随CaCl2胁迫浓度升高,均呈先升后降的趋势,但3 份葛藤种质SOD活性升至最大值时的胁迫浓度不同,HN 和JS 种质在150 mmol·L-1时达到最大值,而AUS 种质在50 mmol·L-1即达到最大值。在整个胁迫处理期间,AUS 种质的SOD 活性均低于HN 和JS 种质(除50 mmol·L-1)。3 份葛藤种质叶片APX 活性的变化趋势和幅度不同,AUS 种质叶片APX 活性表现为先增后减趋势,而HN 和JS 种质随CaCl2胁迫浓度的升高表现为持续上升趋势,并在200 mmol·L-1时达到最大值。AUS 种质在50 mmol·L-1时其APX 活性达到最大值且显著高于HN 和JS 种质,分别高58.09%和73.74%。
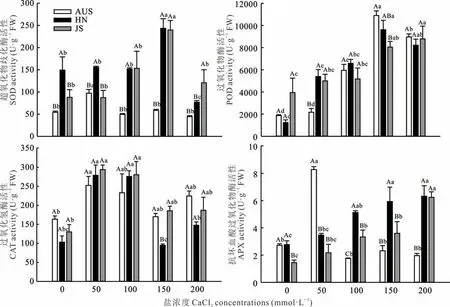
图3 钙盐胁迫对3 份葛藤种质叶片过氧化物酶、过氧化氢酶、超氧化物歧化酶和抗坏血酸过氧化物酶活性的影响Fig. 3 Effect of calcium salt stress on the activities of peroxidase(POD),catalase(CAT),superoxide dismutase(SOD)and ascorbate peroxidase(APX)in leaves of three kinds of P. lobata germplasms
2.5 钙盐胁迫对3 份葛藤种质幼苗叶片内源激素含量的影响
由表3 可知,不同浓度的钙盐胁迫下3 份葛藤种质幼苗叶片中的ABA、IAA 和GA3含量均表现为先增后减的趋势。AUS 种质叶片ABA 含量变化幅度最大,在CaCl2浓度为50 mmol·L-1时就达到最大值(103.67 ng·g-1),并显著高于CK 和JS 及HN 种质,JS 种质ABA 含量变化幅度最小,在100 mmol·L-1时达到最大值,为CK 的1.36倍。在高钙盐胁迫浓度(150~200 mmol·L-1)下,3 份葛藤种质叶片IAA 含量均小于CK。AUS 和JS 种质叶片GA3含量均在CaCl2浓度为100 mmol·L-1时达到最大值并显著高于CK,分别为CK 的1.28 和1.36 倍。HN 种质
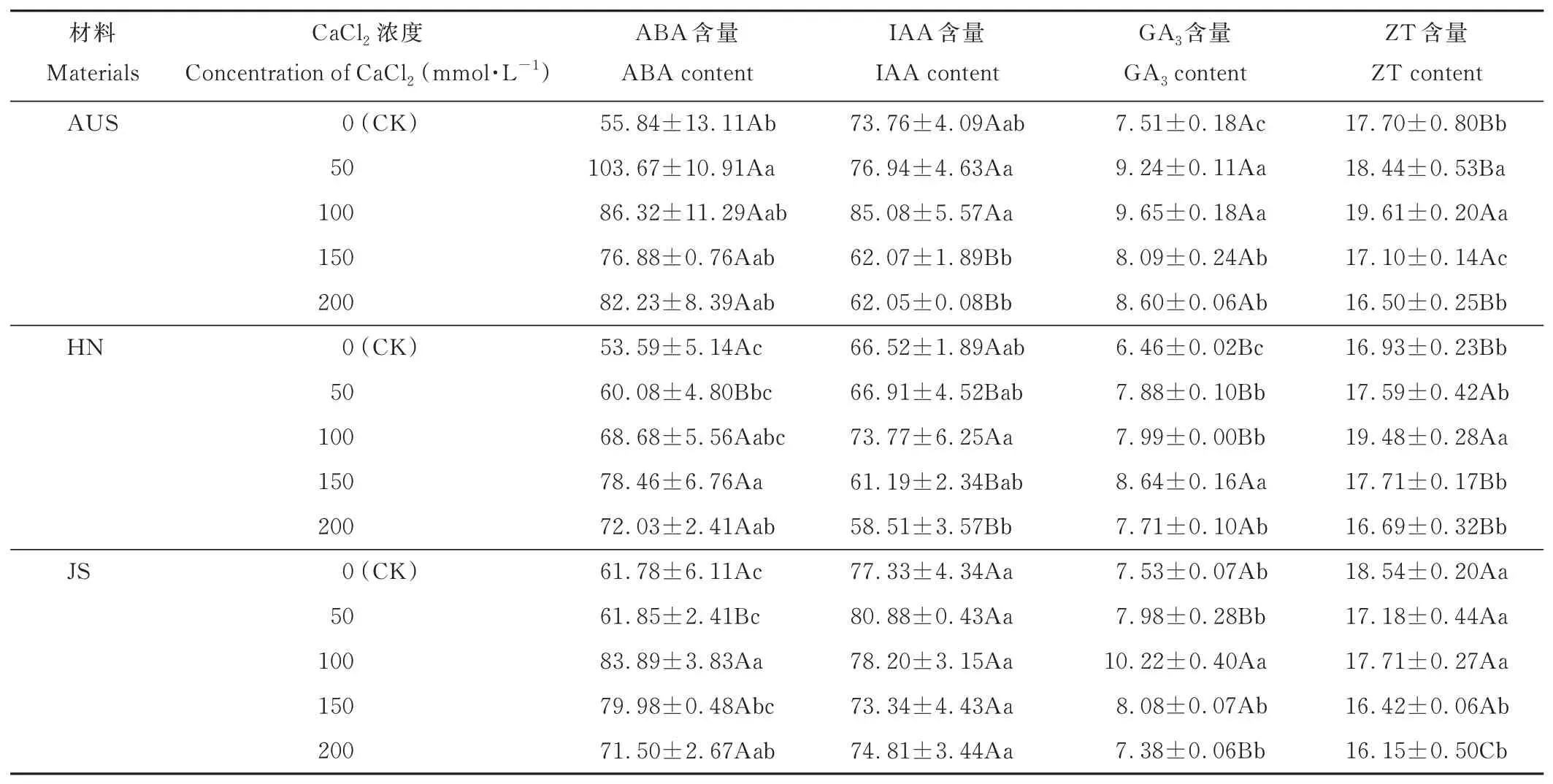
表3 钙盐胁迫下3 份葛藤种质叶片内源激素含量的变化Table 3 Changes of endogenous hormone contents in leaves of three P.lobata germplasms under calcium salt stress(ng·g-1)
叶片GA3含量在150 mmol·L-1时为最大值(8.64 ng·g-1)。3 份葛藤种质叶片ZT 含量变化趋势和变化幅度差异较大,AUS 和HN 种质叶片ZT 含量表现为先增后减趋势,两份种质在胁迫浓度达到100 mmol·L-1时均达到最大值,分别为19.61 和19.48 ng·g-1。JS 种质叶片ZT 含量表现为随胁迫浓度增加呈下降趋势,200 mmol·L-1时,其ZT 含量达到最小值(16.15 ng·g-1)。
2.6 耐盐性综合评价
2.6.1不同钙盐胁迫下3 种葛藤的耐盐性指标主成分分析 由表4 和表5 可以看出,AUS 葛藤耐盐性指标主成分分析的第Ⅰ主成分特征值λ1=15.008,贡献率为71.468%,指标对应的特征向量中,发芽势、发芽指数、活力指数、叶长、地上部干重和地下部干重性状 数 值 较 大,分 别 为0.251、0.257、0.257、0.257、0.256 和0.255,主要反映出盐胁迫下,AUS 种质种子活力及幼苗生长形态状况;第Ⅱ主成分的特征值和贡献率分别为4.137 和19.699%。对应的特征向量中CAT、ABA、IAA、GA3、ZT 性状数 值较大,分别为0.282、0.463、0.360、0.382 和0.443,主要反映出盐胁迫下AUS 种质幼苗的抗氧化酶和内源植物激素的状况。HN 葛藤耐盐性指标主成分分析的第Ⅰ主成分特征值λ1=12.585,贡献率为59.931%,耐盐性指标所对应的特征向量中,活力指数、叶宽、株高和地上、地下部干重数值较大,分别为0.281、0.258、0.277、0.271、0.259,集中反映HN 种质种子活力和幼苗生物量状况。第Ⅱ主成分的特征值和贡献率分别为7.199 和34.281%。其中耐盐性指标特征向量中的叶长、SOD、可溶性糖和ZT 含量数值较大,分别为0.322、0.340、0.303 和0.360,反映出盐胁迫下HN 种质幼苗生长、抗氧化酶和内源植物激素变化状况。
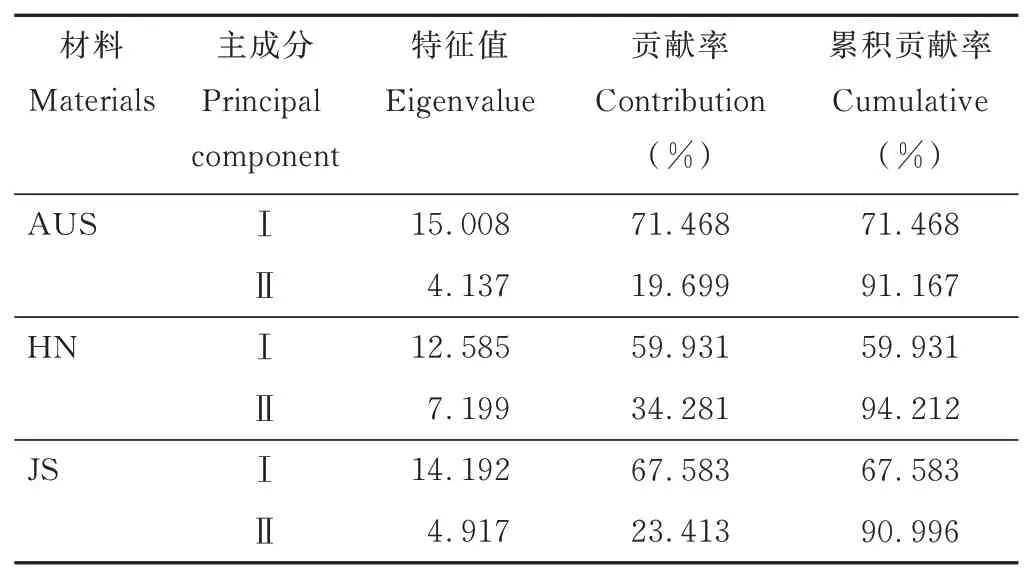
表4 3 份葛藤种质耐盐性指标的特征值和贡献率Table 4 Eigenvalue and contribution of salt tolerance index of three kinds of P.lobata germplasms

表5 3 份葛藤种质耐盐性指标的主成分分析Table 5 Principal component analysis of salt tolerance index of three kinds of P.lobata
JS 葛藤耐盐性指标主成分分析的第Ⅰ主成分特征值λ1=14.192,贡献率为67.583%,耐盐性指标所对应的特征向量中,发芽率、发芽势、发芽指数、叶长、株高、地上及地下部干重、相对电导率、POD 和CAT 数值较大,分别为0.254、0.259、0.261、0.260、0.259、0.256、0.254、0.250、0.250 和0.252,集中反映JS 葛藤种子活力和幼苗生长状况。其第Ⅱ主成分的特征值和贡献率分别为4.917 和23.413%。其中耐盐性指标特征向量中的丙二醛、可溶性糖、ABA、IAA、GA3含量数值较大,分别为0.410、0.418、0.318、0.340 和0.406,反映出盐胁迫下JS 葛藤幼苗的渗透调节作用与内源植物激素的变化状况。
综上可知,第Ⅰ、Ⅱ主成分分别集中反映出AUS、HN、JS 葛藤种质耐盐性指标的累积贡献率达到91.167%、94.212%、90.996%,对葛藤耐盐性综合评价的指示意义较大。表5 中各耐盐性指标特征向量数值越大,表明该指标越能集中反映3 份葛藤种质种子萌发及幼苗生长对钙盐胁迫的敏感性。因此,发芽势、发芽指数、活力指数、叶长、地上部干重和地下部干重、CAT、ABA、IAA、GA3、ZT 含量可作为AUS 葛藤种质耐盐性综合评价的主要指标;种子活力指数、叶宽、株高和地上、地下部干重、叶长、SOD、可溶性糖和ZT 含量可作为HN 葛藤种质耐盐性综合评价的主要指标;种子发芽率、发芽势、发芽指数、叶长、株高、地上及地下部干重、相对电导率、POD、CAT、MDA、可溶性糖、ABA、IAA、GA3含量可作为JS 葛藤种质耐盐性综合评价的主要指标。
2.6.23 份葛藤种质对钙盐胁迫的耐受性综合评价 通过对3 份葛藤各耐盐性指标的主成分分析,得出3 份葛藤种质生长生理指标中可以作为钙盐胁迫耐受性评价的指标,利用模糊数学隶属函数法对筛选出的3 份葛藤种质的生长生理指标进行钙盐耐受性评价(表6),用每份葛藤种质各项指标隶属度的平均值作为种质耐钙盐能力综合鉴定标准,该值越大耐钙盐性越强。结果显示:AUS、HN 和JS 种质的隶属函数平均值分别为0.475、0.487、0.495,表明3 份葛藤种质耐钙盐能力顺序为JS>HN>AUS。
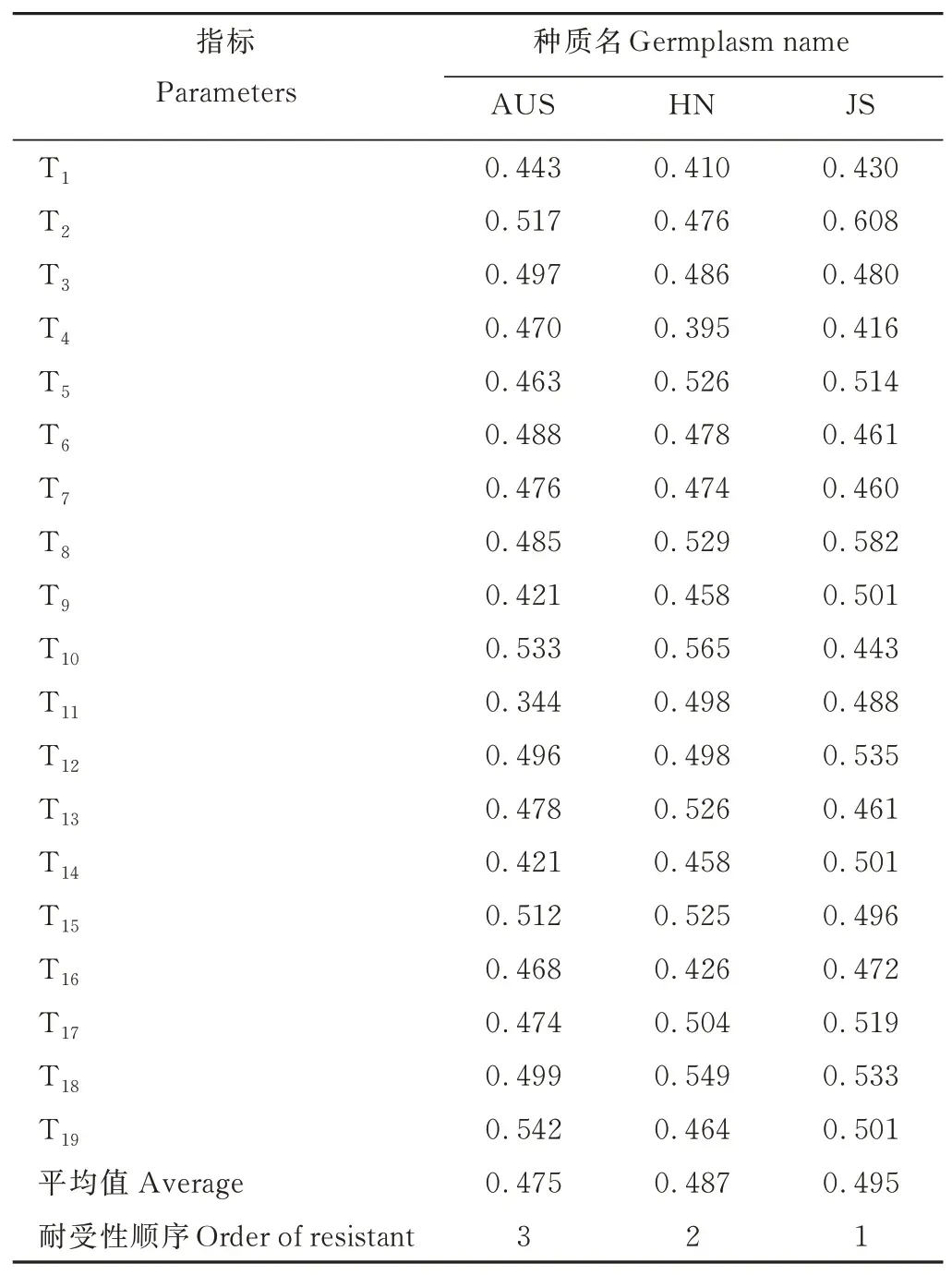
表6 3 份葛藤种质对不同钙盐浓度的耐受性综合评价Table 6 Comprehensive evaluation of tolerance of three P.lobata germplasms to different calcium concentrations
3 讨论
3.1 葛藤种子萌发期对钙盐的适应性反应
植物种子在萌发期对外界盐胁迫十分敏感,植物种子发芽能力受众多因素的影响[22]。种子发芽率、发芽势、发芽指数、活力指数等指标能够较集中地反映种子的发芽能力[23]。本研究表明在钙盐胁迫处理浓度为50 mmol·L-1时,3 份葛藤种质种子的发芽率、发芽势、发芽指数、活力指数除AUS 种质的种子活力指数和HN 种质的发芽指数显著低于CK 外,其余种质发芽指标均与CK 无显著差异,表明低钙盐浓度(50 mmol·L-1)胁迫对种子萌发无显著抑制作用,种子发芽能力基本不受影响,3 份种质对该钙盐浓度胁迫耐受性较强。可能原因是低钙盐胁迫浓度下,细胞中钙离子参与胁迫信号的感受、传递、响应与表达,进而提高了植物抗逆性。从100 mmol·L-1CaCl2浓度开始,AUS 和JS 种质的各项发芽指标与CK 相比开始显著降低,到高钙盐(200 mmol·L-1)浓度胁迫时,两者的种子正常萌发受到显著抑制。可能原因是高浓度钙盐胁迫会对种子产生离子毒性,抑制种子正常萌发,这与孔德政等[24]和李玉梅等[25]的研究结果一致。HN 种质种子发芽率、发芽势与CK 相比,中钙盐(100~150 mmol·L-1)浓度胁迫下略有上升趋势但不显著,当胁迫达到高钙盐(200 mmol·L-1)浓度才开始显著低于CK,表明其发芽能力虽较弱,但种子应对钙盐胁迫时抗逆性较好,可能因为HN 葛藤种质种子种皮较硬,导致种子休眠,提高了种子的耐钙盐性,导致其在低钙盐胁迫下发芽能力低于AUS 和JS 种质,但中高钙盐胁迫下却高于二者。种子休眠在植物界十分常见,是植物帮助自己度过不良环境的一种常见手段,种子种胚未成熟或缺少必要的激素刺激及种皮或果皮等物理因素的限制是造成种子休眠的因素[26]。
3.2 葛藤幼苗生长及生理对钙盐的适应性反应
3.2.1生长响应 植物在应对盐胁迫时,会通过降低株高、叶长、叶宽等形态指标来适应胁迫造成的逆境[27],同时通过对自身不同部位分配不同生物量来维持自身的正常生长[28]。菘蓝(Isatis indigotica)幼苗在低浓度盐环境下能维持其正常生长,浓度过高时其生长明显受到抑制[29],狭叶香蒲(Typha angustifolia)在高钙盐胁迫浓度下的生长被抑制[30]。本研究中,低钙盐(50 mmol·L-1)浓度胁迫下,3 份葛藤种质幼苗叶长、叶宽、株高(除HN 种质)和地上部干重整体均与CK 无显著差异,表明低钙盐胁迫对3 份葛藤幼苗生长均没有产生显著抑制。中高钙盐浓度均显著抑制3 份葛藤种质幼苗正常生长,幼苗叶长、叶宽、株高和地上部干重与CK 相比均显著降低。HN 和JS葛藤种质地下部干重在高钙盐浓度胁迫下仍与CK 无显著差异,可能原因是植物通过维持一定的地下生物量来提高自身水分及养分的利用效率,从而提高自身耐盐能力[31]。
3.2.2生理响应 盐胁迫会导致植物细胞内产生大量活性氧,造成植物细胞膜脂中的不饱和脂肪酸过氧化,导致终产物MDA 含量增加,MDA 含量和相对电导率大小在一定程度代表细胞膜损伤程度和植物抗逆能力[32-33]。本研究中,MDA 含量与相对电导率大小随钙盐浓度的升高整体呈逐渐上升趋势,与贾兴平等[34]的研究结果一致。50 mmol·L-1胁迫下,3 份葛藤幼苗叶片相对电导率均略大于CK 但无显著差异,AUS 葛藤种质幼苗MDA 含量略高于CK 但不显著,HN 和JS 葛藤种质幼苗叶片MDA 含量与CK 相比显著升高,表明低钙盐胁迫浓度下,3 份葛藤种质幼苗细胞受到逆境胁迫开始导致细胞膜膜脂过氧化,但生长指标未受到显著抑制,说明其他生理指标起到了重要的调控作用。
大量研究表明,植物遭受盐胁迫时会引起细胞水分亏缺,导致体内渗透调节物质含量明显升高[35-37]。游离脯氨酸和可溶性糖是细胞内普遍存在的有机渗透调节物质,脯氨酸可作为溶质来调节细胞水分环境的变化[38],逆境中积累的脯氨酸还可作为能量和氮源的储存库,胁迫解除后直接参与植物代谢[39],可溶性糖可维持细胞膜稳定,提高细胞保水力和原生质弹性来保持植株自身活力[40]。本研究中,3 份葛藤种质幼苗叶片可溶性糖和游离脯氨酸含量随CaCl2浓度的增加均表现为先升后降趋势,可能是在中低钙盐浓度(50~100 mmol·L-1)胁迫下,植物为适应逆境环境,细胞内脯氨酸和可溶性糖大量合成,以维持植物细胞内外的渗透势稳定,保证植物代谢的正常进行与植株正常生长[41]。2 个指标分别在150(除AUS)和100 mmol·L-1(除JS)达到峰值,并在高钙盐浓度,特别是200 mmol·L-1胁迫时,植物细胞内脯氨酸和可溶性糖含量下降,可能是随胁迫浓度持续升高,盐害逐渐加重,植物体内的渗透调节物质合成速度逐渐减弱,而降解速度逐渐增快所致。本研究结果表明,3 份葛藤种质中,JS 脯氨酸含量和可溶性糖含量在各盐胁迫梯度下均高于其他两份种质,表明JS 种质的渗透势较其他2 份种质稳定。
逆境胁迫下,SOD 可将植物体内产生的伤害性物质O2-歧化为H2O2和O2,从而减轻植物体的损伤程度[42]。而由于SOD 歧化作用产生的过量H2O2,会在植物体内被氧化形成可以引起细胞膜脂过氧化的羟自由基(·OH),CAT、POD 和APX 均具有清除植物体内H2O2的能力,可以使植物体内自由基保持较低水平状态[43]。CAT 具有较高的酶活性效率,但对H2O2的亲和力较弱。POD 对H2O2有高的亲和力,但它能参与叶绿素的降解并引起膜脂过氧化[44]。本试验中,SOD 和POD 活性在150 mmol·L-1时增长明显,CAT 活性在50~100 mmol·L-1时增长明显,一方面表明在不同钙盐浓度胁迫下,不同抗氧化酶在清除H2O2中起主导作用,但关于抗氧化酶作用的关联性有待于进一步深入研究;另一方面表明在面临逆境胁迫时,植物能及时启动保护酶系统进而有效地清除植物体内的过氧化物,这是葛藤对环境胁迫的一种适应性反应。3 份种质叶片SOD、POD(除JS)和CAT 的活性达到峰值后,随着钙盐胁迫浓度增加开始下降,表明葛藤体内保护酶系统受损,过氧化物质的产生与清除开始失衡,植物体正常生长受到损害。JS 种质POD 和APX 活性在整个胁迫期表现为持续上升趋势,有别于其他种质,表明其保护酶系统受损较小。这一生理差异与3 份葛藤种质在遭受持续钙盐胁迫时植株的形态变化是一致的。
3.2.3体内激素响应 面对逆境胁迫时,植物通过调节体内激素含量的变化来调控植物的新陈代谢,从而使植物能够维持正常的生理功能[45]。植物内源激素是重要的生长调节物质。IAA、GA3和ZT 主要表现为促进生长作用,ABA 主要表现为生长抑制作用[46]。ABA 是重要的反映植物遭受胁迫反应的植物激素,本试验中,ABA、IAA 和GA3含量均随盐胁迫浓度的增加表现为先增后减趋势。可能原因是在低浓度胁迫时,葛藤尚能通过调节这几种激素的水平降低生理需求,抵抗胁迫,而高浓度的钙盐胁迫对植物造成更大的伤害,使得各部位不能再协同调节,表现为激素合成下降,植物生长受到显著影响。前人对于盐胁迫下ZT 含量变化的研究结果也不尽相同,其中湖北海棠(Malus hupehensis)[47]叶片ZT 含量随着盐浓度的增加呈上升趋势,而杨树(Populus)[48]、向日葵(lianthus annuus)[49]的变化趋势却相反。本研究中,3 份葛藤种质叶片ZT 含量变化在整个胁迫期有不同变化趋势,AUS 和HN 种质均随盐胁迫浓度的增加表现为先增后减趋势,JS 种质则表现为随胁迫浓度增加呈下降趋势,有学者认为这是由于植物细胞内外离子平衡随电解质渗漏被打破,破坏了细胞器正常合成ZT 激素的pH 环境,从而抑制了ZT 的正常合成[50]。不同植物对逆境反应的调控机制不同,植物可能通过多种激素的相互协调,来维持自身的正常生长,对此仍需进一步研究。
3.3 耐盐性综合评价
植物耐盐性是由多种因素的相互作用和协同作用决定的,钙盐胁迫对植物的影响是多方面的,植物通过自身营养物质、渗透调节物质和保护酶活性等多种生理机制的共同作用来减轻或延缓伤害的发生[51]。因此,选择单一的耐盐种质材料筛选评价指标局限性较大,本研究结合主成分分析法和模糊隶属函数法对3 份葛藤种质耐盐性进行综合评价,经主成分分析筛选出耐盐性综合评价的主要指标,克服了信息重叠与指标的相关性,既避免单一指标的片面性,又在多指标的基础上对3 份葛藤种质进行隶属函数综合评价,求得3 份葛藤种质不同生长生理指标的隶属函数平均值,作为不同种质耐钙盐能力综合鉴定标准,该值越大,葛藤耐盐性越强。结果表明发芽率、发芽势、发芽指数、活力指数、叶长、叶宽、株高、地上部干重、地下部干重、MDA、POD、CAT、SOD 活性、相对电导率、可溶性糖、ABA、IAA、GA3、ZT 含量对钙盐胁迫处理比较敏感,可将其作为3 份葛藤种质耐盐性综合评价指标。AUS 种质对钙盐胁迫耐受性最差,HN 种质次之,JS 种质最强。
4 结论
通过研究不同浓度钙盐胁迫对不同产地3 份葛藤种质种子萌发、幼苗生长、渗透调节物质、抗氧化酶系统及植物内源激素的影响,认为高钙盐浓度显著抑制葛藤种子萌发率、萌发速度及种苗生活力,但部分种子可通过种子休眠来规避这种逆境。为缓解钙盐胁迫伤害,葛藤幼苗通过提高自身有机渗透调节物质含量、增强不同时期不同抗氧化酶活性、改变内源激素含量等方式来快速调节自身生理代谢功能,进而更迅速适应钙盐胁迫环境。CaCl2浓度在0~50 mmol·L-1时,对葛藤种质幼苗无显著抑制作用,表明葛藤对低钙盐胁迫具有一定耐受性。结合主成分和隶属函数分析,本研究认为AUS 种质对钙盐胁迫耐受性最差,HN 种质次之,JS 种质最强。

