丁酸盐对C2C12成肌细胞的增殖和分化作用
管理,曹子怡,陈洁
复旦大学附属华东医院消化内科,上海 200040
肌少症是一种与年龄相关的进行性、全身性骨骼肌疾病,涉及肌肉质量下降和肌肉功能丧失,可引发跌倒、骨折、衰弱和死亡等不良后果。回顾性研究提示,亚洲人群的肌少症患病率为5.5%~25.7%[1-2]。肌少症的发生由炎症、免疫衰老、肌肉蛋白合成代谢、氧化应激和肌卫星细胞活性抑制等共同作用[3-7],在机体活动减少和营养不良的情况下,这些机制会进一步影响肌少症[8]。因此,抗阻运动联合营养补充是治疗和预防肌少症的有效方法[9],但由于目前肌少症的发病机制不明,具体的营养素补充剂以及治疗靶点仍未有定论。近年来的研究表明,肠道微生物群可能参与肌少症的发生,增龄引起的肠道菌群组成及其衍生代谢物改变可以促进慢性炎症和肌肉蛋白合成代谢抵抗,最终导致肌肉质量下降和功能受损[10-11]。丁酸盐是一种短链脂肪酸(short-chain fatty acid,SCFA),目前已知的丁酸盐作用多通过抑制组蛋白脱乙酰酶产生的表观遗传效应[12]。虽然SCFA 能够改善肌肉组织功能,但丁酸盐本身对肌肉萎缩的影响及具体作用机制仍有待确定。本研究旨在探索肠道菌群代谢物在肌少症人群中的改变,明确SCFAs(尤其是丁酸盐)对肌肉组织的作用,为肌少症的防治提供崭新思路。
1 材料和方法
1.1 一般资料
2020年11月—12月,经纳入、排除标准筛选后入选共和新路街道及甘泉路街道的社区老年人14 例。纳入标准:(1)年龄≥60 岁;(2)性别不限;(3)本地常住人口。排除标准:(1)常年卧床;(2)体成分发生急性变化(显著水肿或脱水);(3)发热、感染或不明原因传染病;(4)患有严重心、肺、肾和脑疾病;(5)近3 个月使用抗生素、非甾体抗炎药、抗过敏药或类固醇激素;(6)近3 个月患有严重影响身体活动的疾病(手术或骨折);(7)过去1 周存在吸烟、饮酒等影响肠道菌群的行为。本研究通过复旦大学附属华东医院伦理委员会审批(20190068),所有受试者自愿参与本研究,并签署知情同意书。
14 例受试者年龄62~85 岁,平均(71.5 ±8.1)岁,其中男性5 例、女性9 例,肌少症6 例、非肌少症8例。与非肌少症组比较,肌少症组四肢骨骼肌质量(appendicular skeletal muscle mass,ASM)降低,6 m 步速减慢,丁酸盐水平降低,差异均有统计学意义(P<0.05)。2 组的年龄、性别、体质量指数(body mass index,BMI)、骨骼肌质量指数(appendicular skeletal muscle mass index,ASMI)和握力差异均无统计学意义。后续研究选择丁酸盐作为干预因素。见表1。
表1 2 组一般资料比较(±s,n=14)
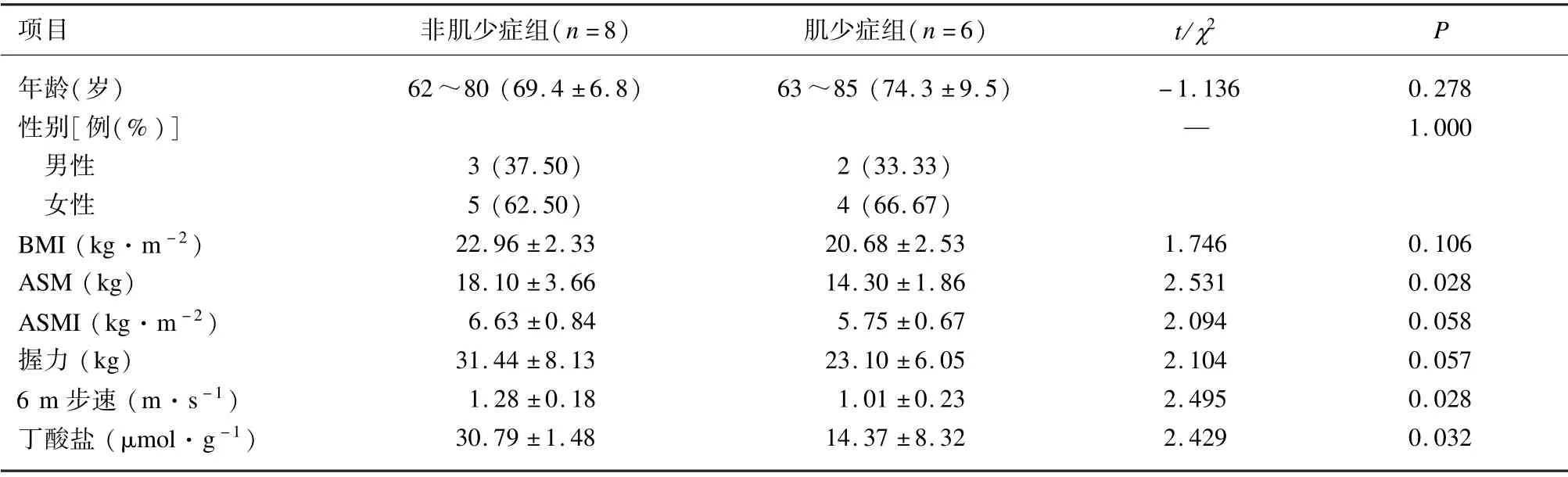
表1 2 组一般资料比较(±s,n=14)
项目 非肌少症组(n=8) 肌少症组(n=6) t/χ2 P年龄(岁) 62~80 (69.4 ±6.8) 63~85 (74.3 ±9.5) -1.136 0.278性别[例(%)]— 1.000男性 3 (37.50) 2 (33.33)女性 5 (62.50) 4 (66.67)BMI (kg·m -2) 22.96 ±2.33 20.68 ±2.53 1.746 0.106 ASM (kg) 18.10 ±3.66 14.30 ±1.86 2.531 0.028 ASMI (kg·m -2) 6.63 ±0.84 5.75 ±0.67 2.094 0.058握力(kg) 31.44 ±8.13 23.10 ±6.05 2.104 0.057 6 m 步速(m·s -1) 1.28 ±0.18 1.01 ±0.23 2.495 0.028丁酸盐(μmol·g -1) 30.79 ±1.48 14.37 ±8.32 2.429 0.032
1.2 肌少症诊断
1.2.1 肌肉质量通过人体成分分析仪(Inbody 270)检测受试者的ASM,ASMI=ASM/身高2。
1.2.2 肌肉力量受试者站立位,双臂自然垂于身体两侧,用力握住握力器(瑞狮生物科技有限公司)手柄,测量3 次,记录测量最大值。
1.2.3 躯体功能受试者以日常步速沿直线方向行走6 m,可借助拐杖(不鼓励使用)。共测试2 次,计算2 次的平均6 m 步速。
采用2019年亚洲肌少症工作组[13]推荐的诊断阈值评估肌少症:(1)男性ASMI<7.0 kg/m2、女性ASMI<5.7 kg/m2为肌肉质量下降;(2)男性握力<28.0 kg、女性握力<18.0 kg 为肌肉力量下降;(3)步速<1 m/s为躯体功能受损。在满足肌肉质量下降的基础上,握力与步速符合任1 项即可确诊为肌少症,据此将所有受试者分为肌少症组和非肌少症组。
1.3 标本采集
采集受试者粪便样本,并于-80 ℃冰箱保存,由麦特绘普生物科技(上海)有限公司提取代谢物,经衍生化处理后基于UPLC-MS/MS 平台,通过Q300TM试剂盒(麦特绘谱,HY5023R)进行代谢物检测。
1.4 药物与试剂
DMEM 高糖培养基、青霉素-链霉素(双抗)、马血清、胎牛血清、0.25%胰蛋白酶-EDTA(美国Gibco 公司,货号分别为11995065、15140122、16050122、10091148、25200056);抗-Ki67 抗体、抗-Myf5 抗体(英国Abcam公司,货号分别为ab15580、ab125301);Hoechst 抗体(美国Thermo Fisher 公司,货号H3570);抗-MyoD 抗体(中国Santa Cruz 公司,货号sc-377460);抗-MyHC抗体(美国R&D Systems 公司,货号MF20);β-Tubulin抗体、二抗鼠IgG 抗体、二抗兔IgG 抗体(美国CST 公司,货号分别为5346S、7076S、7074P2);PBS 缓冲液(中国Bioss 公司,货号C01-01001);CCK-8 试剂盒(日本同仁化学研究所,货号CK04);反转录试剂盒(中国Takara 公司,货号RR036A);RIPA 裂解液、SDS-PAGE 凝胶配制试剂盒(中国碧云天公司,货号分别为P0013B、P0012A)。
1.5 细胞培养及分化
1.5.1 溶液制备丁酸钠购自上海阿拉丁生化科技有限公司(货号S102956),充分溶于ddH2O,制成1 000 mmol/L 的丁酸盐溶液备用,避光环境下室温储存。
1.5.2 细胞培养及分组C2C12 成肌细胞购自富恒生物,应用DMEM 高糖培养基,于37 ℃、5%CO2细胞培养箱中培养。2~3 d 更换1 次生长培养液(DMEM +10%胎牛血清+1%青霉素-链霉素)。待细胞贴壁后,丁盐酸组每4 mL 培养液加入3 μL 丁酸盐储备液,对照组加入等体积、浓度的ddH2O。
1.5.3 细胞分化2 组细胞经丁酸盐和ddH2O处理48 h 后,当细胞密度≥80%时吸弃生长培养液,加入分化培养液(DMEM +2%马血清+1%青霉素-链霉素)进行分化诱导,隔天换液,持续96 h。
1.6 CCK-8 细胞增殖实验
将每孔2 ×103个细胞接种于96 孔板中,每孔加入10 μL CCK-8 进行细胞增殖检测。恒温箱孵育1~2 h后,于24 h、48 h 使用酶标仪检测450 nm 处的吸光度。
1.7 免疫荧光染色
丁酸盐处理48 h 后,检测C2C12 成肌细胞的增殖效应。PBS 缓冲液润洗细胞2 遍,每个细胞培养皿中加入4%多聚甲醛固定60 min。1 mL PBS 慢洗3 遍,每遍5 min。封闭液(PBS +10% 山羊血清+0.3%Triton)覆盖皿底,室温孵育1 h。使用抗-Ki67 抗体标记增殖的细胞核,Hoechst 抗体标记全体细胞核。抗-Ki67 一抗(1∶100)4 ℃冰箱孵育过夜,荧光鼠/兔IgG二抗(1∶500)室温孵育2 h。PBS 充分洗涤细胞培养皿后,以PBS 稀释Hoechst 抗体(1∶500),室温避光孵育20 min。通过激光共聚焦显微镜(德国Leica,TCS SP8)对每个样品随机取5 个视野显像。
Ki-67 是一种标记细胞增殖状态的核抗原,Ki-67增殖指数常被用于评价细胞增殖水平。Ki-67 增殖指数=阳性细胞核数/全体细胞核数。
1.8 蛋白免疫印迹检测
将处理后的细胞充分裂解,并加入上样缓冲液。蛋白样本移入金属水浴锅中100 ℃加热15 min 变性,室温下冷却5 min 后离心,取上清加入SDS-PAGE 凝胶样品槽。转膜后将0.4 μm 聚偏二氟乙烯膜(美国Merck 公司)放入BSA 封闭液中置低速摇床上封闭1 h。使用MyoD、Myf5、MyHC 一抗(1∶1 000)4 ℃孵育过夜,鼠/兔IgG 二抗(1∶2 000)室温孵育2 h。充分洗膜后通过ECL 化学发光成像系统对条带进行显影。
1.9 统计学分析
使用SPSS 20.0 进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,2 组间比较采用独立样本t检验;计数资料以例数(%)表示,2 组间比较采用Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结果
2.1 丁酸盐促进C2C12 成肌细胞增殖
采用CCK-8 检测丁酸盐对C2C12 成肌细胞增殖能力的影响。与对照组比较,丁酸盐处理48 h 后C2C12成肌细胞增殖率上调。对2 组细胞的Ki-67 增殖指数进行统计分析,与对照组比较,丁酸盐组Ki-67 +细胞核增多(16.82%vs35.96%,P=0.009)。见图1。

图1 丁酸盐促进C2C12 成肌细胞增殖(n=3)
2.2 丁酸盐改善C2C12 成肌细胞分化
与对照组比较,分化48 h 后丁酸盐组C2C12 成肌细胞MyoD、Myf5 的蛋白表达水平升高(P<0.05);分化96 h 后丁酸盐组C2C12 成肌细胞MyHC 的蛋白表达水平升高(P<0.01)。见图2。
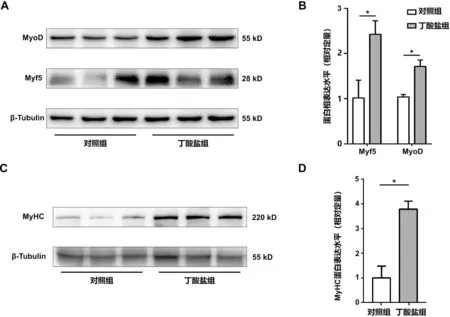
图2 丁酸盐改善C2C12 分化水平(n=3)
3 讨论
近年来测序分析技术不断进步,帮助研究者挖掘微生物学标志物,实现由微生物群落的比较到临床诊断与微生物学应用的跨越[13-14]。人体内微生物群落与健康和疾病等因素密切相关[15-16]。
目前,已知促进骨骼肌生长的特定肠道菌群种类包括干酪乳杆菌、长双歧杆菌、直肠真杆菌、球状梭菌和巴氏杆菌。这些菌种通过产生SCFA 来改善肌肉的功能[17-18],而菌群紊乱导致SCFA 减少可引起胰岛素抵抗,减少线粒体脂肪酸氧化,继而引起肌肉内脂肪酸沉积增多。这种现象会使肌肉力量与质量下降,并进一步促进胰岛素抵抗,从而形成恶性循环,最终导致肌少症的发生[19-20]。此外,SCFA 可以增加血清中胰岛素样生长因子1 的含量,促进卫星细胞增殖,改善肌肉再生[21]。补充剂(如基于果聚糖的益生元或抗性马铃薯淀粉等)可以增加个别产丁酸菌的相对丰度,提高丁酸的产量[22]。摄取益生元(如菊粉型果聚糖和阿拉伯低聚木糖)有利于促进双歧杆菌与产丁酸菌之间的相互作用,从而增加产量。因此,联合营养和运动的综合治疗方案,可以促进衰弱老人肠道微生物群结构的年轻化。
本次研究表明,丁酸盐通过改善成肌细胞增殖促进肌肉再生。一方面丁酸盐对于C2C12 成肌细胞有促增殖效应;另一方面丁酸盐上调Myf5、MyoD 的表达水平,进而改善成肌细胞分化水平。促分裂原活化的蛋白激酶信号传导是增殖、分化等细胞活动的基础,对该通路的调控有利于改善肌细胞的细胞活力和蛋白质降解。此外,丁酸盐对能量摄取的调节作用以及胞内脂滴沉积的缓解,有利于改善肌细胞的分化水平[23]。通过对组蛋白去乙酰化酶的抑制,丁酸盐还有助于调节性T 细胞的分化[24]。成肌细胞的促增殖环境为预防、治疗随年龄引起的骨骼肌退化提供了新的视角。
本研究通过对社区老年人群粪便样本的代谢物检测,结合分子生物学实验,验证了特定浓度的丁酸盐对C2C12 成肌细胞生成的促进作用。后续研究中,更大的样本量将有利于明确产丁酸菌是否为肌少症患者与健康人群间的差异菌种,同时血清学数据有助于确定丁酸盐与肌少症之间的相关性[25]。

