老年胃癌伴腹膜转移患者预后不良的危险因素及模型建立
钱金平,吉冬丽
南通市肿瘤医院消化肿瘤内科,江苏南通 226000
胃癌是我国常见的消化道恶性肿瘤之一,主要发病于中老年人群,早期症状隐匿,确诊时多处于终末期,预后较差。胃癌常见的治疗手段包括外科手术、化学治疗和分子靶向治疗等。腹膜转移是胃癌常见的转移方式,临床多表现为恶性腹水、发热、恶液质等。虽然TNM 分期是胃癌患者生存强有力的预后指标,但是其他临床、病理指标仍可能会影响此类患者的预后情况[1]。因而创建个性化的预后评估工具有助于临床识别高危患者并可能会影响实际的治疗决策。既往文献报道斯罗恩-凯特林纪念癌症中心列线图有助于评估单独R0 切除的胃癌患者5年和9年的生存率[2],但是鉴于种族、人群、治疗手段的差异等,其用于评估老年胃癌伴腹膜转移患者的预后效能仍不明确。此外,HER2 基因突变亦被证实能够影响胃癌患者预后,但其检测较为繁琐,且不同观察者之间评估存在差异[3]。故而,本研究拟利用本中心数据探讨影响胃癌伴腹膜转移的老年患者预后的因素并构建风险模型。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月—2021年1月于南通市肿瘤医院就诊的123 例老年胃癌伴腹膜转移患者的临床和病理资料。纳入标准:(1)患者年龄≥60 岁;(2)患者胃癌经病理诊断明确;(3)就诊时存在腹膜转移,符合《胃癌腹膜转移防治中国专家共识》[4]中有关定义,即腹水脱落细胞学查见癌细胞。符合以上全部标准的病例纳入本研究。排除标准:(1)合并严重的肝肾功能不全;(2)合并其他恶性肿瘤;(3)非首次诊断为胃癌;(4)患者临床或检查资料不全,无法分析。具备以上任意1 项标准的病例不纳入本研究。
1.2 研究方法
通过电子病历系统收集患者的临床、病理和实验室检查资料,包括患者年龄、性别、体力状态评分(东部肿瘤协作组ECOG 评分)、胃癌部位(贲门胃底部、胃体部、胃窦部)、肿瘤直径、是否为印戒细胞癌、是否合并腹膜外转移、腹膜种植分期、腹水等级以及血清癌胚抗原(CEA)浓度。根据12 版日本胃癌分期有关标准[5],依手术所见或影像学结果将腹膜种植分期为:P0,无腹膜种植;P1:胃癌相邻部位网膜(即横结肠以上网膜)种植;P2:远处网膜数个(≤3 个)转移灶或仅种植至卵巢(即Krukenberg 瘤);P3:远传网膜或卵巢多个(3 个以上)转移灶。腹水等级标准如下:0级,无腹水;1 级,无明显症状和体征,仅CT 或B 超提示少量腹水;2 级,体征阳性,即移动性浊音阳性;3级,大量腹水,液波震颤阳性。
对所纳入患者进行随访,随访终点为全因死亡。当患者出现随访终点时即退出随访队列。若患者失访或至随访截止时间(2022年1月)时仍未出现终点事件,则记录末次随访状态。
1.3 统计学分析
使用SPSS 22.0 软件进行统计学分析。首先使用Shapiro-Wilk 检验对数据正态性进行检验,符合正态分布的连续变量以均数±标准差(±s)表示。分类资料以例数和百分率表示。通过单因素分析筛选潜在的预后变量,将单因素分析中P<0.1 的变量带入多因素Cox 比例风险回归模型中明确影响胃癌伴腹膜转移的老年患者预后不良的危险因素。使用Kaplan-Meir 生存曲线明确患者累计生存率随时间的变化情况。根据多因素分析中回归系数构建相应的风险模型,并使用时间依赖的受试者工作特征(receiveroperating characteristic,ROC)曲线明确所构建的风险模型鉴别患者52 周时是否达到随访终点的最佳截断值、曲线下面积(area under the curve,AUC)及敏感性和特异性。双侧检验,P<0.05 为差异有统计学意义。
2 结果
2.1 患者的一般特征
本研究纳入123 例患者,包括男性患者55 例(44.72%)和女性患者68 例(55.28%),年龄为60~83岁,平均年龄为(69.4 ±6.2)岁。所纳入患者中位随访时间为47 周[95%置信区间(CI):33~65 周],中位累积生存期为55 周。见图1。

图1 所纳入患者累计生存率随时间变化的Kaplan-Meier 曲线
2.2 影响胃癌伴腹膜转移的老年患者预后单因素分析
单因素分析结果表明,肿瘤直径>5 cm、CEA>5 μg/mL、印戒细胞癌、腹膜种植分期、腹水等级、腹膜外转移以及ECOG 评分过高是胃癌伴腹膜转移的老年患者预后不良的危险因素。见表1。
2.3 多因素分析
将表1中有统计学意义的变量带入多因素Cox回归中,结果提示肿瘤直径>5 cm (HR=1.46)、CEA水平>5 μg/mL (HR=1.50)、印戒细胞癌(HR=1.85)、腹膜种植分期高、腹水等级高以及腹膜外转移(HR=1.66)和ECOG 评分高是影响胃癌伴腹膜转移患者预后不良的独立危险因素。见表2。
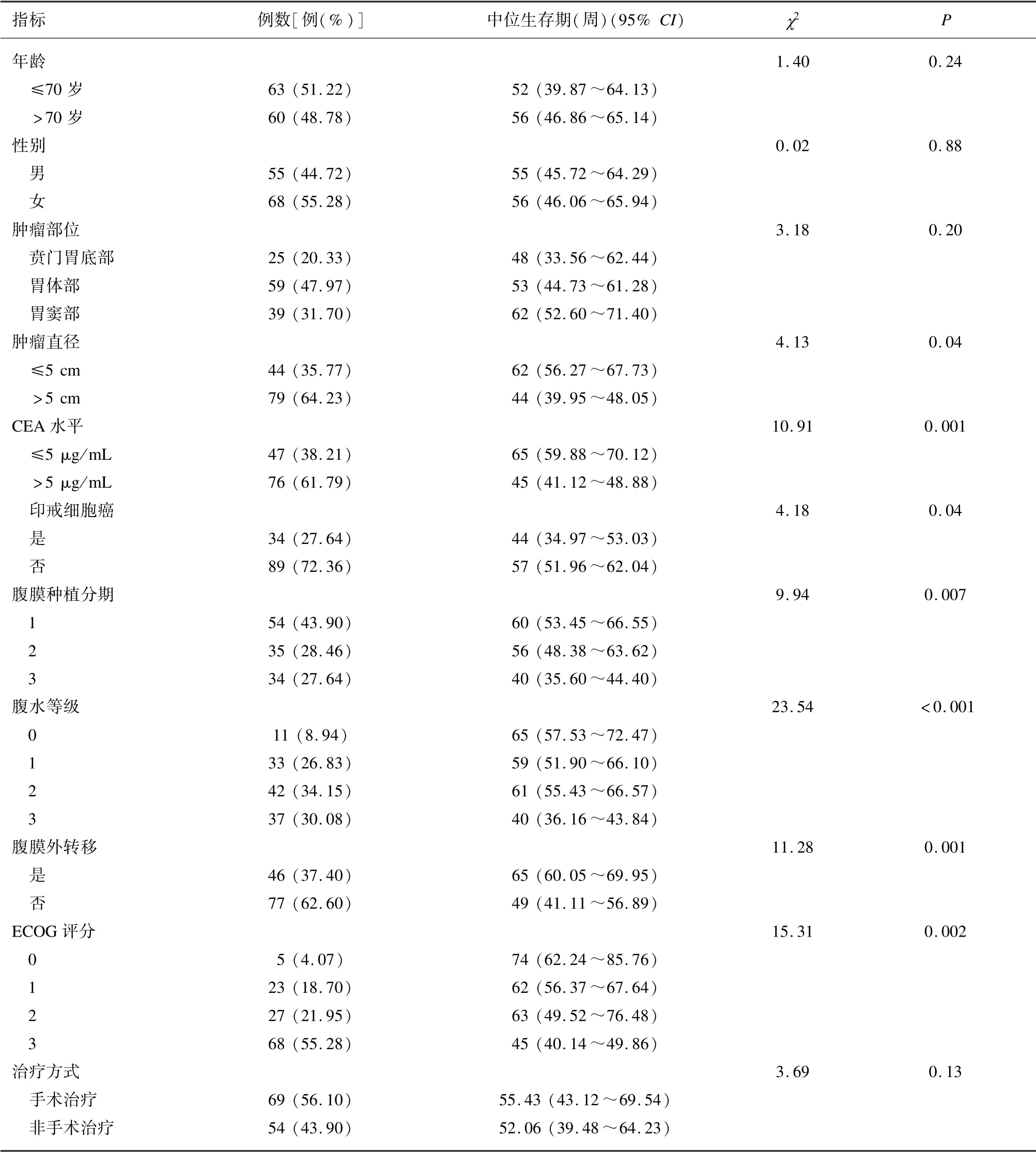
表1 影响胃癌伴腹膜转移的老年患者预后的单因素分析
2.4 风险模型构建和效能评估
根据表2中的结果,构建的风险模型如表3所示。按照表3对每位患者进行评分,所得即为复合总分。时间依赖的ROC 曲线(图2)结果表明,当最佳截断值取3.02 时,该复合总分评估52 周(即1年)时是否达随访终点的AUC 为0.80 (95%CI:0.72~0.87),敏感性和特异性分别为66.3% (95%CI:56.1%~75.6%)和84.0% (95%CI:63.9%~95.5%)。
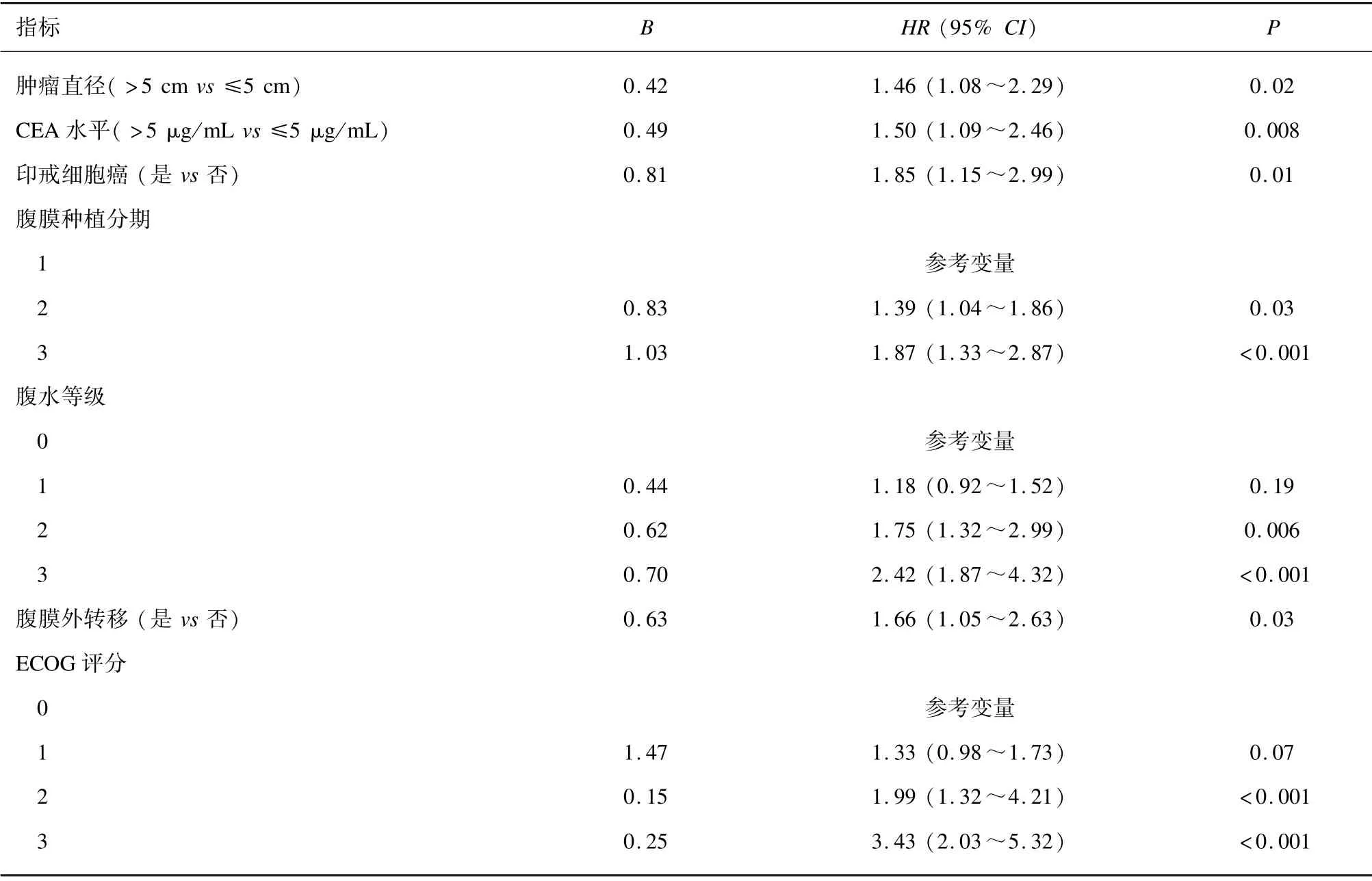
表2 影响胃癌伴腹膜转移患者预后的多因素Cox 回归分析结果
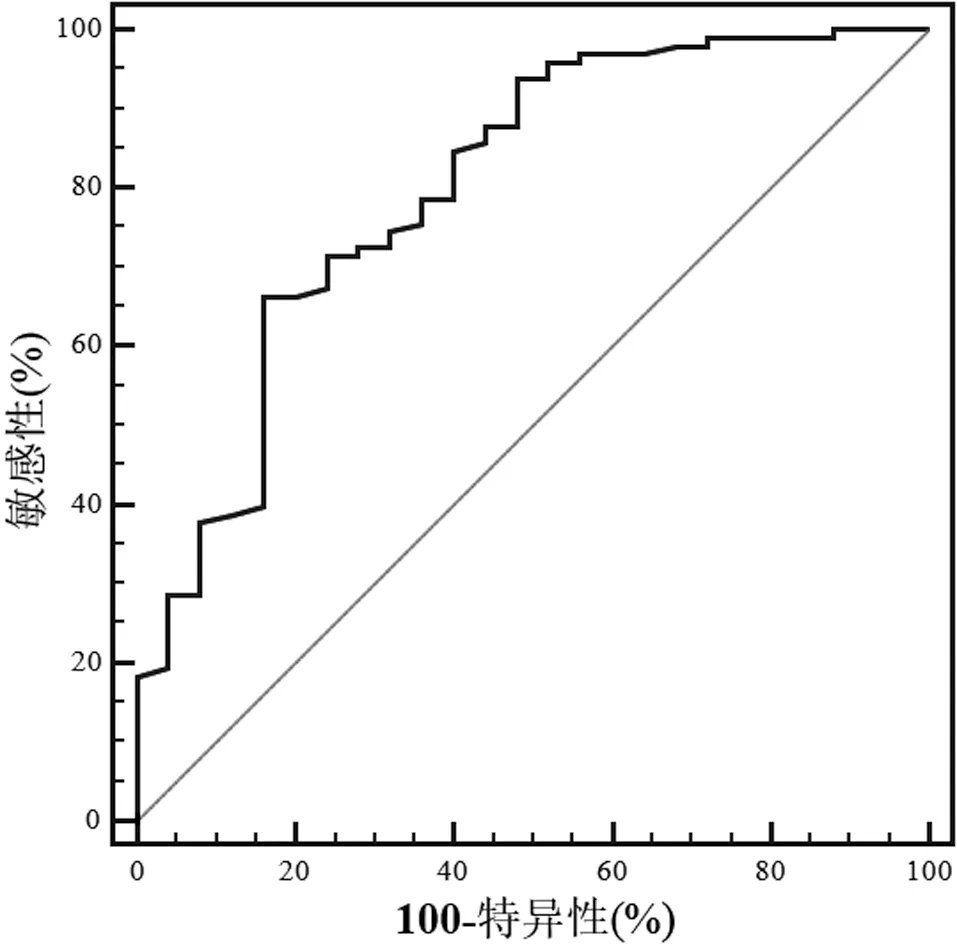
图2 复合总分鉴别胃癌伴腹膜转移的老年患者1年时是否达终点的时间依赖ROC 曲线

表3 复合总分得要素及其对应得分值
3 讨论
腹膜种植是晚期胃癌常见的转移方式,常表现为腹水、发热和恶液质等。化学治疗联合腹腔灌注目前是伴腹膜种植的胃癌患者主要治疗手段。既往文献[6]报道,50%伴腹膜转移的胃癌接受联合治疗后病情稳定。故而,明确此类患者的预后影响因素有助于临床治疗决策和预后评估。
传统上,TNM 分期是胃癌患者最重要的预后指标。伴腹膜转移的胃癌患者TNM 分期则均为Ⅳ期,然而此类患者的预后情况也存在显著差异,因而需要对TNM Ⅳ期的患者再进行分类。本研究发现,肿瘤直径>5 cm、CEA 水平>5 μg/mL、印戒细胞癌、腹膜种植分期高、腹水等级高以及腹膜外转移和体力状态评分高是影响胃癌伴腹膜转移患者预后不良的独立危险因素。Chen 等[7]利用肿瘤大小等指标构建了评估了胃癌伴腹膜转移患者预后评估的列线图,这与本研究结果一致。Guo 等[8]在2 379 例国内胃癌患者数据分析表明,直径<4 cm 的胃癌患者5年生存率为68.7%,而直径>4 cm 的患者5年生存率仅为40.2%。国外人群的研究[9]也表明,直径>6 cm的胃癌患者5年生存率较直径<6 cm 胃癌患者降低37.2%。
CEA 是消化道肿瘤常用的生物标志物,常与胃癌浸润深度、TNM 分期以及淋巴结转移等因素有关[10]。已有大量研究[11-12]表明,术前CEA 水平或CEA 术后的动态变化有助于检测胃癌术后肿瘤复发和评估远期预后情况。印戒细胞癌是胃腺癌中恶性程度较高的一种病理类型。有研究发现,印戒细胞癌患者淋巴结转移早,容易早期复发并昭示预后不良[13]。
腹膜种植分期是日本及我国常用的胃癌腹膜播散评估的工具。Fujimoto 等[14]证实,腹膜种植分期为3 期的胃癌患者预后明显差于1 期和2 期患者。Fang等[15]研究发现,伴有恶性腹水的胃癌患者生存期较短,且ECOG 评分在此类患者中具有较强的预后评估意义。
基于多因素分析结果,构建胃癌伴腹膜转移的老年患者预后的模型。ROC 曲线结果表明,该模型评估患者确诊1年时是否存活的AUC 为0.80,表明该模型的预判功能较好,具有一定的临床应用价值,但仍有优化空间。推测以下因素可能限制了该模型的预后评估效能:首先,因本队列患者治疗模式和手段差异性较大,仅根据是否手术分为手术治疗组和非手术治疗组,这可能最终影响患者的预后;其次,本研究为单中心、回顾性分析,可能存在偏倚,且模型缺少外部验证;最后,既往研究[16-17]发现,Borrmann 分型、分子靶向治疗等参数和治疗可能也对患者的预后有一定的影响,本研究尚未对这些因素加以分析。
综上所述,本研究发现肿瘤直径>5 cm、CEA 水平>5 μg/mL、印戒细胞癌、腹膜种植分期高、腹水等级高以及腹膜外转移和体力状态评分高是影响胃癌伴腹膜转移患者预后不良的独立危险因素。构建的风险模型具有较好地预后评估效能。鉴于本研究为单中心回顾性分析,所得到的结论尚需前瞻性、多中心研究加以验证。

