胰激肽原酶联合利拉鲁肽治疗老年糖尿病肾病的临床疗效研究
洪娟,苏钢,詹桂桂
芜湖市第一人民医院全科医学科,安徽芜湖 241060
糖尿病肾病属于较为常见的糖尿病并发症之一,若不能及时有效的采取措施控制肾损伤,患者肾损伤会快速进展,严重者可导致患者肾功能衰竭,研究指出,此病的发生与年龄高度相关,老年人群罹患糖尿病肾病几率较高,且老年患者身体各机能衰退,随着病程的延长会加重目标器官的损害,因此早期治疗对修复肾损伤尤为重要[1-2]。利拉鲁肽属胰高糖素样肽-1 (glucagon-like peptide-1,GLP-1)受体激动剂,有别于传统降糖药,其可根据体内血糖水平“按需”调节胰岛素分泌,目前多用于糖尿病及糖尿病并发症的治疗中,且已有报道称[3],此药可用于老年糖尿病肾病患者的治疗。但随着临床上对老年糖尿病肾病的逐渐深入研究发现,单药治疗周期较长,且极易产生耐药,效果并不明显,因此临床普遍使用多药联合方案治疗,在最大程度上提高治疗效果。胰激肽原酶药物具有改善患者肾脏血流动力学的作用,有报道称[4],其可用于糖尿病肾病的辅助治疗中。基于此背景,本文将利拉鲁肽、胰激肽原酶药物联合用于老年糖尿病肾病的治疗中,分析其应用疗效,以减轻患者肾损害,修复肾损伤,为临床上老年糖尿病肾病治疗方案的选择提供参考。
1 资料与方法
1.1 一般资料
选择2016年1月—2020年10月芜湖市第一人民医院就诊的老年糖尿病肾病患者70 例,采用数字表法随机分为观察组和对照组,每组35 例。观察组男性17 例,女性18 例;年龄63~79 岁,平均年龄(72.1 ±4.4)岁;糖尿病病程(13.78 ±2.23)年;糖尿病肾病病程(6.33 ±1.45)年;疾病分期:1 期8 例,2 期7 例,3a 期6 例,3b 期6 例,4 期8 例。对照组男性19 例,女性16 例;年龄62~79 岁,平均年龄(71.6 ±4.2)岁;糖尿病病程(13.65 ±2.09)年;糖尿病肾病病程(6.19 ±1.24)年;疾病分期:1 期9 例,2 期8 例,3a期8 例,3b 期5 例,4 期5 例。2 组基线资料比较差异无统计学意义,均衡可比(P>0.05)。本研究已获得本院伦理委员批准(QBH2015120902)。
1.2 纳入和排除标准
纳入标准:(1)患者疾病诊断满足相关标准诊断[5],糖尿病病程超过5年,持续白蛋白尿,尿白蛋白/肌酐>300 μg/mg 或尿白蛋白排泄率>200 μg/min或尿白蛋白定量>300 mg/d 或尿蛋白定量>0.5 g/d;糖尿病视网膜病变伴任何1 期慢性肾脏病;(2)行肾穿刺活检术进行经皮肾穿刺活体组织病理检查,包括免疫荧光或免疫组化法、光镜和电镜检查,进一步诊断为糖尿病肾病;(3)年龄≥60 岁;(4)患者对本研究的内容知情,签署知情同意书。符合以上全部标准的病例纳入本研究。排除标准:(1)患有恶性肿瘤者;(2)药物过敏者;(3)合并糖尿病足者;(4)合并肾动脉狭窄、急慢性肾小球肾炎、IgA 肾病或膜性肾病者;(5)合并肺、心功能异常者;(6)存在意识功能障碍或精神疾病;(7)原发性肾病感染、原发性高血压导致的蛋白尿。具备以上任意1 项标准的病例不纳入本研究。
1.3 治疗方法
对2 组患者均行临床常规治疗,包括降糖、控制饮食等,对照组采用利拉鲁肽[诺和诺德(中国)制药有限公司,国药准字J20110026,规格3 mL:18 mg/支]治疗,起始剂量0.6 mg/d,7 d 后每日增加至1.2 mg,1 次/d,皮下注射。观察组使用胰激肽原酶联合利拉鲁肽治疗,利拉鲁肽用法用量与对照组相同,胰激肽原酶[卫材(辽宁)制药有限公司,国药准字H20044399,规格120U],用法用量:120 IU/次,3 次/d,口服。2 组患者均治疗4 个月。
1.4 观察指标与方法
(1)血糖测定:取2 组患者治疗前、治疗疗程结束后次日(治疗后)抽取清晨空腹静脉血3 mL,离心10 min(3 000 r/min,离心半径5 cm),制备血清,-80 ℃保存待用。使用全自动生化分析仪测定血糖指标。(2)肾功能指标、血尿酸、尿微量蛋白指标水平测定:使用全自动生化分析仪(Olympus AU2700 型)测定血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,SCr)水平,计算肾小球滤过率(glomerular filtration rate,GFR),GFR=186×SCr-1.154 ×(年龄-0.203) ×(0.742/女性)。用尿酸酶-钯纳米粒子(uricase palladium nanoparticles,MCA-Pd NPs)的比色法[6]测定血尿酸(serum uric acid,SUA),以2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid,ABTS)2-为显色底物,取10 μL 血清样本,加50 μL 尿酸酶+100 μL MCA -Pd NPs +50 μL ABTS2-,37 ℃下反应20 min。使用紫外-可见分光光度计(日本岛津公司,UV2550 型)在420 nm 处测定吸光度值。使用特种蛋白分析仪(美国Beckman 公司,Coulter 800型)分析尿微量蛋白指标水平,包括尿β2-微球蛋白(β2-microglobulin,β2-MG)、尿α1-微球蛋白(α1-microglobulin,α1-MG)、24 h 尿微量白蛋白定量(24 h urine microalbumin quantification,24 h-UmAlb)。(3)肾功能损害恢复情况评价:依据既往研究[7-8],本研究应用肾皮质对比增强超声(contrast-enhanced ultrasound,CEUS)对糖尿病肾病患者肾功能损害恢复情况进行评价,在患者治疗后使用彩色多普勒超声诊断仪(荷兰Philips公司,Philips iU22 型)对肾功能损害恢复情况进行评价,根据CEUS 强度变化情况生成曲线,获得曲线下面积(area under curve,AUC)、达峰时间(time to peak,TTP)、曲线达峰绝对值(derived peak intensity,DPI),根据值高低评价肾功能损害恢复情况。(4)胱抑素C(cystatin C,Cys-C)和视黄醇结合蛋白(retinol binding protein,RBP)检测:使用自动生化分析仪(山东博科生物产业有限公司,博科BK-400 型)测定血清Cys-C水平,采用胶乳增强免疫比浊法[9]测定尿RBP 水平,取3 个试管,分为空白管、标准管和测定管,均加350 μL Tris 缓冲液,之后分别加15 μL 生理盐水、15 μL RBP 定标液、15 μL 待测标本,混匀,37 ℃反应5 min,在波长340~700 nm 处读吸光度,测定RBP 水平。(5)临床疗效评价:患者疗程结束后次日依据症状消失情况和肾功能指标BUN、SCr 水平评估效果,显效:患者临床症状均消失,BUN、SCr 中任意一项与治疗前相比降低程度>30%;有效:患者临床症状得到显著改善,BUN、SCr 与治疗前相比降低程度<30%;无效:临床症状无改善,且有加重的趋势。治疗总有效率=(显效例数+有效例数)/总例数×100%。(6)不良反应统计:统计患者在研究期间所出现的不良反应,并对2 组患者对比。
1.5 统计学分析
使用SPSS 22.0 软件做数据分析。计量资料符合正态分布则以均数±标准差(±s)表示,组间使用独立样本t检验,组内使用配对样本t检验;偏态分布的资料采取秩和检验。以例数和百分率表示计数资料,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 2 组患者治疗前后血糖比较
2 组患者治疗前血糖对比差异无统计学意义(P>0.05);治疗后,2 组患者的血糖水平均降低(P<0.05),且观察组的血糖水平低于对照组(P<0.05)。见表1。

表1 2 组患者治疗前后血糖比较
2.2 2 组患者治疗前后肾功能、血尿酸和尿微量蛋白比较
2 组患者治疗前肾功能、血尿酸、尿微量蛋白指标对比差异无统计学意义(P>0.05);治疗后,2 组患者的BUN、SCr、SUA、24 h-UmAlb、α1-MG 和β2-MG 水平降低,GFR 水平升高(P<0.05),且观察组的BUN、SCr、SUA、24 h-UmAlb、α1-MG 和β2-MG 水平低于对照组,GFR 水平高于对照组(P<0.05)。见表2。
表2-1 2 组患者治疗前后肾功能、血尿酸和尿微量蛋白指标水平比较(±s)
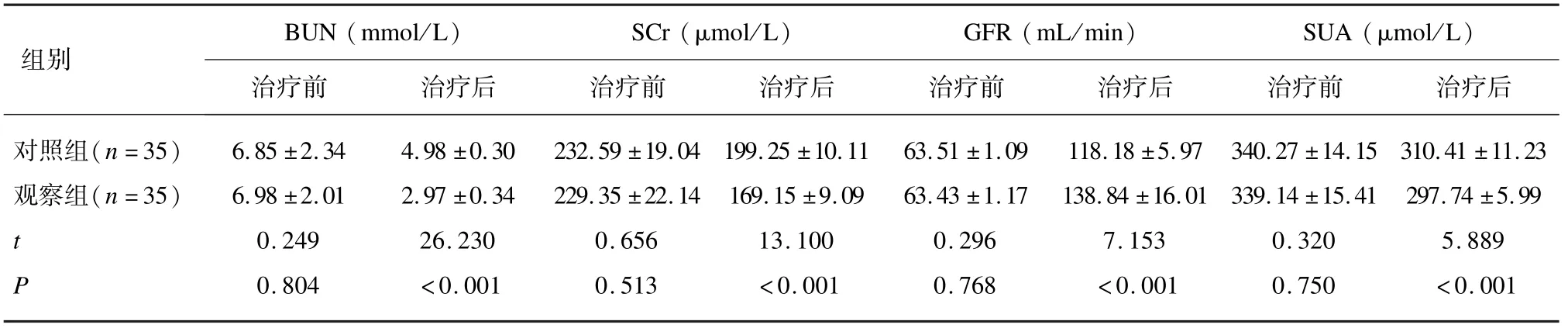
表2-1 2 组患者治疗前后肾功能、血尿酸和尿微量蛋白指标水平比较(±s)
?
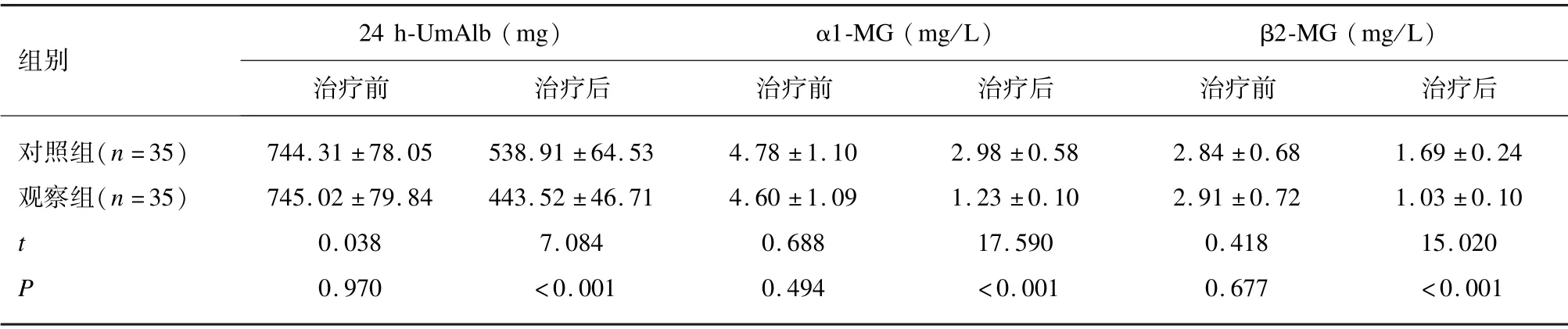
表2-2
2.3 2 组患者治疗后肾功能损害恢复情况比较
治疗后观察组的TTP 和AUC 值低于对照组,DPI 值高于对照组(P<0.05)。见表3。
表3 2 组患者治疗后肾功能损害恢复情况比较(±s)

表3 2 组患者治疗后肾功能损害恢复情况比较(±s)
TTP (s) DPI (dB) AUC (dB/s)组别左肾 右肾 左肾 右肾 左肾 右肾对照组(n=35) 26.87 ±3.14 26.68 ±4.31 12.97 ±1.54 13.91 ±1.66 1 301.24 ±152.62 1 566.49 ±244.55观察组(n=35) 22.09 ±1.58 22.34 ±1.24 17.42 ±2.61 16.04 ±2.61 1 110.24 ±67.45 1 160.12 ±121.42 t 8.045 5.725 8.687 4.074 6.772 8.805 P<0.001<0.001<0.001<0.001<0.001<0.001
2.4 2 组患者治疗前后Cys-C 和RBP 水平比较
2 组患者治疗前Cys-C 和RBP 水平对比差异无统计学意义(P>0.05);治疗后,2 组患者的Cys-C 和RBP 水平降低(P<0.05),且观察组Cys-C 和RBP 水平低于对照组(P<0.05)。见表4。

表4 2 组患者治疗前后Cys-C 和RBP 水平比较
2.5 2 组患者治疗效果比较
观察组的总有效率高于对照组(P<0.05)。见表5。

表5 2 组患者治疗效果比较[例(%)]
2.6 2 组患者不良反应比较
2 组患者不良反应差异无统计学意义(P>0.05)。见表6。

表6 2 组患者不良反应比较[例(%)]
3 讨论
报道称,糖尿病肾病是引发肾衰竭的重要原因,同时也是增加糖尿病患者死亡风险的独立危险因素[10]。目前临床上认为糖尿病肾病的应以控血糖、保护肾功能、修复肾功能损伤,延缓疾病进展为治疗原则,但目前仍缺乏有效治疗此病的方法。
既往研究表明GLP-1 可经改善管球反馈机制、神经激素-血管机制共同导致的高过滤性保护肾功能,利拉鲁肽属GLP-1 受体激动剂,其可改善糖尿病肾病患者蛋白尿症状,且在此过程中不依赖于血糖的肾脏保护作用[11-12]。肾小球血管内皮细胞中含有较多的GLP-1 受体,利拉鲁肽在使用后可与上述受体产生特异性结合作用,进而调控肾小球过滤功能,发挥治疗糖尿病肾病的作用[13]。随着目前临床上对老年糖尿病肾病治疗方法的不断深入研究,发现单药治疗效果并不理想,胰激肽原酶为蛋白水解酶类,由激肽、激肽原和激肽酶等构成,该药物可调节血压、血糖、炎症反应等,发挥作用的途径为扩张肾小球毛细血管、降低肾动脉阻力,发挥肾脏保护作用,最终抑制疾病进展[14]。既往报道指出[15],胰激肽原酶可有效降低糖尿病肾病患者炎症反应,促进肾功能恢复。糖尿病患者激肽释放酶明显减少,从而影响血管功能的调节,补充胰激肽原酶可有效提高患者肾组织中激肽,扩张毛细血管壁,改善微循环,同时能够抑制肾小球系膜细胞增生,预防微血栓形成[16]。而报道称[17],老年糖尿病肾病患者通常情况下病程较长,血糖长时间的处于紊乱状态,机体内激肽释放酶随着病程的延长逐渐减少,而应用激肽释放酶可快速补充机体内所需的激肽释放酶,进而缓解肾损伤。检索国内外相关文献,将利拉鲁肽、胰激肽原酶联合治疗老年糖尿病肾病还鲜有报道,本文首次研究在利拉鲁肽的基础上使用胰激肽原酶辅助治疗老年糖尿病肾病的疗效,结果显示,与单纯使用利拉鲁肽治疗的患者相比,联合应用利拉鲁肽、胰激肽原酶的患者尿微量蛋白明显被纠正,且在治疗后评价患者肾功能损害的修复情况发现,联合使用利拉鲁肽、胰激肽原酶治疗的患者肾损伤明显得到修复,提示两药联合相比单药治疗效果更为理想,此结果与黄欢等[15]研究结果中认为在羟苯磺酸钙的基础上联合使用胰激肽原酶最大程度上修复糖尿病肾病患者肾功能的结果相似。
24 h-UmAlb、α1-MG 和β2-MG 均属尿微量蛋白指标,研究显示[18-20],上述指标水平高低均为影响糖尿病肾病患者疾病进展的独立因素,正常情况,24 h-UmAlb、α1-MG 和β2-MG 合成和释放速度相对恒定,经肾小球滤过的24 h-UmAlb、α1-MG 和β2-MG 在近曲小管被吸收,并被分解破坏呈氨基酸,24 h-UmAlb、α1-MG和β2-MG 异常升高反映了肾小球滤过功能和肾小管损伤。本文结果显示,联合用药的患者24 h-UmAlb、α1-MG和β2-MG 水平显著降低,此结果提示着联合用药疗效更为显著,表现为24 h-UmAlb、α1-MG 和β2-MG水平降低。目前关于老年糖尿病肾病的具体发生机制尚不完全明确,但部分研究显示[21-23],Cys-C 是公认的诊断肾小管损伤的敏感指标,其属于有核细胞所分泌的小分子蛋白,可在人体肾小管分解和重吸收,在机体处于正常状态下时无表达或者低表达,但当肾脏损伤后,其分泌增加,在外周血中含量增加。RBP水平与肾脏损伤正相关,其主要由肝脏合成,主要运载维生素A,在正常状态下时不会经肾小球滤过,但当肾脏损伤时,重吸收紊乱,RBP 水平升高,高表达于患者尿液中[24-25]。本文对Cys-C 和RBP 水平进行检测发现,治疗后均明显降低,但观察组降低更为显著,此结果提示胰激肽原酶、利拉鲁肽联合应用可在最大程度上修复肾脏损伤,表现为Cys-C 和RBP 水平降低,此结果与安洁等[26]研究认为Cys-C 和RBP 水平降低标志着糖尿病肾病患者肾损伤被修复的结果一致。
但本文仍存在一定的不足,本研究首次将胰激肽原酶、利拉鲁肽2 者联合应用于老年糖尿病肾病患者中,但并未对2 者共同发挥作用的机制进行更加深入的分析。并且本研究属单中心研究,所纳入的样本量较少,在数据统计时可能存在一定的偏倚,因此还需后续经多中心和大样本进一步研究,以期望为临床上此病的治疗提供参考。
综上所述,本文研究发现胰激肽原酶联合利拉鲁肽治疗老年糖尿病肾病效果显著,可改善肾血流动力学,修复患者肾损伤,其机制可能与抑制Cys-C 和RBP表达有关。

