固体分散体技术在阿比特龙胶囊制备中的应用研究*
孙嘉慧,朱柏儒,杜 燕,唐 海,王利娜,杨美青
(1.内蒙古科技大学包头医学院药学院,内蒙古 包头 014040;2.江苏天士力帝益药业有限公司)
醋酸阿比特龙(Abiraterone Acetate),商品名为Zytaga®。2011年经美国食品和药品管理局(Food and Drug Administration,FDA)批准,其可用于治疗转移性去势抵抗前列腺癌[1],作为一种前药,主要通过酯酶催化水解转化为其活性代谢物阿比特龙(abiraterone,Ab)[2]。阿比特龙作为一种强效、不可逆和选择性的CYP 17酶抑制剂,可以减少睾丸、肾上腺和前列腺肿瘤组织的雄激素生成[3],减缓疾病进程。最新的临床研究显示,阿比特龙与泼尼松联合用药时,疾病控制率(86.21 %)较单一用药组(62.07 %)高(P<0.05),且能改善患者排尿功能,不良反应较少[4]。
目前该药物在延长前列腺癌患者寿命方面取得巨大成功[5]。但其属于生物制药分类系统(biopharmaceutics classification system,BCS)的Ⅳ类药物,具有极低的水溶性(<0.5 μg/mL),在体内的生物利用度<10 %[6],日剂量为1 000 mg[7]。因此应用合理的制剂技术,提高阿比特龙的溶出度进而提高其生物利用度具有重要意义。
1 材料与方法
1.1仪器与试药 ThermoFisher Pharma11 双螺杆热熔挤出机(赛默飞世尔科技有限公司);Agilent 708DS智能溶出仪(安捷伦科技有限公司);Sotax AT 7X溶出仪(瑞士Sotax);Agilent 1260高效液相色谱仪(安捷伦科技有限公司);METTLER DSC3 + 差示扫描量热分析仪(梅特勒-托利多仪器有限公司);METTLER TGA/DSC3 + 热重分析仪(梅特勒-托利多仪器有限公司);OlympusBX51偏振光显微镜(日本Olympus公司);ThermoFisher IS10傅里叶变换红外光谱仪(赛默飞世尔科技有限公司);艾卡MF10研磨机(德国IKA公司);METTLER WRR型熔点仪(梅特勒-托利多仪器有限公司);METTLER S210-K Sev-enCompact pH 计(梅特勒-托利多仪器有限公司);METTLER XS205 十万分之一天平(梅特勒-托利多仪器有限公司);METTLER AB204N 万分之一天平(梅特勒-托利多仪器有限公司);Mill-Q II 超纯水器(日本Millipore公司)。
阿比特龙原料药(Ab,湖北猫尔沃生物医药有限公司),聚乙烯己内酰胺-聚醋酸乙烯酯-聚乙二醇接枝共聚物[Soluplus®,巴斯夫(中国)有限公司];乙烯吡咯烷酮-醋酸乙烯酯共聚物[Kollidon®PVP VA64,巴斯夫(中国)有限公司];泊洛沙姆188[Kolliphor®P188,巴斯夫(中国)有限公司];聚氧乙烯40氢化蓖麻油[Kolliphor®RH40,巴斯夫(中国)有限公司];共聚维酮[Plasdone S-630、Plasdone S-630 ULTRA,亚什兰(中国)投资有限公司];羧甲基淀粉钠(江苏奥福生物科技有限公司);交联聚维酮(德国JRS集团);乳糖FlowLac100(德国美剂乐集团);微晶纤维素PH102[巴斯夫(中国)有限公司];微粉硅胶(日本富士硅);硬脂酸镁(浙江中维药业股份有限公司);FaSSIF/FeSSIF/FaSSGF口服药物肠溶液(Biorelevant,UK);磷酸二氢钠(分析纯,天津市致远化学试剂有限公司);磷酸氢二钠(分析纯,天津市致远化学试剂有限公司);十二烷基硫酸钠[SDS,西格玛奥德里奇(上海)贸易有限公司];乙腈(色谱纯,默克公司);水为超纯水。
1.2方法
1.2.1含量测定方法及方法学验证 含量测定:利用高效液相色谱法测定阿比特龙胶囊含量。采用ZORBAX C18 extend(250 mm×4.6 mm,5 μm)色谱柱,以0.1 %甲酸水:乙腈=(3∶7)为流动相,流速为1.0 mL/min,设置柱温25 ℃,检测波长为254 nm,进样量为10 μL。
建立标准曲线:称取阿比特龙约25 mg,精密称定,置250 mL量瓶中,以乙腈溶解并定容,作为贮备液。精密量取贮备液适量,以乙腈稀释成3、5、8、10、12、15、20、30 μg/mL的系列浓度溶液,注入高效液相色谱仪,记录峰面积。
加样回收率:称取阿比特龙约20、25、30 mg,精密称定,按阿比特龙与载体质量比为1∶8加入空白辅料,以乙腈为溶剂溶解稀释制备成低、中、高三个浓度的溶液(8、10、12 μg/mL),注入高效液相色谱仪记录峰面积,计算加样回收率。
精密度:精密称定Ab-Soluplus(约相当于阿比特龙 25 mg)置250 mL容量瓶中,以乙腈溶解并定容。于一日内连续测定6次,记录峰面积,计算精密度。
耐用性:调整色谱方法流速为(1.0±0.1)mL/min,柱温为(25±1) ℃,流动相B比例为(70±5) %;检测波长为(254±1) nm,各条件下进行样品的含量测定。
1.2.2阿比特龙的熔点与稳定性 药物的熔点和稳定性对于热熔挤出温度的确定和载体的选择具有重要意义。通过熔点仪测得阿比特龙的熔程为203~211 ℃,利用热重分析(thermogravimetric analysis,TGA)及差式扫描量热分析(DSC)测定阿比特龙的热稳定性,实验参数为:以空气为参比,置氮气流中,温度为30~250 ℃,以10 ℃/min的速率升温扫描。
1.2.3固体分散体的制备、表征及溶解度研究 载体初步筛选:将阿比特龙与各载体分别过30目筛,按表1编号F1~F7对应的处方配比分别在聚乙烯袋中混合15 min,即得各物理混合物。设置同向双螺杆挤出机各区段至机头的温度依次为160 ℃、170 ℃、170 ℃、170 ℃、170 ℃、160 ℃,螺杆均采用输送单元,转速为50 r/min,将各物理混合物100 g置于加料斗中进行挤出,将挤出物接于铝盘中,室温冷却后用研磨机(0.5 mm滤网)粉碎,过60目筛,得到阿比特龙固体分散体F1~F7。采用差示扫描量热(DSC)分析仪进行测定。仪器参数设定同“1.2.2”。

表1 固体分散体处方
处方工艺优化:将阿比特龙与Soluplus分别过30目筛,按阿比特龙与Soluplus比例为1∶5、1∶8分别制备处方F8、F9,在聚乙烯袋中混合15 min,即得各物理混合物。设置同向双螺杆挤出机各区段至机头的温度依次为170 ℃,180 ℃、180 ℃、180 ℃、180 ℃、170 ℃,螺杆采用输送单元加剪切单元,其余操作条件同上,得到阿比特龙固体分散体F8 ~F9。采用差示扫描量热(DSC)分析仪进行扫描。
保持其他参数不变,提高挤出转速分别为80、100 r/min,制备的阿比特龙固体分散体利用DSC扫描。
偏振光显微镜(polarization microscope,PLM)分析:取Ab、Soluplus、Ab与Soluplus质量比为1∶5的物理混合物(PM)及其固体分散体(SD)样品粉末少量,分别在载玻片上分散均匀后,置偏振光显微镜下观察药物的结晶状态。
傅里叶变换红外光谱(fourier transform infrared spectrometer,FTIR)分析:Ab、Soluplus、Ab与Soluplus质量比为1∶5的物理混合物(PM)及其固体分散体(SD)样品粉末分别与溴化钾混合后压片,在400~4 000/cm范围内进行FTIR分析。
不同pH介质中溶解度曲线测定:取阿比特龙原料药及阿比特龙固体分散体(Ab-Soluplus质量比1∶8)适量,分别置于pH为1.6、5.0、6.5的FaSSIF/FeSSIF/FaSSGF介质的锥形瓶中,制备成饱和溶液,在温度为37 ℃,转速为100 r/min的恒温振荡器中振荡24 h,分别于0.5、1、2、4、6、8、10、12、18、24 h取样并滤过,注入高效液相色谱仪记录峰面积,计算饱和溶解度,并分别绘制溶解度曲线。
1.2.4阿比特龙胶囊的制备及质量研究 以25 mg药物规格为例采用单因素试验进行胶囊剂处方研究。
崩解剂筛选:按表2处方A、B、C、D、E分别将原辅料混合均匀后共同手工灌装至0# 明胶胶囊,得到相应编号胶囊。测定其在pH6.8磷酸盐缓冲液+0.3 % SDS介质中的溶出度,并绘制溶出曲线。
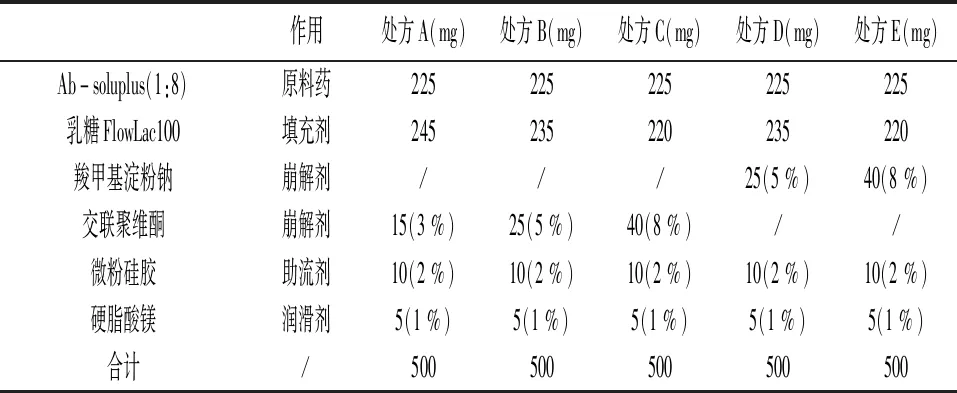
表2 胶囊处方-1
填充剂筛选:阿比特龙胶囊的处方设计基本思路为Ab-Soluplus(含API25 mg)作为主药、8 % CMS-Na作为崩解剂,2 % 微粉硅胶作为助流剂,1 % 硬脂酸镁作为润滑剂,其余均为填充剂。拟选用具有一定崩解作用的微晶纤维素PH102或直压乳糖FlowLac100作为填充剂,分别就两处方的粉体学性质进行评价,具体处方量见表3。

表3 胶囊处方-2
溶出曲线比较:按照表4的处方分别将原辅料混合均匀后共同手工灌装至0#明胶胶囊,得到相应编号胶囊。测定其在pH6.8磷酸盐缓冲液+0.3 %SDS介质中的溶出曲线。
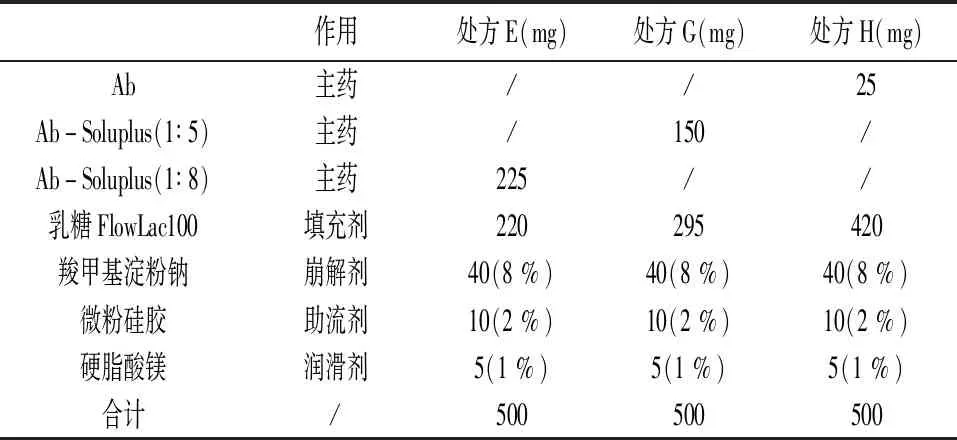
表4 胶囊处方-3
1.2.5溶出度方法及方法学验证 溶出度方法:采用《中国药典》2020版通则-0931第一法,以pH 6.8磷酸盐缓冲液+0.3 %SDS,900 mL为溶出介质,温度为(37±0.5)℃,转速为100 r/min,依法操作,分别在15、30、45、60 min时取续滤液1.5 mL,并及时补充同体积同温度的空白介质,注入高效液相色谱仪记录峰面积,计算溶出度并绘制溶出曲线。
线性:精密称定 Ab-Soluplus(相当于Ab 25 mg),溶解于250 mL溶出介质中,制备成浓度为0.1 mg/mL的贮备液。分别精密量取贮备液0.5、1.0、1.2、1.5、2.0、3.0 mL分别置10 mL容量瓶中,用溶出介质稀释至刻度,摇匀,得线性溶液1~6,过滤后进行HPLC分析。
批间均一性:同法制备三批Ab-Soluplus,并分别制备成阿比特龙胶囊,测定其溶出度。
耐用性:调整溶出介质体积为(900±10)mL,温度为(37±1)℃,pH为6.8±0.5,溶出转速为(100±5) r/min,在上述条件下分别测定阿比特龙胶囊溶出度。
2 结果
2.1含量测定方法学验证
2.1.1线性 以峰面积A对浓度C(μg/mL)进行线性回归得到标准曲线方程A=11.088C-4.388(r=0.9998),说明阿比特龙在3~30μg/mL范围内线性关系良好。
2.1.2回收率 测得平均回收率分别为100.83 %、101.28 %、101.44 %,RSD值分别为0.65 %、0.45 %、0.36 %。表明该方法准确度良好。
2.1.3精密度 经HPLC检测,得各Ab-Soluplus样品的平均含量为99.04 %,RSD值为0.49 %,精密度良好。
2.1.4耐用性 各条件下进行样品的含量测定,HPLC结果显示,当流速为0.9 mL/min及1.1 mL/min时,样品含量分别为98.77 %、99.01 %;当柱温设定为24 ℃及26 ℃时,样品含量分别为98.05 %、98.65 %;流动相B比例分别为65 %及75 %时,样品含量分别为98.04 %、100.32 %;检测波长分别设定为253 nm及255 nm时,样品含量分别为97.87 %、98.56 %,表明本方法耐用性良好。
2.2阿比特龙热稳定性结果 阿比特龙的热重分析(TGA)及差式扫描量热分析(DSC)测试结果见图1及图2曲线Ab。结果显示,原料药在210 ℃附近有一明显的吸热峰,即为阿比特龙的熔点;TGA图显示药物从约250 ℃开始失重,因此挤出工艺应在低于250 ℃下进行,拟通过挤出过程物理作用力和温度同时作用于药物和载体使其形成固体分散体,设定挤出温度为170 ~ 180 ℃。

图1 阿比特龙原料药的TGA曲线
2.3固体分散体的制备、表征及溶解度结果
2.3.1固体分散体载体选择 按表1制备处方F1~F7固体分散体,DSC结果如图2,制备的各固体分散体较阿比特龙熔点发生变化,可能是由于各辅料与阿比特龙存在分子间作用,例如氢键结合[8]。此外,相较于F1~F4,处方F5、F6、F7制得的固体分散体吸热峰较弱,表明在Soluplus载体中仅有少量阿比特龙以微晶态存在,故选用Soluplus为载体,拟通过优化工艺使阿比特龙完全转变为非晶态。
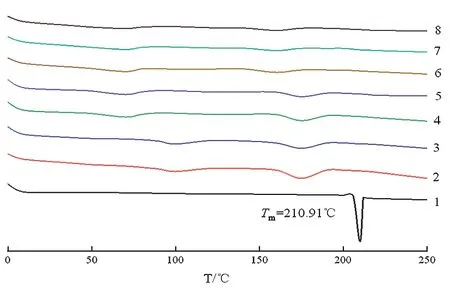
图2 处方F1~F7 DSC曲线1-Ab:;2-F1;3-F2;4-F3;5-F4;6-F5;7-F6;8-F7
2.3.2确定热熔挤出工艺 按阿比特龙与Soluplus比例为1∶5,1∶8分别制备处方F8、F9,并提高挤出温度,设置双螺杆剪切单元,制备的固体分散体经DSC检测结果如图3,阿比特龙的结晶峰消失;通过物理挤压和升温的双重作用,阿比特龙以非晶态分散于载体中。
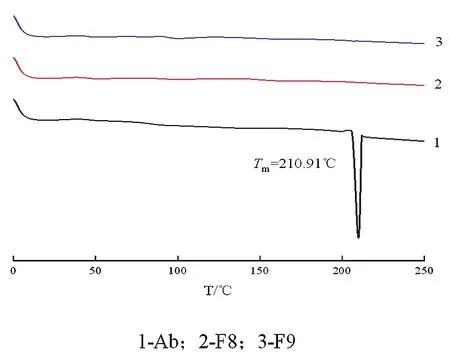
图3 处方F8~F9 DSC曲线1-Ab;2-F8;3-F9
将转速提高到80、100 r/min时,制备固体分散体,经DSC扫描发现,阿比特龙均能以非晶态分散于载体中,为提高挤出效率及降低阿比特龙晶型转化不完全的风险,将挤出转速调整为80 r/min。
因此,确定制备阿比特龙固体分散体处方工艺为:以Soluplus为载体,阿比特龙与Soluplus比例为1∶5,1∶8,设置同向双螺杆挤出机各区段至机头的温度依次为170 ℃、180 ℃、180 ℃、180 ℃、180 ℃、170 ℃,螺杆采用输送单元加剪切单元,挤出转速80 r/min。
2.3.3PLM结果 Ab、Soluplus、Ab与Soluplus质量比为1∶5的物理混合物(PM)及其固体分散体(SD)样品的偏振光显微镜结果如图4所示,结果表明,载体Soluplus镜下未见光斑,阿比特龙和其物理混合物均显示双折射现象,说明此时药物均以晶体的形式存在,而固体分散体镜下未见光斑,结合DSC的结果,判断阿比特龙以非晶态存在于载体Soluplus中。辅料比例增大有利于原料药分散及晶型转变,故不再对阿比特龙与Soluplus质量比为1∶8的固体分散体进行观察。
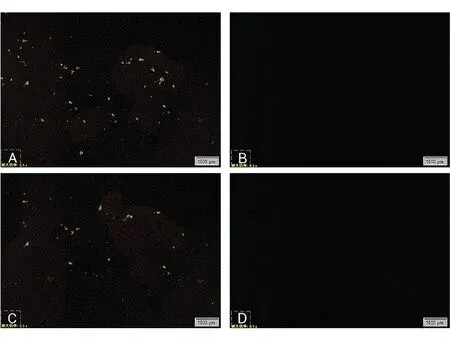
图4 Ab,Soluplus,物理混合物及固体分散体的偏振光图注:图A~D依次为Ab、Soluplus、PM、SD
2.3.4FTIR结果 Ab、Soluplus、Ab与Soluplus质量比为1∶5的物理混合物(PM)及其固体分散体(SD)样品的傅里叶变换红外光谱显示如图5所示,阿比特龙的红外光谱显示出清晰、明确的特征红外吸收带,在3 235.22/cm处存在-OH的特征吸收峰,Soluplus分别在1 635.82/cm和1 739.96/cm处存在内酰胺羰基及酯羰基的伸缩振动峰,物理混合物中保留了原料药及辅料的特征吸收峰,在固体分散体中,阿比特龙的-OH吸收峰钝化消失,提示药物与载体之间存在着分子作用力。
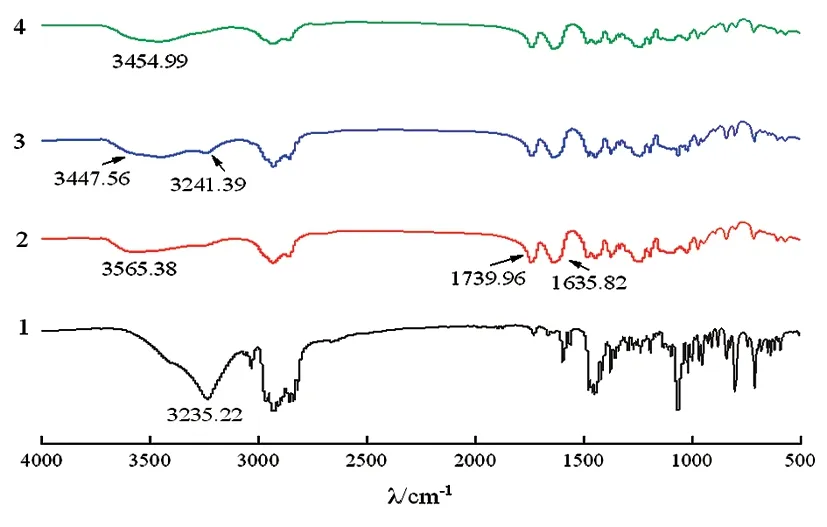
图5 Ab,Soluplus,物理混合物及固体分散体的红外光谱图1-Ab;2-Soluplus;3-物理混合物;4-固体分散体
2.3.5不同pH介质中溶解度曲线 如图6所示,在pH1.6、pH 5.0、pH 6.5的FaSSIF/FeSSIF/FaSSGF介质中,阿比特龙(n=6)的24 h饱和溶解度分别为103.01、16.55、1.41 μg/mL;Ab-Soluplus的24 h饱和溶解度分别为489.5、63.4、57.14 μg/mL,相较于阿比特龙分别提高了375.25 %、283.44 %、3 952.48 %,可见,Ab-Soluplus较阿比特龙在不同pH中溶解度均有很大提升。
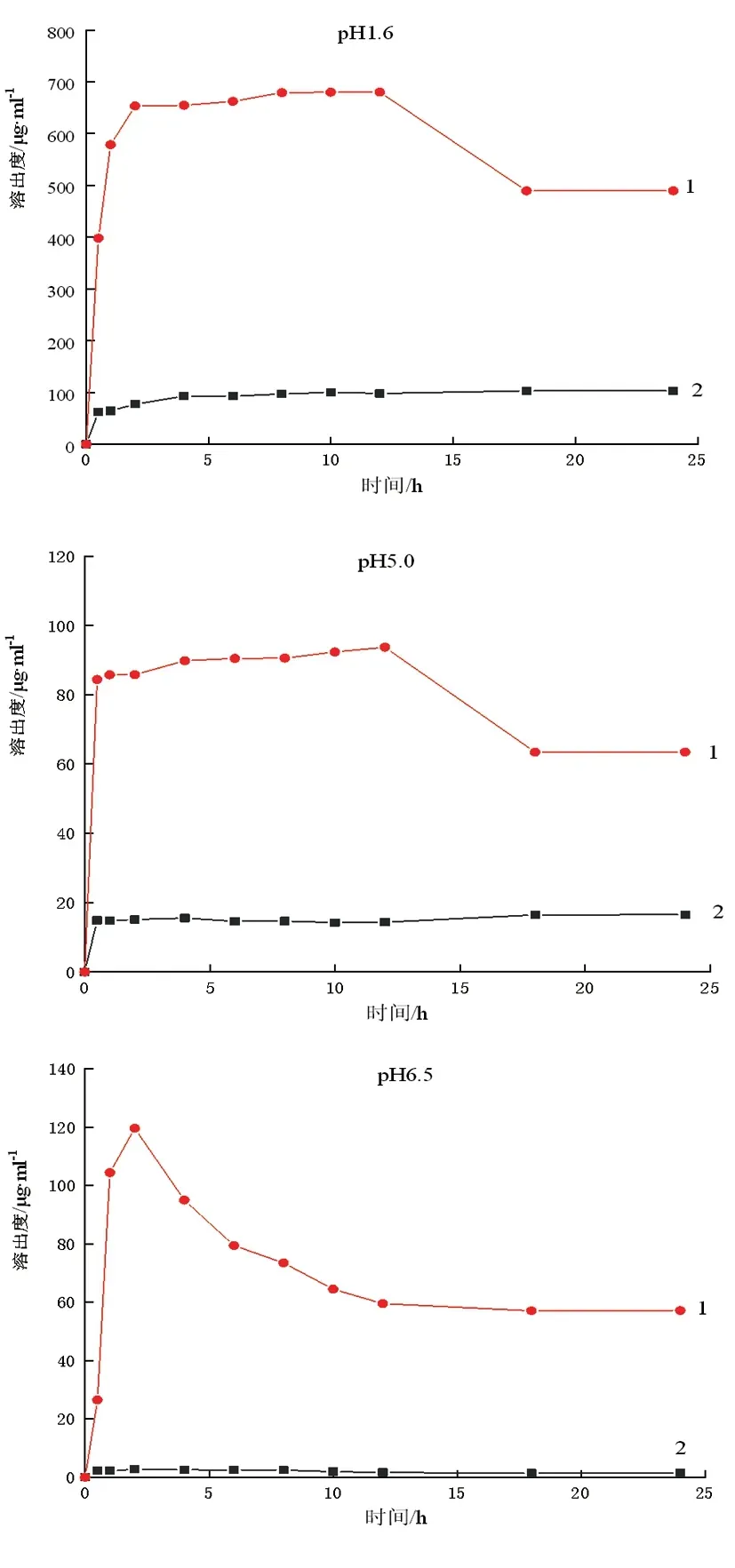
图6 Ab及Ab-Soluplus在不同pH介质的溶解度曲线1-(Ab-Soluplus);2-Ab
2.4阿比特龙胶囊研究结果
2.4.1确定崩解剂 按表2制备的处方A、B、C、D、E的胶囊在pH 6.8磷酸盐缓冲液+0.3 %SDS介质中的溶出曲线(n=6)如图7显示,胶囊A、B在介质中不崩解,胶囊C崩解现象不明显,三者释放药物均缓慢,由于soluplus在介质中迅速水凝胶化,形成凝胶层,交联聚维酮(PVPP)的崩解力难以突破凝胶层,药物释放依赖soluplus水凝胶层的溶蚀速度。胶囊D、E采用超级崩解剂羧甲基淀粉钠(CMS-Na),均能实现快速崩解,胶囊E释放药物的速度相对更快,但是对于CMS-Na而言,大量使用其自身会产生凝胶层,因此选择8 % CMS-Na作为崩解剂。

图7 处方A~E溶出曲线1-处方E;2-处方D;3-处方C;4-处方B;5-处方A
2.4.2确定填充剂 按表3制备处方E,F的粉体学性质结果显示,处方F的总量低于处方E是由于微晶纤维素本身密度较小,填充时使用量有限,从粉体学上看,处方F的Hausner比值为1.37,在1.35~1.45范围内;Carr’s指数为28.31 %,在23 %~35 %范围内,流动性较差,不利于胶囊的填充,有成品含量均匀度不合格的风险。处方E的Hausner比值为1.21,在1.19~1.25范围内;Carr’s指数为17.25 %,在16 %~20 %范围内,流动性较好。由于乳糖的密度大,填充用量较大,整体粉体性质得益于乳糖良好的流动性,因此选用乳糖作为填充剂。
2.4.3溶出曲线 按照表4的处方制备各处方胶囊,测定溶出曲线,结果如图8显示,经热熔挤出制备的阿比特龙胶囊G在60 min时溶出度仅为62 %(n=12),释放较慢,可能是因为Soluplus用量减少,减弱了增溶效果,又由于其中Soluplus的凝胶化导致药物释放缓慢。经热熔挤出制备的阿比特龙胶囊E在60 min时溶出度达96.2 %(n=12),基本达到完全释放,较原料药制备的阿比特龙胶囊H(60 min溶出度为71.0 %)溶出度提高了35.5 %。
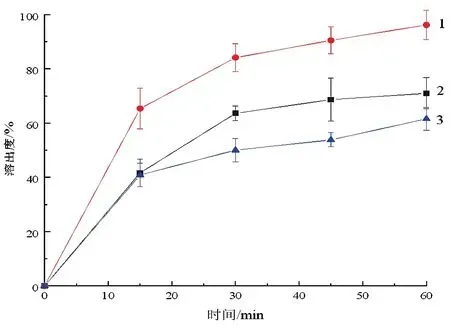
图8 处方E,G,H的溶出度曲线1-处方E;2-处方H;3-处方G
2.5溶出方法学验证
2.5.1线性 以峰面积A对浓度C(μg/mL)进行线性回归得到标准曲线方程A = 9.4367C+2.1511 (r=0.9998),说明阿比特龙在5~30 μg/mL范围内溶出度线性关系良好。
2.5.2批间均一性 同法制备三批阿比特龙胶囊,溶出度结果见表5,表明批间均一性良好。
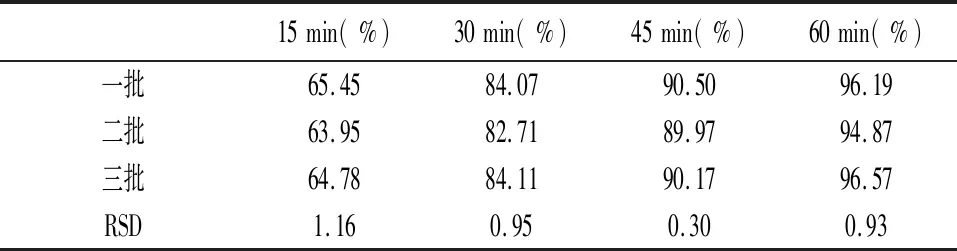
表5 批间均一性
2.5.3耐用性 在各条件下分别测定阿比特龙胶囊溶出度,各时间点溶出度结果见表6。不同实验条件下,制备的阿比特龙胶囊在60 min时的溶出度均能达到90 %以上,符合药典要求,表明该溶出度测定方法耐用性良好。

表6 耐用性
3 讨论
Soluplus®(聚乙烯己内酰胺-聚醋酸乙烯酯-聚乙二醇接枝共聚物)的降解温度约240 ℃,玻璃化转变温度约70 ℃,安全性高,具有增溶、抑晶、空间稳定、助悬、热敏、成膜等作用[9]。有研究证明Soluplus®有利于提高难溶性药物溶解度[10],在提高药物体内生物利用度方面也得到证实[11]。本研究利用Soluplus®为载体制备阿比特龙固体分散体,提高了体外溶解度,验证其具备增溶效果,体内生物利用度有待进一步研究。
以FaSSIF/FeSSIF/FaSSGF配制的介质中,Ab-Soluplus的饱和溶解度较阿比特龙提高了4 ~ 40倍。制备成胶囊后,在pH 6.8磷酸盐缓冲液+0.3 %SDS介质中,其溶出度仅提高了1.4倍。提升幅度的差异性可能是由于介质差异,而FaSSIF/FeSSIF/FaSSGF介质更能模拟生物体内环境,后续可进一步对阿比特龙胶囊的体内生物利用度展开研究,有望降低给药剂量。
在筛选载体时,要考虑各载体、原料药的玻璃转化温度及分解温度,当挤出温度设置较低时,物料在螺杆间没有完全熔融,会导致挤出压力过大而挤出设备报警,无法顺利挤出。挤出温度低于180 ℃时,挤出物为乳白色,且横截面有未熔融颗粒,药物未完全分散于载体中。提高挤出温度至180 ℃,并增加双螺杆剪切单元,挤出物呈透明棒状,且表面光洁,此时DSC显示挤出物呈非晶态,且溶出度有很大提升,说明温度升高及螺杆的捏和组件对晶型的转变十分关键。
综上所述,本研究利用热熔挤出技术制备阿比特龙固体分散体,并对其胶囊剂进行研究。通过固体分散体技术显著提高其体外溶出度,为阿比特龙提高体内生物利用度提供前期研究基础,进一步研究将围绕体内生物利用度及其制剂稳定性研究展开。

