鸡血藤提取物改善睡眠剥夺诱导的学习认知功能障碍的作用*
孙毅红,白雨朦,王艳国,闫旭升,霍东升,宋 嵬,杨占君,贾建新
(1.包头医学院2019级研究生,内蒙古 包头 014040;2.包头市昆都仑区昆河镇卫生院;3.包头医学院病理生理学教研室;4.包头医学院人体解剖学教研室)
睡眠障碍(sleep disorders,SD)是中枢神经系统退行性疾病,临床表现与痴呆程度、认知功能等密切相关[1-2]。目前,已有学者发现睡眠障碍发生在认知能力下降之前甚至更早,但睡眠障碍通过何种机制影响学习认知功能仍无定论。研究表明,睡眠障碍作为一种应激源可致神经细胞凋亡[3],与此同时,也可引起明显的氧化应激损伤,使机体氧化物增加和抗氧化能力降低。既往文献报道,学习认知功能损害与氧化应激损伤、凋亡等密切相关,睡眠障碍是否通过诱发凋亡、氧化应激损伤等进而影响学习认知功能仍未探明[4]。
鸡血藤,豆科、被子植物门。药理学研究证明,鸡血藤提取物(spatholobus sinensis extract,SSE)具有镇静催眠、抗氧化及抗凋亡等药效作用[5],SSE是否可以通过抗氧化与抗凋亡机制改善睡眠剥夺诱导的学习认知功能障碍未见报道。本文旨在探明SSE对改善睡眠剥夺诱导的学习认知功能障碍的作用机制,以期为临床防治睡眠障碍及相关认知功能障碍疾病提供理论及实验依据。
1 材料和方法
1.1实验动物和分组 Wistar大鼠[SCXK(京)2 019-0 010],无菌级,雄性,8周龄,体质量260~280 g,60只,饲养于清洁级环境,自由进食水。随机分为6组(10只/组):空白对照组(Control)、平台对照组(Plat Control)、模型组(Model)、高剂量组(High)、中剂量组(Intermediate)、低剂量组(Low)。空白对照组全程不给予任何干预,自由进食水;平台对照组将动物置于多平台水环境连续睡眠剥夺60 d(平台直径10 cm);模型组及各剂量组进行多平台水环境连续睡眠剥夺60 d(平台直径5 cm),从睡眠剥夺第31天开始,连续给予SEE灌胃30 d(1次/d),给药剂量分别为:模型组[0 mg/(kg·d)]、低剂量[45 mg/(kg·d)]、中剂量[90 mg/(kg·d)]、高剂量[180 mg/(kg·d)]。
1.2试剂与仪器 SSE(购自中检院,国家药品标准物质),ELISA试剂盒(默沙克科技有限公司),BCA 蛋白定量分析试剂盒(批号:23227),Tubulin 抗体(批号:10094-1-AP),Bcl-2 抗体(批号:12789-1-AP),BAX抗体(批号:10701-1-AP)和山羊抗兔 IgG 二抗(批号:SA00001-2),山羊抗鼠 IgG 二抗(批号:SA00001-1)。水迷宫(美国 NatureGene 公司),TDL-40B 型离心机(上海安亨科学仪器厂),Max-M5 型酶标仪(美国 Molecular Devices 公司),SDS-PAGE 电泳仪(型号:DYY-7C,北京六一生物科技有限公司),凝胶扫描仪(型号:4466611,美国 BIO-RAD 公司)。
1.3方法
1.3.1睡眠剥夺模型大鼠的制备 改良多平台水环境法造模,实验装置为长130 cm、宽45 cm、高45 cm的水箱,水箱中放置20个直径5 cm、高15 cm的平台(模型组直径5 cm,平台对照组直径10 cm),注水深度为13 cm,水温22 ℃左右。将大鼠放置于平台上,当其进入快速动眼(REM)睡眠时期,肌张力松弛落水,此后重振精神爬上平台,如此反复达到睡眠剥夺目的。大鼠于实验前一周每天小平台适应1 h。实验期间12 h光照(8:00~20:00)/12 h黑暗,自由进食水。实验进行总时间为60 d(包括30 d睡眠剥夺模型制备、30 d给药过程中的睡眠剥夺)。
1.3.2旷场实验 大鼠于实验前、造模后、周期给药结束后分别进行旷场实验检测。使用大小为100 cm×100 cm×50 cm的活动箱,底面等分为9格。实验时,抓住大鼠尾根部三分之一处放入旷场实验箱正中格并开始计时。依次将每只大鼠放于箱中,使用自发活动分析软件分析5 min内大鼠自发活动状况,记录站立次数、修饰次数等指标。
1.3.3Morris水迷宫测试 定位航行实验历时5 d,每天训练4次。记录动物逃避潜伏期、上台前路程。第6 天进行空间探索实验,记录动物120 s内穿越平台次数及目标象限百分比等指标。
1.3.4Nissl染色及细胞计数 4 %多甲固定脑组织,常规石蜡包埋、切片。切片脱蜡至水,自来水冲洗,PBS冲洗5 min×3次,0.1 %甲苯胺蓝浸染30 min,95 %乙醇分化,镜下控制分化时间,待尼氏体清晰显示时终止;脱水、透明、封片,镜下每张切片海马CA1区选取3个视野(200倍)计数1 mm长度椎体细胞个数,取其均数进行分析。
1.3.5ELISA法测定血清褪黑激素(melatonin,MT)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性、丙二醛(malondialdehyde,MDA)水平 水迷宫实验结束后24 h,动物经腹膜腔注射麻醉。腹主动脉采血4-5 mL,4 ℃离心15 min(5 000 rpm),取血清100 μL备用。检测血清MT、SOD和GSH-Px活性、MDA的含量。ELISA操作步骤根据制造商试剂盒说明书(南京建成生物技术公司)进行。
1.3.6免疫组织化学染色 切片脱蜡至水,PBS洗5 min×3次。滴加阻断剂,37 ℃孵育20 min,PBS洗5 min×3次。抗原修复,室温晾凉,PBS洗5 min×3次。滴加一抗,4 ℃过夜,PBS洗5 min×3次。滴加反应增强液,37 ℃孵育20 min,重复PBS洗涤步骤。滴加生物素标记的二抗,37 ℃孵育20 min,PBS洗5 min×3次。DAB显色,自来水冲洗。最后经脱水、透明、封片。
1.3.7蛋白免疫印迹(Western blot) 海马组织称重后放入EP管中并加入蛋白裂解液,冰浴超声波破碎数次。4 ℃离心15 min(12 000 rpm),提取蛋白原液并测定浓度,蛋白制样。配制浓缩胶和分离胶,蛋白电泳、转膜;5 %脱脂奶粉室温封闭1 h后进行漂洗;一抗4 ℃冰箱摇床过夜,次日取出TBST漂洗;加入二抗室温避光孵育1 h后避光漂洗;使用成像分析系统对条带进行统计分析。
1.3.8图像处理和统计学分析 各组切片选取相同截面进行图像分析,每张切片选取3个视野(200倍)计数1 mm内锥体细胞数,取均数分析。实验数据采用SPSS 18.0统计软件进行分析,多样本均数两两比较采用单因素方差分析(One way ANOVA),样本服从正态分布,P<0.05为差异有统计学意义。
2 结果
2.1SSE对睡眠剥夺模型大鼠情绪行为的影响 旷场结果显示,实验前,各组大鼠修饰行为与站立次数之间差异无统计学意义(表1)。睡眠剥夺后,与空白对照组相比,剥夺组站立次数均显著性降低(P<0.05)。给予SSE干预30 d后,站立次数随给药剂量增加逐渐增高;与模型组相比,高剂量组站立次数明显增高(P<0.05);与空白对照组相比,低剂量组站立次数显著性降低(P<0.05),中、高剂量组差异无统计学意义。与空白对照组相比,睡眠剥夺导致大鼠的修饰行为显著增多,模型组、低剂量组、中剂量组修饰行为次数均显著性增高(P<0.05),高剂量组差异无统计学意义。SSE干预30 d后,修饰行为次数随给药剂量的增加逐渐降低;与模型组相比,高剂量组修饰行为次数明显降低(P<0.05)。上述结果表明,睡眠剥夺使大鼠焦虑情绪显著增加,SSE可以显著改善睡眠剥夺模型大鼠的焦虑情况。见表1。
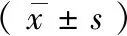
表1 旷场实验检测各组大鼠焦虑情况
2.2SSE对睡眠剥夺模型大鼠学习认知功能的影响 Morris水迷宫定位航行结果显示,空白对照组逃避潜伏期、上台前路程在第1 天显著大于其余各组(P<0.05),第1~5天上述指标下降趋势最显著,模型组与空白对照组在第5天差异显著(P<0.05)。与模型组相比,各剂量组逃避潜伏期、上台前路程在第4 、5天均有显著差异(P<0.05)。与空白对照组比较,平台对照组逃避潜伏期在第1 天显著减小(P<0.05),随后4 d未见显著性差异;平台对照组的上台前路程在第1~4天明显减小(P<0.05)。与模型组比较,平台对照组逃避潜伏期在第4 、5天显著减小(P<0.05);平台对照组的上台前路程5 d均明显小于模型组(P<0.05)。见表2、3。

表2 定位航行试验每组逃避潜伏期
空间探索结果显示,各组目标象限百分比存在显著差异(P<0.05)。与空白对照组相比,平台对照组、模型组、低、高剂量组目标象限时间百分比均显著减小(P<0.05);与模型组相比,中剂量组目标象限时间百分比均明显增加(P<0.05),其余各组未见显著性改变。与空白对照组相比,平台对照组、模型组、SSE低、高剂量组穿越平台数均显著减小(P<0.05);与模型组相比,中、高剂量组穿越平台数均明显增加(P<0.05),其余各组未见显著性差异。见表4。
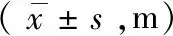
表3 定位航行试验每组上台前路程
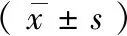
表4 空间探索检测各组大鼠记忆能力
2.3SSE对睡眠剥夺模型大鼠脑组织神经细胞的影响 Nissl结果显示,与空白对照组相比,模型组海马CA1区神经元数量明显降低(P<0.05),平台对照组无明显变化;与模型组相比,SSE中、高剂量组海马CA1区神经元数目均显著增加(P<0.05),且随剂量增加细胞数目也呈上升趋势;剂量组之间差异无统计学意义。与空白对照组相比,模型组齿状回神经元排列疏松且紊乱,SSE各剂量组齿状回神经元排列较为紧密规则,随给药剂量增加齿状回神经元数量增加,剂量组之间无明显差异。与空白对照组相比,模型组齿状回神经元数量明显降低(P<0.05),平台对照组未见明显变化;与模型组相比,各剂量组齿状回神经元数目均显著增加(P<0.05),且随着剂量的增加细胞数目也呈上升趋势;剂量组之间无明显差异。与空白对照组相比,模型组大脑皮层锥体细胞数量明显降低(P<0.05),平台对照组未见明显变化;与模型组相比,中、高剂量组大脑皮层锥体细胞数目均显著增加(P<0.05),且随着剂量的增加细胞数目也呈上升趋势;剂量组之间无明显差异。见表5,图1~3。

图1 Nissl染色显示SSE对睡眠剥夺模型大鼠海马CA1区神经元数目的影响(×200)注:A:空白对照组,B:平台对照组,C:模型组,D:低剂量组,E:中剂量组,F:高剂量组
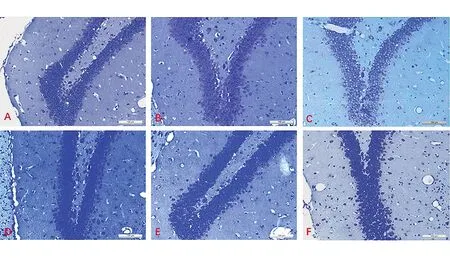
图2 Nissl染色显示SSE对睡眠剥夺模型大鼠海马齿状回神经元数目的影响(×200)注:A:空白对照组,B:平台对照组,C:模型组,D:低剂量组,E:中剂量组,F:高剂量组。

图3 Nissl染色显示SSE对睡眠剥夺模型大鼠大脑皮质锥体细胞数目的影响(×200)
表5 尼氏染色检测各组大鼠海马CA1区、DG区神经元数量及皮质区完整锥体细胞数量
2.4SSE对睡眠剥夺模型大鼠MT以及氧化应激标志物的影响 ELISA结果显示,与空白对照组相比,模型组血清MT明显降低(P<0.05),平台对照组血清MT含量无明显差异。SSE治疗后,随给药剂量的增加血清MT含量呈现上升趋势;与模型组相比,SSE中、高剂量组血清MT含量明显增加(P<0.05),但低剂量组无明显差异。与空白对照组比较,模型组血清SOD、GSH-Px活性明显降低,MDA含量显著升高(P<0.05),平台对照组上述指标差异无统计学意义。SSE治疗后,SSE中、高剂量组大鼠血清SOD、GSH-Px活性显著升高,MDA含量显著降低(P<0.05),低剂量组与模型组相比上述指标差异无统计学意义。见表6。
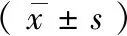
表6 ELISA检测各组血清MT、SOD、MDA与GSH-Px的水平
2.5SSE对睡眠剥夺模型大鼠凋亡相关蛋白表达的影响
2.5.1免疫组织化学染色 免疫组化结果显示,与空白对照组相比,模型组海马CA1区、齿状回、大脑皮质Bax、Bcl-2阳性细胞数均显著减少,平台对照组与空白对照组之间无明显差异。与模型组相比,SSE中、高剂量组海马CA1区、齿状回、大脑皮质Bax、Bcl-2阳性细胞数逐渐增加;低剂量组与模型组之间无明显差异。见图4~6。
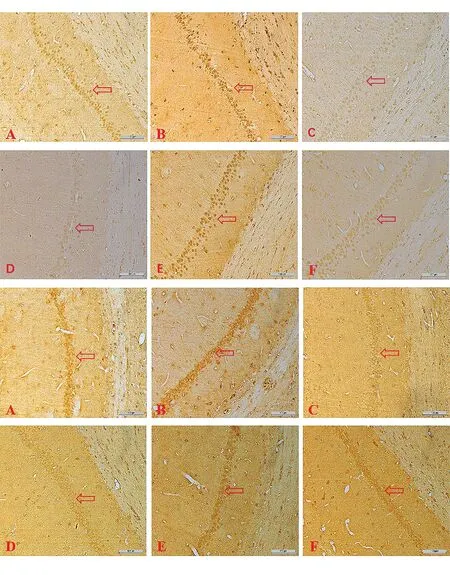
图4 免疫组织化学染色显示SSE对睡眠剥夺模型大鼠海马CA1区Bcl-2、Bax表达的影响(×200)注:A:空白对照组,B:平台对照组,C:模型组,D:低剂量组,E:中剂量组,F:高剂量组;红色箭头指向为阳性细胞。
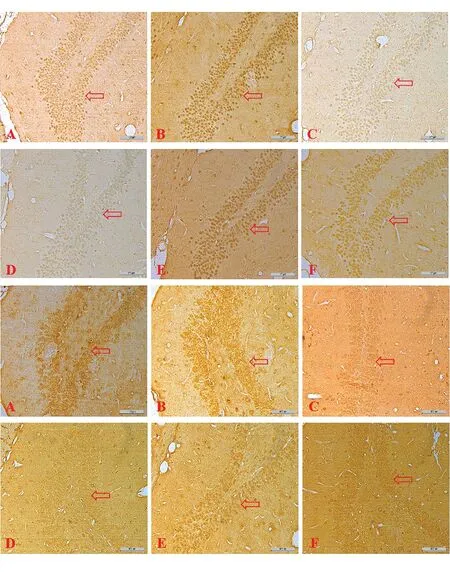
图5 免疫组织化学染色显示SSE对睡眠剥夺模型大鼠海马齿状回Bcl-2、Bax表达的影响(×200)注:A:空白对照组,B:平台对照组,C:模型组,D:低剂量组,E:中剂量组,F:高剂量组;红色箭头指向为阳性细胞。
2.5.2SSE对睡眠剥夺模型大鼠凋亡标志物蛋白表达的影响 Western blot结果显示,与空白对照组相比,模型组Bcl-2/Bax蛋白表达量比值显著降低(P<0.05),平台对照组与空白对照组之间差异无统计学意义;与模型组相比,高剂量组Bcl-2/Bax蛋白表达量比值显著升高(P<0.05);低、中剂量组与模型组之间差异无统计学意义,但随给药剂量的增加Bcl/Bax蛋白表达量比值呈上升趋势。上述结果表明,睡眠剥夺可以明显增加相关脑区凋亡程度,SSE治疗后在一定程度上降低了睡眠剥夺导致的海马、大脑皮层凋亡程度。见图7。
3 讨论
既往研究表明睡眠障碍不仅可以引起学习记忆功能下降,也会增加焦虑、易激惹等负面情绪[6]。本研究结果显示,睡眠剥夺可以诱发动物出现焦虑情绪,这与既往研究报道相一致。给予SSE后,随给药剂量增加模型动物站立次数显著增多、修饰行为显著减少,这表明SSE可以缓解睡眠剥夺模型大鼠的焦虑情绪。既往文献报道,睡眠剥夺可以引起机体学习认知功能障碍[7]。本实验研究显示,定位航行实验中空白对照组逃避潜伏期、上台前路程在第1天均明显高于其余各组,但空白对照组动物定位航行实验的5 d内,逃避潜伏期与上台前路程下降趋势最为显著;空间探索实验结果揭示空白对照组记忆能力最为突出。根据水迷宫结果不难看出,SSE可显著降低模型大鼠逃避潜伏期、上台前路程并增加目标象限时间百分比及平均穿台次数,故笔者认为睡眠剥夺是引起认知功能损害的原因之一,且SSE能在一定程度上减轻学习认知损伤。
众所周知,学习认知功能障碍主要与氧化应激损伤、自噬功能紊乱、凋亡等有关。相关研究表明,睡眠障碍可引起机体发生氧化应激反应。氧化应激与凋亡关系密切,氧化应激可直接或间接调控和诱导细胞凋亡[8]。本实验结果显示,睡眠剥夺明显降低了动物血清SOD、GSH-Px的活性,相反MDA含量增加,提示睡眠剥夺引起了动物体内氧化应激损伤。给予SSE治疗后,可以逆转睡眠剥夺对上述指标的影响,提示SSE具有抗氧化应激损伤的药效作用,SSE可能通过抗氧化应激损伤机制改善睡眠剥夺诱导的认知功能障碍。
此外,据文献报道,睡眠剥夺会引起大鼠体内启动细胞凋亡相关程序,使机体Bcl-2表达减少,Bax表达增多。Bax、Bcl-2是Bcl-2蛋白家族的两大蛋白,是参与线粒体凋亡途径的重要调控者[9]。Bax作为Bcl-2拮抗剂发挥促凋亡作用,Bcl-2与Bax结合形成异源二聚体,发挥抗凋亡作用;但当Bax表达过量时,Bax间相互结合形成同源二聚体来促进凋亡[10]。因此,Bcl-2与Bax二者的比例关系决定着细胞凋亡的发展走向。本实验结果显示,睡眠剥夺大鼠脑组织凋亡相关蛋白Bax、Bcl-2表达均减少,给予SSE治疗后Bax、Bcl-2的表达量均有所升高。睡眠剥夺可以使Bcl-2/Bax蛋白表达比值降低,且SSE干预后比值随剂量增加而逐渐上升,表明睡眠剥夺导致机体促凋亡作用大于抑制凋亡作用,相反,SSE抑制凋亡作用大于促进凋亡的作用,总体上发挥抗凋亡的作用。本实验结果还发现,睡眠剥夺会显著减少大鼠海马CA1区、海马齿状回及皮质的细胞数量,细胞排列相对疏松且不规则,即睡眠剥夺会导致脑细胞的数量和质量均降低,进而影响到脑的正常生理功能;SSE可以显著提高睡眠剥夺模型大鼠上述各脑区神经细胞的数量并改善细胞形态,提示SSE可能通过影响神经细胞的存活状态进而调控脑的学习认知功能。上述结果提示,SSE抑制并扭转睡眠剥夺引起的细胞凋亡这一结论是毋庸置疑的。
褪黑激素(MT)由松果体分泌,调控昼夜节律、有强大的神经内分泌免疫调节活性和清除自由基抗氧化能力。MT与睡眠质量密切相关,MT的水平是衡量睡眠质量的指标,睡眠障碍可以导致机体MT水平降低[11]。睡眠剥夺颠倒了大鼠的昼夜节律,导致血清MT水平显著降低,而给予SSE治疗后血清MT显著升高并呈现药物剂量依赖性。
本实验给药设立了低、中、高剂量组,通过对实验结果整体分析可知,药效作用一定程度上随给药剂量的增加逐渐提高,中剂量组90 mg/(kg·d)和高剂量组180 mg/(kg·d)作用较为明显且无显著性差异,基于上述现象笔者推测,其一,本实验给药剂量总体设置可能偏大,中剂量组90 mg/(kg·d)和高剂量组180 mg/(kg·d)已经达到了药物治疗效果的平台期,故最佳给药剂量应该位于45~90 mg/(kg·d);其二,SSE药效治疗效果曲线有可能呈抛物线,本实验设置的中剂量90 mg/(kg·d)、高剂量180 mg/(kg·d)可能刚好落到最佳给药剂量(抛物线最高点)两侧,即最佳给药剂量在90~180 mg/(kg·d),故两组间差异无统计学意义,确切的最佳给药剂量仍需后续的实验研究加以证实。
综上所述,SSE可能通过抑制机体氧化应激损伤和神经细胞的凋亡,进而改善睡眠剥夺诱导的认知功能障碍。本研究结果将为SSE用于临床治疗睡眠障碍及相关认知功能障碍提供一定的理论及实验依据。

