高强度间歇训练改善肥胖患者认知功能的线粒体机制研究进展
蔡明,王晓军,陈晓艳,胡静芸
2021年12月发布的《第五次国民体质监测公报》显示,我国成年人(14.6%)和老年人(16.7%)的肥胖率增长幅度明显加快[1]。预计到2025年,肥胖率将达到23.1%[2]。肥胖不仅是高脂血症、高血压、胰岛素抵抗、2型糖尿病等代谢性疾病发生的主要诱因[3],其负代谢后果更是损害认知功能的重要风险因素[4]。研究发现,肥胖啮齿动物脑内线粒体去极化、肿胀、含量减少,三磷酸腺苷(ATP)产能下降以及过量活性氧 (reactive oxygen species,ROS)生成[5],导致能量危机,是认知损伤的重要诱因[6]。而既往研究也证实了脑内线粒体功能障碍与神经退行性疾病之间的高度相关性[7],在肥胖阶段,靶向治疗线粒体稳态受损通路可能是一种有效的恢复神经元功能的策略。
近年来临床研究发现,高强度间歇训练(high-intensity interval training,HIIT)在提高超重/肥胖患者认知功能方面有较为显著的效果[8-9],是肥胖患者健康管理的有效康复策略之一,但目前尚不清楚HIIT改善肥胖认知损伤的神经生物学机制。运动产生的有益生理效益常伴随线粒体数量的增加、线粒体活性的提高以及适应力的增强[10]。基于线粒体和肥胖、HIIT之间的相互联系,脑内线粒体生物发生的信号上调、线粒体功能提高可能是HIIT改善肥胖认知损伤的重要作用途径。
本文以“肥胖、认知损伤、认知功能障碍、高强度间歇训练、线粒体功能、线粒体功能紊乱、线粒体生物发生”为中文关键词检索中国知网、维普网、万方数据知识服务平台等数据 库, 以“obesity、Cognitive dysfunction、Cognitive function impairment、High-intensity interval training、 Mitochondrial function、Mitochondrial dysfunction、Mitochondrial biogenesis”为英文关键词检索PubMed 、Web of Science、Embase等英文数据库;检索时间为建库至2021 年 12月;文献的纳入标准:肥胖损伤认知功能的脑线粒体机制与高强度间歇训练改善作用相关的临床研究、基础研究和文献研究;文献的排除标准:无法获取全文和数据的文献、内容或观点重复发表的文献、质量较差及陈旧的文献等。
1 肥胖损害脑线粒体功能并损伤认知功能
1.1 肥胖患者脑内线粒体功能障碍 线粒体是满足机体能量需求的重要细胞器,其结构和功能表现出与代谢的高度适应,在能量代谢中起核心作用[11]。除了合成ATP供细胞利用、支持细胞功能外,线粒体还参与了ROS的产生和清除[12]。线粒体功能的破坏会导致ATP减少,ROS水平过高,影响能量内稳态[13]。神经元中线粒体影响神经传递、钙稳态控制、短期和长期神经可塑性等,为学习、记忆的形成、巩固提供能量保障[14]。肥胖啮齿动物脑内常会发生线粒体功能障碍〔如线粒体膜电位(mitochondrial membrane potential,MMP)降低、ROS过多、线粒体耗氧量减少、ATP生成减少等〕,并伴随突触可塑性降低和记忆能力衰退[15-16],这是因为线粒体功能缺陷会导致葡萄糖、脂质、氨基酸在脑内代谢受阻[17],能量代谢紊乱进一步加重了神经元损伤,加速认知障碍的病理发展[11,18]。基于此,了解和揭示影响大脑线粒体能量代谢的过程,恢复线粒体的结构和功能,将为肥胖认知损伤提供一个重要的治疗靶点。
1.2 引起肥胖患者认知损伤的各因素与线粒体功能障碍的内在联系 肥胖导致的认知功能衰退是多因素作用的结果,但无论是高脂膳食还是脑内胰岛素抵抗、炎症、氧化应激、内质网应激(endoplasmic reticulum stress,ERS),最后均指向于线粒体功能受损(图1)。

图1 引起肥胖患者认知损伤的各因素与线粒体功能障碍间的联系Figure 1 The relationship of induction factors of obesity-related cognitive impairment with cerebral mitochondrial dysfunction
1.2.1 高脂饮食 流行病学研究表明,高脂饮食会增加肥胖患者发生认知损伤的风险[19]。动物研究表明,高脂饮食会损害脑源性神经营养因子 (brain-derived neurotrophic factor,BDNF)的表达[6]和神经元突触数量[20],对调控大脑认知的功能性蛋白和结构造成损害,引起焦虑[21]、抑郁样行为[22]、视觉记忆丧失[20]、空间学习记忆能力受损[23-24]。MARQUES NETO等[25]研究发现,18周的高脂膳食会导致肥胖大鼠脑内线粒体肿胀,引起线粒体功能障碍。WANG等[15]研究发现,高脂膳食喂养小鼠20周后,其脑内MMP下降,ATP合成减少,ROS水平升高,而在改善小鼠脑内线粒体功能障碍后,认知缺陷的症状得到了缓解。上述研究表明,线粒体功能受损可能是高脂饮食损害肥胖患者认知功能的重要原因之一。
1.2.2 中枢胰岛素抵抗 脑内胰岛素存在于嗅球、下丘脑、大脑皮质、小脑和海马等脑区,与胰岛素受体结合后可调控食物摄入、Tau蛋白磷酸化、淀粉样前体蛋白 (amyloid precursor protein,APP)代谢、β-淀粉样蛋白 (amyloid β-protein,Aβ)清除、神经元存活及记忆[26-27]。肥胖会导致中枢发生胰岛素抵抗 ,还会引起胰岛素受体磷酸化水平下降,而胰岛素受体底物1 (insulin receptor substrate-1,IRS-1)磷酸化水平升高,磷脂酰肌醇激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI3K/AKT)和丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK)过度激活,会削弱胰岛素的敏感性,使胰岛素信号通路受损,从而损害认知功能[28]。既往研究表明,中枢胰岛素抵抗导致的认知障碍可能与线粒体功能紊乱关系密切[29-30]。首先,中枢胰岛素抵抗导致的胰岛素信号级联异常不利于神经元对葡萄糖、游离脂肪酸等能量底物的摄入,阻碍线粒体对神经元的能量供应,使大脑功能受损[6]。其次,中枢胰岛素抵抗也会直接造成线粒体肿胀、ROS产生增加、MMP去极化、ATP合成下降、耗氧量和CO2生成减少、氧化还原失衡等一系列线粒体病理性改变,引起线粒体功能紊乱,影响突触功能维护和重塑的基本进程[29,31]。BEIRAMI等[32]研究发现,改善大鼠海马内PI3K/AKT介导的胰岛素信号,可促进线粒体发生相关基因和蛋白的表达,改善工作记忆、学习记忆能力以及再认记忆障碍,提示线粒体可能是胰岛素信号传导的靶细胞器。
1.2.3 神经炎症 脑内炎症信号在肥胖的状态下会被激活,引发神经炎症,损害认知功能[33-34]。核转录因子κB(nuclear factor kappa-B,NF-κB)在介导肥胖相关炎性信号和炎性反应中发挥了核心作用[35]。NF-κB可释放NOD样受体蛋白 3(NOD like receptor protein 3,NLRP3)、白介素 1β(interleukin-1β,IL-1β)、肿瘤坏死因子α(TNF-α)等炎性因子,阻碍长时程增强(long-term potentiation,LTP)和记忆的形成[36]。其中NLRP3可与半胱氨酸天冬氨酸蛋白水解酶1(cysteine-requiring aspartate protease-1,caspase-1)组成炎性小体,促进IL-1β、IL-18的成熟、释放,进一步加剧神经炎症[37],抑制环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)磷酸化和BDNF的表达,损害突触可塑性[38]。既往研究发现,肥胖啮齿动物脑内发生神经炎症时会伴随线粒体功能抑制[5,39],表明线粒体功能障碍在触发认知受损相关的炎症信号中发挥了重要作用。近期研究发现,线粒体功能障碍可通过多种方式强化炎症信号,改善线粒体功能可能是缓解神经炎症、治疗认知障碍的靶点[40]。受损的线粒体成分从神经元中释放是调控该炎症通路的前提,这种释放途径有两种,一种是细胞坏死或凋亡导致的神经元死亡[41];另一种是“transmitophagy”,即受损的线粒体在神经元的轴突末梢释放后,被周围胶质细胞降解[42]。在这个过程中,受损的线粒体DNA(mtDNA)、线粒体损伤产生的高水平ROS均可刺激炎症小体NLRP3介导的炎症信号,促使炎性因子分泌,增强炎性反应[40]。
1.2.4 ERS ERS是内稳态失衡导致折叠或错误折叠的蛋白在内质网腔内积累引起的应激状态。前期研究发现,肥胖会引起大鼠海马、前额叶脑区葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)蛋白表达、蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)、肌醇酶1α(inositol-requiring enzyme 1,IRE1α)和真核细胞起始因子2α(eukaryotic initiation factor 2α,eIF2α)的磷酸化水平升高,产生过度的ERS反应,诱导细胞凋亡并降低突触可塑性蛋白的合成[43-44]。而抑制高糖、高脂诱导的神经元ERS,能减少神经元凋亡并提高突触可塑性[45]。值得注意的是,长期的ERS一方面会使线粒体产生过量的ROS,引起氧化应激,损害线粒体功能[46];另一方面会引起线粒体-内质网结构偶联(mitochondria-associated endoplasmic reticulum membranes,MAMs)作用增强,导致内质网到线粒体的钙通量增加,线粒体钙超载伴随着线粒体ROS产生的增加,进而使线粒体功能受损[47]。但在肥胖状态下,ERS对线粒体功能损伤有何影响,以及这些会对认知产生怎样的负面效应,目前还未见报道。在未来的研究中明确ERS与线粒体的相互作用将为研究肥胖状态下认知损伤的机制提供新的思路。
1.2.5 氧化应激 在肥胖的情况下,氧化应激已被证明会影响大脑线粒体功能和认知功能。氧化应激是由自由基的产生与抗氧化防御系统中的抗氧化物质生成之间的严重失衡引起[48]。核因子E2相关因子2(nuclear factor E2-related factor 2,NRF2)是调节Ⅱ期抗氧化反应的调控因子,通过与抗氧化反应元件 (antioxidant response element,ARE)相互作用调控抗氧化信号,使大脑免受氧化损伤。FREEMAN 等[49]研究发现肥胖小鼠海马和脑皮质区内ROS水平显著升高,谷胱甘肽过氧化物酶 (glutathione peroxidase,GPx)活性、抗氧化调控信号NRF2/Kelch样环氧氯丙烷相关蛋白1 (Kelch-like ECH-associated protein 1,Keap1)降低。MORRISON等[50]研究亦表明,肥胖小鼠海马内NRF2活性下降,其下游应答蛋白血红素氧合酶1 (heme oxygenase-1,HO-1)和NAD(P)H:醌氧化还原酶1 (NQO1)表达均被抑制。MA等[51]研究则表明,尽管肥胖大鼠脑内还原型谷胱甘肽 (reduced glutathione,GSH)水平、GSH/氧化型谷胱甘肽 (oxidized glutathione,GSSG)下降,但为了应对氧化应激会提高谷胱甘肽过氧化物酶(GSH-Px)活性以及上调NRF2/NQO1信号。这种部分矛盾的研究结果可能是由高脂饲料配方、高脂干预时间、动物取材的组织、动物年龄、种属差异性引起的。PINTANA等[52]研究表明,通过减轻肥胖大鼠脑内氧化应激可以减少线粒体ROS生成、增强MMP以及修复线粒体结构损伤,改善线粒体功能障碍并逆转学习记忆能力的受损。因此,改善肥胖状态下脑内氧化应激,将有利于线粒体功能恢复及缓解认知损伤。
2 HIIT在控制肥胖及认知损伤中的应用及研究进展
2.1 HIIT在肥胖管理中的临床应用价值 2018年美国体力活动指导咨询委员会(Physical Activity Guidelines Advisory Committee,PAGAC)指出HIIT在健康促进中的重要性。随后有研究强调了HIIT可以改善20~77岁人群的胰岛素敏感性、血压和身体成分[53],降低肥胖等代谢性疾病发生风险[54]。与常规的有氧训练比,HIIT是控制肥胖更有效的运动策略[55-56]。
HIIT是一种重复多次、交替进行短期高强度和休息/低强度恢复的运动[57]。目前,根据HIIT的概念研发了多种训练方法,主要分为有氧HIIT和自重 HIIT (抗阻HIIT)。HIIT训练可灵活根据肥胖个体的身体素质进行运动策略的修正,起到个性化运动处方的效果;且HIIT运动模式多样 (包括骑行、游泳、水上训练、交叉训练等),可根据个人意愿进行选择。个性化的HIIT运动疗法更切合当下对肥胖的管理,有效纠正肥胖代谢紊乱,预防肥胖相关风险因素。
2.2 HIIT改善肥胖认知损伤的研究 临床研究表明,HIIT可通过提高脑内氧合功能[58]和分泌神经营养因子[8-9]两方面,提高肥胖患者的认知功能,是肥胖个体提高认知功能的有效运动康复策略。DRIGNY等[58]通过使用近红外光谱技术发现,中年肥胖患者在经历4个月的HIIT后脑血氧饱和度明显提升,同时伴随短期记忆、言语记忆和注意力等认知功能的提升。而与常规有氧训练相比,HIIT可在很短的时间内促进肥胖人群分泌神经营养因子。例如,一次性的HIIT结合抗阻训练可刺激超重青年人产生较高水平的BDNF、神经营养因子3 (neurotrophin-3,NT-3)、NT-4/5[9]。且相比一次性常规有氧训练,青年肥胖患者 BDNF对HIIT更敏感[8]。动物研究表明,HIIT能促进肥胖大鼠的脑微循环,改善线粒体功能[25]。以上研究表明,HIIT可有效改善肥胖患者认知损伤情况。
3 线粒体是HIIT促进认知改善的靶细胞器
3.1 HIIT可通过改善线粒体功能提高认知功能 运动能在细胞水平上对脑功能产生有益影响,而线粒体是其首选的目标细胞器[59]。运动对脑线粒体的影响在于能增强线粒体适应性[60-61],提高抗氧化能力和改善氧化应激[62],促进线粒体功能[63]。临床研究发现,仅一次性21 min的HIIT就能显著提高受试者脑内谷胱甘肽的水平[64]。动物研究表明,6周的HIIT能促进啮齿动物海马内丙二醛 (malondialdehyde,MDA)等氧化产物的清除[65-66]和减少ROS的生成[67],且能显著提高皮质、海马、纹状体脑区中超氧化物歧化酶(SOD)、总抗氧化能力 (total antioxidant capacity,TAC)、GSH-Px、过氧化氢酶(catalase,CAT)的活性[65-67]。而12周的HIIT能通过减轻阿尔茨海默病小鼠海马内线粒体氧化应激损伤,修复线粒体的形态、结构、功能,促进小鼠的认知功能恢复[68]。本研究团队前期研究也发现,6周的HIIT能通过调控健康小鼠海马内的线粒体动力学和线粒体生物发生,改善线粒体质量,提高能量代谢效率,增加BDNF表达和CA1区树突棘密度,促进突触可塑性[69]。以上研究表明,HIIT能改善脑内氧化应激,促进线粒体网络的稳态平衡,这有利于保证线粒体的质量,增强线粒体功能。而MARQUES NETO等[25]研究发现,仅4周的HIIT就能减轻肥胖大鼠脑内线粒体的肿胀程度,并增加其脑毛细血管密度,进一步验证了HIIT可能会通过靶向促进线粒体功能对肥胖相关认知损伤产生正面效益。
3.2 线粒体生物发生在促进线粒体功能中的作用 线粒体生物发生受应激刺激、细胞能量需求而触发,以应对细胞内的环境变化[70]。线粒体生物发生与mtDNA的复制、线粒体动力学相偶联,用自身的基因组产生具有功能性的新线粒体[71],表现为线粒体数量增多、体积增大、特异性荧光信号增强、相关蛋白表达上调[72],对线粒体功能的维持尤为重要。
过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferators-activated receptor γ coactivator-1α,PGC-1α)是调控线粒体生物发生的主要刺激因子[73],可与下游NRF1/2相互作用,促使线粒体转录因子 (mitochondrial transcription factor A,TFAM)活化进入到线粒体内,诱导mtDNA的转录与复制,最终促进线粒体的复制[74]。研究发现AD小鼠海马内PGC-1α介导的线粒体生物发生信号通路受损[75]。而激活小鼠皮质神经元内PGC-1α-NRF1调控的线粒体生物发生后,可增加神经元内线粒体耗氧量和ATP产生水平,增强线粒体功能[76],可以推测,上调线粒体生物发生信号通路是提高线粒体功能、靶向治疗神经退行性病变认知损伤的可行策略。目前证据仅表明,线粒体生物发生信号受损是引起肌肉[77]、肝脏[78]、脂肪[79]等组织器官线粒体功能障碍的重要机制之一。该信号是否关联肥胖患者脑线粒体功能障碍以及是否参与调控认知相关的信号、靶蛋白,仍有待于进一步研究。
3.3 脑内线粒体生物发生信号对运动强度敏感 有研究发现,8周高强度运动能显著提高青年[80]和老年小鼠[74]脑内PRC mRNA、PGC-1α蛋白表达和mtDNA的水平。MARQUESALEIXO等[81]研究发现,12周跑台运动能激活大鼠皮质区域PGC-1α介导的线粒体生物发生,改善线粒体氧化应激,促进线粒体氧化磷酸化(oxidative phosphorylation,OXPHOS)相关的复合物Ⅰ、Ⅲ、Ⅴ的蛋白表达,提高线粒体氧化磷酸化效率,促进突触可塑性蛋白的表达。STEINER等[82]研究发现,8周跑台运动能显著促进青年小鼠海马、皮质、下丘脑、小脑等脑区PGC-1α mRNA、mtDNA水平的表达,但是急性运动却不能对这些脑区PGC-1α和mtDNA的表达产生影响。而GUSDON等[63]研究表明,3周跑台训练不能对老年小鼠皮质、纹状体区域线粒体生物发生相关蛋白PGC-1α和TFAM表达产生影响。上述研究表明,运动对脑线粒体生物发生信号的刺激效应需要一定的周期。此外,运动强度也是激活线粒体生物发生信号的关键因素。HIIT作为一种高强度的运动,可显著刺激肌肉内的PGC-1α基因、蛋白表达,促进线粒体生物发生[83]。而本研究团队先前的研究也发现,6周的HIIT能提高健康小鼠海马内的线粒体生物发生[69]。因此,HIIT很可能会通过促进肥胖脑内的线粒体生物发生而提高线粒体功能,对认知功能产生显著的促进效果(图2)。当然,这其中需要涉及研究HIIT强度-剂量效应、运动周期对刺激脑内线粒体生物发生的影响。
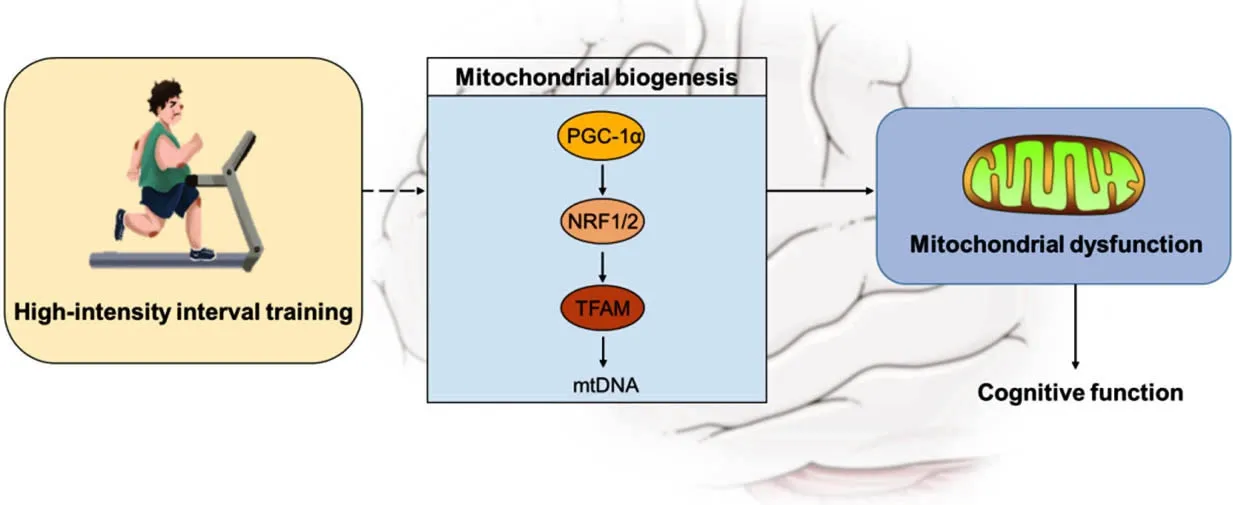
图2 HIIT促进认知功能的线粒体机制Figure 2 The possible mechanisms of high-intensity interval training on improving obesity-related cognitive impairment
4 小结与展望
由于相较常规有氧训练而言,HIIT每次消耗的总时间较少,不仅可高效率实现定期体育运动的健康效益,还有改善肥胖患者认知损伤的潜力,是一个极具吸引力的运动康复策略。但目前HIIT临床应用于防治肥胖患者认知损伤还有待于系统评估。第一,报告HIIT不良事件的研究比例较低,研究对象的数据也较少,大多数HIIT的干预周期较短,导致可获得的相关数据有限。肥胖患者在临床上心血管代谢适应的运动风险性和HIIT安全性未知。且患者长期坚持HIIT的意愿及运动能力目前也无有力的临床证据支持。第二,目前研究中使用HIIT相关锻炼方案和强度范围相对广泛,不利于医务工作者制定最佳的HIIT运动处方。未来还需要继续进行研究以评估、比较和系统地回顾特定类型的HIIT对肥胖患者认知功能损伤的保护作用。
作者贡献:蔡明负责文献和资料收集、论文撰写及论文图片制作;王晓军负责文章的质量控制及审校;陈晓艳负责文章的文献/资料整理;胡静芸负责研究命题的提出、设计及负责最终版本修订,对论文负责。所有作者确认论文终稿。
本文无利益冲突。

