超声波协同纤维素酶提取紫苏叶多糖的工艺条件优化及抗氧化活性分析
梁乐欣,黄晓辰,黄晓婷
(肇庆学院食品与制药工程学院,广东肇庆 526061)
紫苏叶具有独特的气味,是我国南方常见的调味品。同时,紫苏也是我国传统的中草药之一,已被我国卫生部列为药食两用的中药之一[1],具有很高的研究价值。经现代药理学研究,紫苏已经分离鉴定出酚酸类、脂肪酸类、甾醇类、挥发油类、黄酮类化合物等化学成分100余种,具有多方面的生物活性,如解热镇静、抗炎、抗过敏、抗氧化、促进记忆等[2]。有研究表明,紫苏多糖具有改善游泳行为和单胺类神经递质异常的作用,同时还能吞噬金黄色葡萄球菌、大肠杆菌和部分革兰氏阳性及革兰氏阴性细菌[3]。
常见的多糖提取方法有超声提取法、热水直接浸提法、酶提取法、微波提取法等。紫苏叶细胞壁的主要成分是纤维素,利用纤维素酶水解细胞壁,使更多胞内多糖溶出[3]。超声波则是利用空化作用、热效应和机械效应等加快有效物质溶于溶剂,使多糖的提取率提高[4]。结合纤维素酶法和超声提取法,以紫苏干叶为原料提取紫苏叶粗多糖,并利用响应面分析法优化多糖提取的工艺参数,使多糖浸出率提高,为对紫苏叶粗多糖的进一步研究提供参考依据。
1 材料与方法
1.1 材料与试剂
紫苏干叶,康美药业股份有限公司提供;纤维素酶,上海阿拉丁生化科技股份有限公司提供;乙酸钠、冰乙酸、盐酸、过硫酸钾、三氯乙酸、氯化钠等,均为分析纯。
1.2 仪器设备
V-1100D型紫外-可见分光光度计,上海美谱达仪器有限公司产品;KX-1613T型超声波清洗机,北京科玺世纪科技有限公司产品;DS-Y500A型高速多功能粉碎机,上海顶帅电器有限公司产品;HHS型电热恒温水浴锅,上海博迅实业有限公司医疗设备厂产品;DHG-9145A型电热鼓风干燥箱,上海一恒科学仪器有限公司产品;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂产品;TG16-WS型高速离心机,湖南湘仪实验室仪器开发有限公司产品。
1.3 工艺流程
紫苏叶→洗净、烘干→粉碎、过筛→纤维素酶处理→超声处理→离心→上清液→浓缩→醇沉→离心沉淀→干燥→多糖粗品。
1.4 试验方法
1.4.1 紫苏干叶粗多糖提取
称取1 g经粉碎过筛的紫苏干叶,加入pH值4.8的缓冲溶液30 mL和一定量的纤维素酶,在一定的温度和时间条件下酶解,在沸水浴中灭酶0.5 h。放入超声清洗机中超声一定的时间后,得到紫苏叶粗多糖提取液。将提取液真空浓缩,加入80%乙醇醇沉后,以转速4 000 r/s离心30 min,真空干燥后制得多糖粗品。
1.4.2 制作葡萄糖标准曲线
利用蒽酮-硫酸法[5-6],绘制葡萄糖标准曲线。配制质量浓度为1 mg/mL的葡萄糖标准溶液。将编号为1~9的10 mL具塞试管中分别移取0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9 mL,分别加水至2 mL,摇匀,加入6 mL蒽酮试剂(0.1 g蒽酮溶于100 mL 80%H2SO4),沸水浴15 min,冷水浴30 min,室温下放置至常温。用水作空白对照,于波长620 nm处测定吸光度。以质量浓度和吸光度分别作为横纵坐标,绘制标准曲线,得到的回归方程设为公式(1)。

1.4.3 样品多糖含量的测定
将多糖粗品用蒸馏水定容至100 mL,从中吸取4 mL定容至100 mL作为待测样液。从样液中吸取2 mL,测定于波长620 nm处的吸光度,利用公式(2)计算换算系数f,

式中:W——紫苏叶多糖的质量,μg;
D——紫苏叶多糖的稀释倍数;
C——多糖溶液中葡萄糖的质量浓度,μg/mL。再利用公式(3),计算多糖提取率:
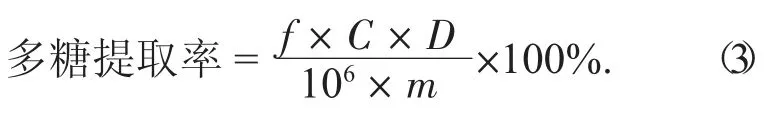
式中:C——样品溶液中葡萄糖质量浓度,μg/mL;
D——样品溶液稀释倍数;
f——换算系数;
m——紫苏叶干粉质量,g。
1.4.4 单因素试验设计
试验选取酶解时间、酶解温度、加酶量和超声时间4个因素,考查其对紫苏多糖提取的结果影响。其中,酶解时间为20,30,40,50,60 min 5个水平;酶解温度为35,40,45,50,55℃5个水平;加酶量为1 000,1 200,1 400,1 600,1 800 U/g 5个水平;超声时间为20,30,40,50,60 min 5个水平,分别进行单因素试验。
1.4.5 响应面试验设计
运用Box-behnken试验设计方法,在单因素试验基础上,对酶解时间、酶解温度、加酶量和超声时间4个影响因素进行优化,影响因素的低、中、高水平分别用-1,0,1表示,进行响应面分析。
1.4.6 羟基自由基清除率测定
移取0.5 mL样品于试管中,加入浓度为100 mmol/L pH值7.4的PBS缓冲液2.5 mL,混匀后加入浓度为1 mmol/L的邻二氮菲溶液1.5 mL,浓度为9 mmol/L的FeSO4溶液0.5 mL,立即混匀[7]。加入质量分数为1%的H2O2溶液0.5 mL启动反应,于37℃下保温1 h,测定波长536 nm处的吸光度A。再以质量浓度为2 g/L抗坏血酸溶液作对比试验,其中A管以不加H2O2的管调零,用PBS缓冲液调零A1和A2管。重复测定3次,计算清除率。下式中,A1为加入1.0 mL水代替提取液和双氧水的管的吸光度;A2为加入0.5 mL水代替提取液的管的吸光度。以抗坏血酸作为对照组,清除率按公式(4)计算。
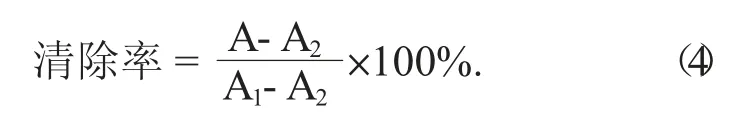
1.4.7 DPPH自由基清除率测定
用无水乙醇配制0.2 mmol/L的DPPH溶液,准确吸取1.5 mL样品待测溶液和0.2 mmol/L DPPH溶液0.5 mL,摇匀后在室温下避光放置30 min,测量波长517 nm处的吸光度,每个样品平行测定3次[8]。下式中,A0为DPPH溶液0.5 mL加蒸馏水1.5 mL的吸光度;A1为样品溶液1.5 mL加DPPH溶液0.5 mL的吸光度;A2为样品溶液1.5 mL加无水乙醇0.5 mL的吸光度。按照公式(5)计算各待测样品对DPPH自由基的清除率,并用抗坏血酸做对照组。

2 结果与分析
2.1 葡萄糖标准曲线
以葡萄糖质量浓度、吸光度分别作为横纵坐标,绘制标准曲线,得线性回归方程Y=4.621 8X+0.055 3,R2=0.997 9。结果表明,无水葡萄糖在质量浓度为0~0.5 mg/mL内线性关系良好。
葡萄糖标准曲线见图1。

图1 葡萄糖标准曲线
2.2 单因素试验结果
2.2.1 酶解时间对多糖提取率的影响
在超声时间50 min,加酶量1 000 U/g,酶解温度40℃条件下,研究酶解时间20,30,40,50,60 min对多糖提取率的影响。
酶解时间对多糖提取率的影响见图2。

图2 酶解时间对多糖提取率的影响
由图2可知,当酶解时间为20~30 min时,提取率随着时间增加而增加,说明酶与底物充分反应,在30 min时多糖提取率最高,当酶解时间为30~60 min时,提取出的多糖可能出现分解现象,使紫苏叶多糖的提取率逐渐下降。
2.2.2 酶解温度对多糖提取率的影响
在超声时间50 min,加酶量1 000 U/g,酶解时间30 min条件下,研究酶解温度20,30,40,50,60℃对多糖提取率的影响。
酶解温度对多糖提取率的影响见图3。

图3 酶解温度对多糖提取率的影响
由图3可知,当酶解温度在30℃时,提取率最大;当酶解温度为30~60℃时,纤维素酶受热,活性降低,催化能力减弱,提取率呈下降趋势。由此可知,酶的最适温度大约为30℃,此时酶的活性最大,水解反应进行得更顺利。
2.2.3 加酶量对多糖提取率的影响
在超声时间50 min,酶解时间30 min,酶解温度30℃的条件下,研究加酶量0,500,1 000,1 500,2 000 U/g对多糖提取率的影响。
加酶量对多糖提取率的影响见图4。
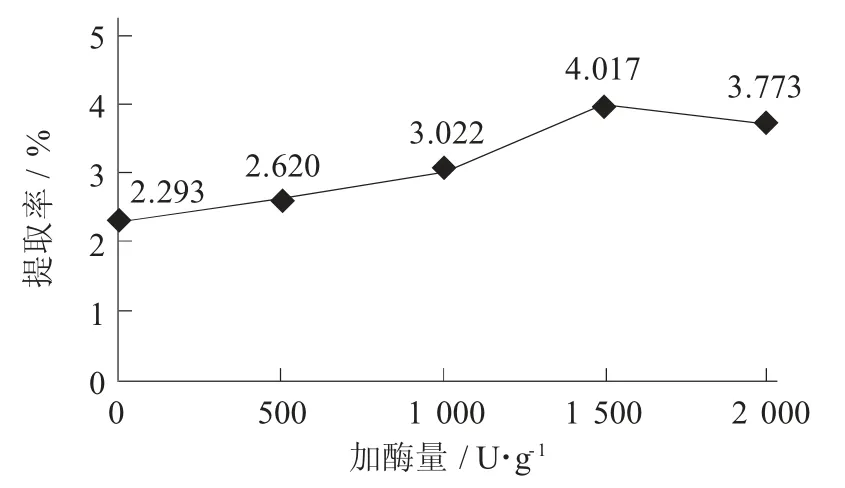
图4 加酶量对多糖提取率的影响
由图4可知,当加酶量为0~1 500 U/g时,紫苏叶多糖提取率随加酶量的增加而提高;当加酶量为1 500 U/g时,提取率最大;当加酶量为1 500~2 000 U/g时,可能由于多余的纤维素酶没有反应底物,提取率随加酶率增加不再提高。
2.2.4 超声时间对多糖提取率的影响
在加酶量1 500 U/g,酶解温度30℃,酶解时间30 min条件下,研究超声时间20,30,40,50,60 min对多糖提取量的影响。
超声时间对多糖提取率的影响见图5。
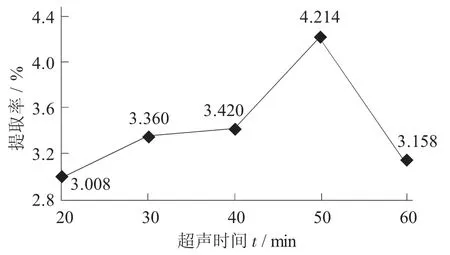
图5 超声时间对多糖提取率的影响
由图5可知,当超声时间为50 min时,多糖得率最高;当超声时间延长,超声波的热效应和机械效应会分解破坏多糖,使多糖提取率降低[9]。
2.3 响应面试验结果
2.3.1 Box-behnken试验设计方案及结果
由单因素试验结果可知,酶解时间为30 min,酶解温度为30℃,加酶量为1 500 U/g,超声时间为50 min时,多糖提取率接近最大值。以这些数值作为中间值,设定合理区域,利用Box-behnken响应面法对提取工艺进行进一步优化。
响应面试验设计水平见表1,Box-Behnken试验设计方案及结果见表2。

表1 响应面试验设计水平
2.3.2 模型回归系数显著性检验结果
由表2可知,此模型与该试验拟合良好,模型的p=0.046 7<0.05,表明此试验模型差异显著,失拟项p=0.289 4>0.05,说明失拟项检验不显著,方程对试验的拟合度较好。
模型回归系数显著性见表3。

表3 模型回归系数显著性
2.3.3 因素相互影响的响应面分析
根据数据模型所得响应曲面可以直观反映因素或因素之间的交互作用对紫苏叶多糖得率影响的强弱,等高线呈椭圆形时因素之间交互作用强,等高线越圆交互作用越弱。响应曲面越陡峭,则表示对提取率的影响越大。
酶解时间(A)与酶解温度(B)对多糖提取率影响的响应面图见图6,酶解时间(A)与加酶量(C)对多糖提取率影响的响应面图见图7,酶解时间(A)与超声时间(D)对多糖提取率影响的响应面图见图8,酶解温度(B)与加酶量(C)对多糖提取率影响的响应面图见图9,酶解温度(B)与超声时间(D)对多糖提取率影响的响应面图见图10,加酶量(C)与超声时间(D)对多糖提取率影响的响应面图见图11。

图6 酶解时间(A)与酶解温度(B)对多糖提取率影响的响应面图
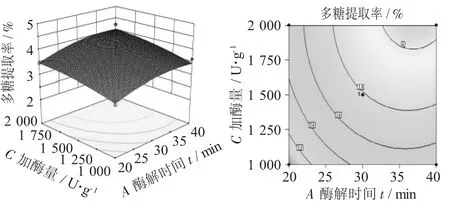
图7 酶解时间(A)与加酶量(C)对多糖提取率影响的响应面图
由图6可知,因素A对多糖提取率的影响略大于因素B,而且因素A与因素B之间的交互影响也大。由图7可知,因素A与因素C对多糖提取率的影响都比较大,且因素C大于因素A,两者交互影响不大。由图8可知,因素D对多糖提取的影响不显著,小于因素A对多糖提取率的影响,因素D与因素A交互影响较大。由图9可知,因素C对多糖提取率的影响大于因素B,且因素C与因素B交互影响小。由图10可知,因素D对多糖提取率的影响小于因素B,且因素D与因素B交互影响小。由图11可知,因素C对多糖提取率的影响大于因素D,且因素C与因素D交互影响大。

图8 酶解时间(A)与超声时间(D)对多糖提取率影响的响应面图

图9 酶解温度(B)与加酶量(C)对多糖提取率影响的响应面图
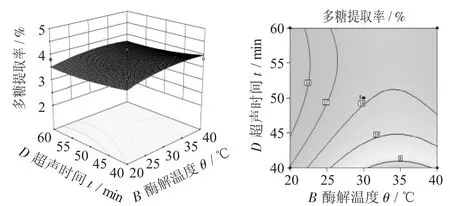
图10 酶解温度(B)与超声时间(D)对多糖提取率影响的响应面图
综合图6~图11可得,各因素对多糖提取率的影响程度为因素C>因素A>因素B>因素D,且因素A与因素B、因素A与因素D、因素C与因素D之间交互影响大。
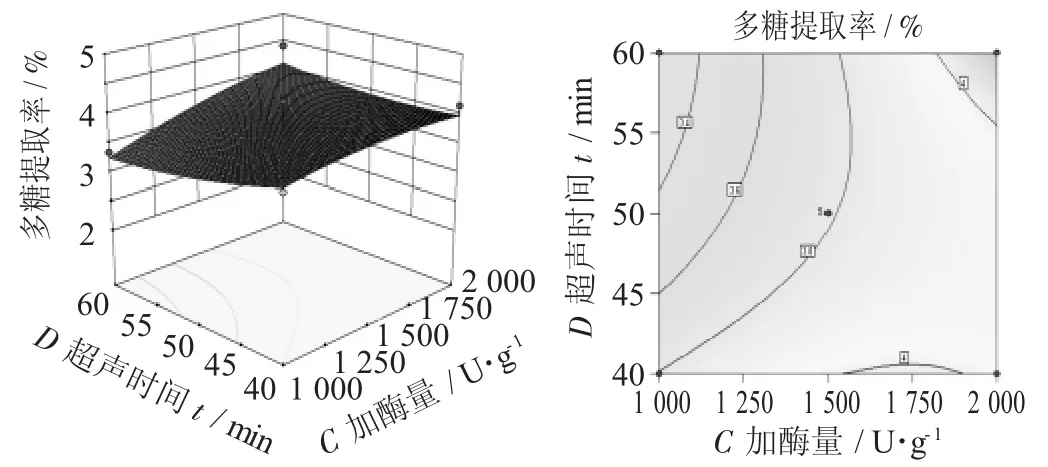
图11 加酶量(C)与超声时间(D)对多糖提取率影响的响应面图
2.3.4 最优值预测及最优工艺验证
经Design Expert软件分析,数学模型最优提取率为4.539%,预测条件为加酶量2 000 U/g,酶解温度20.4℃,酶解时间40 min,超声时间60 min,在此条件下进行3次验证试验。
最优工艺验证试验结果见表4。

表4 最优工艺验证试验结果/%
由试验可得,多糖平均提取率为4.488 2%,实际值与最优工艺预测值偏差为1.12%,表明Design Expert建立的数学模型可以用于优化紫苏叶多糖的提取工艺。因此,由Box-behnken试验设计得到的优化的工艺条件准确可靠。
2.4 紫苏叶多糖抗氧化活性分析
2.4.1 紫苏叶多糖溶液清除DPPH自由基的能力
紫苏叶多糖溶液清除DPPH自由基的能力见图12。

图12 紫苏叶多糖溶液清除DPPH自由基的能力
DPPH自由基能与抗氧化物提供的一个电子配对使其特征紫色消失,可根据其褪色程度来间接评价抗氧化物的抗氧化能力[10]。由图12可知,紫苏叶多糖对DPPH自由基的清除能力随着多糖质量浓度的增加逐渐增大,并呈现明显的量效关系[11],在质量浓度为0.1 mg/mL时,清除率达到94.17%,略低于同质量浓度抗坏血酸溶液的DPPH自由基清除率;当质量浓度高于0.2 mg/mL时,略高于同浓度抗坏血酸溶液的DPPH自由基清除率。
2.4.2 紫苏叶多糖溶液清除羟基自由基的能力
紫苏叶多糖溶液清除羟基自由基的能力见图13。
由图13可知,紫苏叶多糖对羟基自由基有清除作用,当紫苏叶多糖质量浓度为0.1~1.0 mg/mL时,随着质量浓度增加,紫苏叶多糖清除羟基自由基的能力增强;当多糖质量浓度在0.2~1.0 mg/mL时,其对羟基自由基清除率都高于同质量浓度抗坏血酸溶液对羟基自由基的清除率。

图13 紫苏叶多糖溶液清除羟基自由基的能力
3 结论
在单因素试验结果的基础上,运用响应面法对超声波协同纤维素酶提取紫苏叶多糖的条件进行了优化,建立了适当有效的二次多项模型。优化的最佳工艺条件为加酶量2 000 U/g,酶解温度20.4℃,酶解时间40 min,超声时间60 min,在此条件下紫苏叶多糖的提取率为4.539%。对所提取紫苏叶多糖的抗氧化试验显示,随着质量浓度的增加,其清除DPPH自由基和羟自由基的能力逐渐增强,在质量浓度0.1 mg/mL时其DPPH自由基清除率达到94.17%,在质量浓度1.0 mg/mL时羟自由基清除率达到90.06%。超声波法和纤维素酶法结合提取紫苏叶多糖,具有高效、短时、作用条件温和、环保等优点[12]。

