4种植物油室温氧化过程中自由基变化分析
王莉倩,寇宇星,温毓秀,王蒙蒙,杜双奎,于修烛*
(1 西北农林科技大学食品科学与工程学院 陕西杨凌 712100 2 上海交通大学农业与生物学院食品科学与工程系 上海 200240)
植物油容易发生氧化,导致油脂变质。植物油品质劣变的主要原因是自动氧化,其被公认为是一种由自由基引发的链式反应。根据自由基理论,整个氧化过程中伴随着自由基的传递、引发以及含量的变化[1-4]。在自由基链式反应进程中,先生成烷基自由基 (R·),R·与O2反应生成过氧化自由基(ROO·),ROO·传递链反应,形成大量氢过氧化物(ROOH),ROOH 容易发生氧化分解反应形成次级氧化产物(醇、酸、酮和醛等),从而导致油脂酸败变质[5-8]。
电子顺磁共振 (Electron paramagnetic resonance,EPR)是一种可直接测定自由基种类和含量的方法[9-11]。油脂氧化产生的自由基特别活泼,周期性短暂,需通过自旋加合物(自旋捕获剂与自由基反应所生成)来测定,常用的捕获剂有N-叔丁基-α-苯基硝酮(PBN)和5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)[11-13]。目前,EPR 在食品领域主要用于食用油的自由基监测[11-15],以及食品抗氧化能力的评价等[16-18]。Raitio 等[11]通过EPR 方法研究半固态棕榈油早期氧化的特点。结果表明,半固态棕榈油在50 ℃下贮藏7 d 的过程中,产生的自由基与次级氧化产物的形成呈正相关。李培等[13]研究了花生油加速氧化过程的自由基变化,结果表明,加速氧化过程中自由基含量由大到小为R·>RO·>ROO·。Chen 等[14]利用EPR 研究了温度对棕榈酸热氧化的影响。采用烷基和烷氧基自旋加合物模拟试验光谱,发现棕榈酸从175 ℃到180 ℃的氧化速率迅速增加,表明棕榈酸在一定温度下的热氧化是由自由基生成所致。Ottaviani 等[15]采用EPR 方法研究黑孜然籽油、芫荽籽油和小葵籽油中不同组分对自由基的清除能力,评估3 种油脂中不同成分的抗氧化能力。核磁共振氢谱(1H NMR) 能够提供油脂脂肪酸中不同质子氢的化学位移,它利用不同的质子氢与相应的脂肪酸建立起对应关系,可快速、准确测定油脂样品中各质子氢的含量[19-20]。这项技术提供了关于油在热变质过程中产生的许多变化的信息,不仅涉及酰基的降解,而且涉及各种氧化产物的形成和降解。
本文以4 种常见的植物油为研究对象,采用EPR 结合1H NMR 技术研究其在室温氧化过程中产生的自由基种类、总量以及各类自由基的变化情况。同时解析不同植物油中不饱和脂肪酸的1H NMR 在氧化前、后的变化,以期为植物油的自动氧化自由基变化提供参考。
1 材料与方法
1.1 材料与试剂
4 种植物油分别购于国内4 家油脂生产企业,均声称未添加任何抗氧化剂,具体信息如表1所示,主要脂肪酸组成如表2所示。不同油脂的主要脂肪酸组成不同,其中亚麻籽油中主要脂肪酸是亚麻酸;花生油中主要是油酸和亚油酸;葵花籽油中主要是亚油酸;油茶籽油中主要是油酸。

表1 样品信息Table 1 Information of oil samples

表2 4 种植物油主要脂肪酸组成(%)Table 2 Composition of fatty acid in 4 vegetable oils (%)
异辛烷、冰乙酸、碘化钾、硫代硫酸钠、氢氧化钾、四甲基硅烷(TMS)、氘代氯仿(CDCl3)、DMPO(纯度97%)等均为分析纯级,天津科密欧化学试剂有限公司。
1.2 仪器与设备
EMX plus-10/12 电子自旋共振波谱仪,德国布鲁克(Bruker)公司。主要技术参数:磁场强度为磁极距72 mm 时,最大1.45 T;扫场分辨率为128 000 点;微波频率为X-波段,9.2~9.8 GHz;灵敏度为1.5×109自旋数/G;液氮变温为100~700 K;液氦变温为1.8~300 K。
Bruker Avance Ⅲ型核磁共振波谱仪,瑞士布鲁克(Bruker)公司。规格:500 MHz;技术参数:1H分辨率为0.45 Hz。
1.3 试验方法
1.3.1 EPR 分析 准确称量一定的DMPO,采用甲苯溶解,使其终浓度为2.0 mol/L,置于-20 ℃中避光密封保存,待用。
分别取3 mL 的亚麻籽油、葵花籽油、花生油和茶籽油于50 mL 小烧杯中,使其暴露在空气中,在室温下自然氧化,每隔1 d 取200 μL 样品置于核磁管中,加入20 μL 配好的DMPO 溶液,置于EPR 仪器谐振腔内,采用如下检测参数模式进行检测。
EPR 仪器的检测参数:中心磁场为3 350.00 G,扫场宽度为100.00 G,扫场时间为20.0 s,微波功率为3.99 mW,调制幅度为1.000 G,转换时间为10.00 ms,加热温度为373.15 K。然后打开高纯氮气流并开始加热,待谐振腔温度稳定后,将核磁管置于谐振腔中,同时开始计时,每隔24 h 测定1次。
1.3.2 NMR 分析 将亚麻籽油、葵花籽油、花生油和油茶籽油暴露在空气中 (模拟家用存储条件),在室温下自然氧化,取氧化前和氧化10 d 后的样品进行1H NMR 谱测定。分别取20~50 μL 的亚麻籽油、葵花籽油、花生油和茶籽油置于直径5 mm 核磁管,以500 μL 氘代氯仿溶解,溶剂内含0.03%四甲基硅烷作为内标,混合均匀进行检测[21-22]。
通过坝外坡“之”字形斜马道的方式修筑,以原坝体剖面外轮廓线为基准设置“之”字形斜马道,局部调整坝面坡度,同时提高坝体内部碾压系数确保坝体的安全稳定,设置防护栏,调整坡脚的形式。这种建造方法不改变原设计坝体内外坡坡度,既能保证坝体的安全稳定,避免坝外上坝道路因土石方开挖、山体爆破带来的边坡处理等问题,有利于降低施工干扰,控制工程量,减少生态环境破坏[3]。
1H NMR 测定条件参考杨登辉等[19]方法。具体参数为:每次测定都进行调谐和匀场,温度为297.3 K,工作频率为400.13 MHz,采集时间为4.0895 s,光谱宽度为8 012.82 Hz,扫描16 次,空扫2 次。
1.3.3 过氧化值的测定 过氧化值的测定参考GB 5009.227-2016 《食品安全国家标准食品中过氧化值的测定》[23]。
1.4 数据处理与分析
EPR 谱分析:自由基的自旋朗德因子(g 值)为自由基谱图中心点,通过Xenon 软件点击谱图中心点可以直接读出g 值,脂类自由基的g 值都在2.0 附近。然后对样品的自由基谱图进行基线校正,校正后进行二次积分,使用Xenon 软件自带的自旋定量功能,可得到该样品的自旋总数和自由基浓度。通过Xenon 软件中的自旋拟合(Spin fit)功能对样品的试验谱图进行计算机拟合,得到与试验结果相匹配的拟合结果,并以此为根据判定样品中自由基的种类并进行相对定量。
1H NMR 谱图使用Topspin 软件进行处理,以四甲基硅烷内标物的峰作为化学位移零点,谱图处理时以TMS 定位,谱图经校正零点后标峰,并读出峰面积。
所有试验均重复3 次,结果用“平均值±标准差”表示。采用SPSS 20.0 软件进行数据分析,Origin 9.0 软件绘图。
2 结果与分析
2.1 4 种植物油室温氧化过程中过氧化值变化分析
过氧化值表示油脂和脂肪酸等被氧化程度的一种指标,过氧化值越高其酸败就越严重。在自由基链式反应中,一般来说,多不饱和脂肪酸比单不饱和脂肪酸的反应性更强。根据经典的润滑脂理论,亚油酸的自氧化率约为油酸的10 倍,在0 ℃或更低的温度下,亚油酸酯可被空气氧化。4 种植物油室温氧化过程中过氧化值变化结果见图1。

图1 4 种食用油室温氧化中的过氧化值变化情况Fig.1 Peroxide values changes of 4 vegetable oils at room temperature
由图1可知,这4 种植物油按氧化速率排序为:亚麻籽油>花生油>葵花籽油>油茶籽油。从自由基生成的角度来看,虽然亚油酸产生自由基的速度比油酸快,但两者之间的差异小于10 倍。在4 种油中,葵花籽油和茶籽油的过氧化值变化趋势相对较小。在油脂的自动氧化过程中,R·主要存在于自动氧化的链传递阶段,在这一阶段不饱和脂肪酸中双键旁亚甲基上的氢被夺取,形成大量的R·,由此,脂肪酸中的不饱和碳碳双键越多,氧化时生成R·就越多,油脂就越容易氧化。
2.2 4 种植物油室温氧化过程中自由基分析
2.2.1 植物油室温氧化过程中自由基种类分析4 种植物油室温氧化的谱图如图2所示,从上到下依次是试验谱图(Exp)、拟合谱图(Simu)及4 种拟合出的自由基谱图。


图2 4 种植物油室温氧化的EPR 图谱Fig.2 EPR Spectra of four kinds of vegetable oils oxidized at room temperature
如表3所示,根据4 种植物油的超精细耦合分裂常数(αN,αH),确定这些加合物分别是DMPO-X、R·、RO·、ROO·。
由图2和表3可知,4 种植物油在室温氧化过程中除油茶籽油外,其它植物油均产生了4 种自由基。而油茶籽油中只检测到3 种自由基,分别是DMPO-X、RO·、ROO·。油茶籽油中可能含有极少量的R·,由于其含量过低与基线无异,难以拟合。Novakov 等[24]研究了体内测定大鼠肝和肺提取物中的烷基自由基(R·),而未观察到可检测的烷基自由基,这是由它们的低稳态浓度所致[25]。

表3 DMPO 捕获的自由基EPR 参数Table 3 EPR parameters of radical adducts to DMPO
2.2.2 4 种植物油室温氧化过程中自由基含量变化分析 4 种植物油的自旋总数随时间的变化见图3。
由图3a 可以看出,容易氧化的亚麻籽油在第1 天时信号强度是4 种油中最低的,到第5 天时,信号强度降到最低。可能是由于亚麻籽油中最主要的脂肪酸是亚麻酸,相对活跃,引发的自由基在短时间内相互结合转化为氧化产物,导致DMPO捕获到的自由基的量偏少[12]。花生油在第5 天时其信号强度处于最低,这和亚麻籽油比较相似。而葵花籽油和油茶籽油的波动幅度总体处于一个较低的水平。4 种植物油初始信号强度的变化趋势不同,这是由于植物油中的脂肪酸种类和含量不同所致。4 种植物油中自由基含量在贮藏过程中是不断变化和波动的,说明油脂氧化在不断进行[26]。
由图3b 可以看出,亚麻籽油中波动最明显的自由基是DMPO-X,含量最多的也是DMPO-X。在0~6 d 时其自旋总量不同,样品的自旋总量基本保持在较低水平。在6~7 d 时,所有自由基的自旋总量突然急剧增加。这可能是由于DMPO 容易受到O2影响,不断发生反应表现出波动的状态。到第10 天时均略有下降,这可能是由于新形成的自由基可以与稳定的自旋加合物发生反应,从而导致信号强度减弱[27]。而烷氧基在整个氧化过程中都是在一个比较低的范围内波动。由图3c 可以看出,葵花籽油中含量最多的自由基是RO·,而且在氧化第1 天后含量急剧增加,在第2 天时又下降,处于一个不稳定的状态,这可能是由于氧化反应进一步加深,氢过氧化物不断分解所导致[9,28]。其它3 种自由基一直维持在一个较低的水平上。由图3d 可以看出,花生油中自由基按相对含量从高到低排序为DMPO-X>RO·>R·>ROO·。而且在氧化过程中RO·的数量在大幅度波动,在1~2 d急剧上升,在3~4 d 时又呈下降趋势。RO·在第4天之后一直呈现缓慢上升的趋势,表明花生油正处于氢过氧化物二次引发阶段[28]。由图3e 可以看出,油茶籽油中的自由基主要是由R·组成,DMPO-X 的量次之,ROO·的量最少,而且在氧化前期R·的含量非常少以至于无法拟合,这与之前的EPR 图谱相吻合。RO·一直处于动态变化中,可能原因是链式反应中氢过氧化物的分解。仅在氧化第9 天开始出现R·且含量与ROO·相差无几,基本处于同一水平。
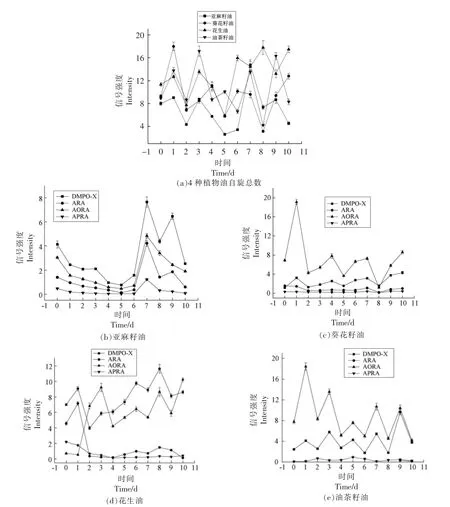
图3 4 种植物油自旋总数随时间的变化Fig.3 Changes of the total amounts of spins of four vegetable oils with time
2.3 4 种植物油室温氧化前、后的1H NMR 分析
核磁共振氢谱1H NMR 是阐明脂质初级和二级氧化产物分子结构最常用的方法,它能提供化合物分子中氢原子的信息,可以分析油脂组成成分,探讨油脂氧化过程中脂肪酸的变化等[29],这对于全面认识氧化过程和氧化机理意义重大。通过在氧化过程中监测脂质分子反应位点的质子峰,1H NMR 可用于评估脂质氧化状态,解析主要1H NMR 谱的化学位移信号的归属信息,见表4[30]。

表4 食用油核磁共振氢谱中各峰的归属Table 4 Signals of the 1H NMR spectra edible oil
2.3.1 亚麻籽油氧化前、后1H NMR 谱 亚麻籽油氧化前、后1H NMR 谱见图4。
亚麻籽油和花生油的NMR 图谱变化趋势基本一致,以亚麻籽油的NMR 图谱为例,如图4所示。光谱在信号B 处是亚麻酸末端-CH3上的H,信号A、C、E 和A、G 分别与油酸、亚油酸含量有关[31]。结果表明,样品的烯丙基质子(E)、二烯丙基质子(G)和烯质子(J)的信号强度都有衰减。据报道,烯烃质子与样品中不饱和酯的含量有关。表明在室温氧化降解过程中不饱和酯含量减少。同时,烯烃脂肪酸链与氧分子反应良好,证实了样品的降解[32]。同时花生油的不饱和脂肪酸(G)的信号积分区域明显低于亚麻籽油的,由此可知,花生油相比于亚麻籽油具有较高的稳定性。在室温氧化10 d后,两种油中并未检测到主要的二级氧化产物醛(δ=9.2~9.9)的特征信号峰,说明氧化正处于初级阶段。

图4 亚麻籽油氧化前(a)和室温氧化10 d 后(b)的1H NMR 谱Fig. 4 1H NMR spectra of linseed oil before oxidation (a) and after 10 d oxidation at room temperature (b)
2.3.2 葵花籽油氧化前、后1H NMR 谱 葵花籽油氧化前、后1H NMR 谱见图5。
葵花籽油和油茶籽油的NMR 图谱变化趋势基本一致,以葵花籽油的NMR 图谱为例,如图5所示。与亚麻籽油和花生油相比,葵花籽油整体信号强度均有降低。可以看出,随着氧化时间延长,亚油基酰基(A 和G)对应的信号强度减弱。因此,在图5可观察到以δ=1.90~2.24 为中心的双烯丙基质子信号强度的下降,这主要是由于亚油基酰基所致[33]。根据María 等[34]的研究表明,亚油基酰基的降解速度略高于油酸的降解速率,PV 值的增长趋势也符合这一规律。同时在油茶籽油中,信号强度在δ=1.5 附近增加,这可能是由于与叔碳结合的氢原子浓度增加所致;后者可在交联反应中产生,在不同的酰基链之间形成碳碳键,导致聚合物的形成[34]。样品的烯丙基质子、二烯丙基质子和烯质子的信号强度变化都很小,说明氧化降解的速率和产量都很低。同样的,在这两种油中也没有检测到氢过氧质子和二级氧化产物的特征信号,氧化处于初级阶段,比较缓慢。

图5 葵花籽油氧化前(a)和室温氧化10 d 后(b)的1H NMR 谱Fig. 5 1H NMR spectra of sunflower seed oil before oxidation (a) and after 10 d oxidation at room temperature (b)
3 结论
亚麻籽油是4 种植物油中最易氧化的,其在室温氧化时主要形成4 种自由基,按含量排序为DMPO-X>RO·>R·>ROO·。花生油的氧化速度仅次于亚麻籽油,且其氧化自由基含量排序与亚麻籽油相似。葵花籽油的氧化速度略慢于花生油,其自由基含量排序为RO·>DMPO-X>R·>ROO·,且在氧化前期主要是烷氧自由基的含量在大幅度波动,其它3 种自由基一直维持在一个较低的水平。油茶籽油稳定性最高,其氧化自由基组成类似葵花籽油,主要是RO·,DMPO-X 次之,ROO·的量最少,且在氧化前期R·的量少以至于无法拟合。总得来说,通过1H NMR 对4 种植物油的室温氧化自由基进行分析,得出氧化前、后氢质子化学位移信号并没有发生变化,而氧化前、后各特征峰的峰面积所占比例均有不同程度的变化。这与自由基链式反应的引发、传递阶段变化情况一致。并且通过EMR 和1H NMR 分析,发现自由基种类和含量与脂肪酸组成相关,且自由基增长速度差别较大,与油脂的脂肪酸组成特征相吻合。在后续研究中,还需要结合自由基链式反应的不同阶段,探究自由基变化与氧化产物的关系。

