QuEChERS/气相色谱-串联质谱-内标前置法测定茶叶中37种农药残留
黄 微,马玉凤,孟怡璠,李崇勇*,李春梅,李 婷,王俣心,丁 伟
(1.陕西省茶叶产品质量监督检验中心 汉中市食品药品监督检验检测中心,陕西 汉中 723000;2.城固县食品药品检验检测中心,陕西 汉中 723200)
我国是茶叶主要生产国,也是茶文化的起源国。茶叶因具有独特的风味和保健功能而深受大众喜爱[1]。影响茶叶质量安全的指标主要有农药、真菌毒素、重金属残留等[2],其中农药残留是最被人们关注的指标之一。茶叶产生农残的原因一方面在于农药的不规范使用,如茶园使用违禁农药、超量喷洒农药、忽视施药安全间隔期等;另一方面在于茶叶种植过程受到外界污染,如土壤、大气、水体中残存的农药向茶叶转移[3]。过高的农药残留严重影响茶叶的质量安全,世界多国对茶叶中农药的最大残留限量(MRL)均做了严格规定。我国2021 年发布的GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》标准[4]中涉及茶叶农药残留的指标有106 项,较2019 版增加了41 项,且降低了部分农药的MRL 数值。限量标准不断从严,体现出我国对茶叶质量安全日益严格的要求。
茶叶中农药残留的检测方法主要有气相色谱法(GC)[5]、气相色谱-质谱法(GC-MS)[6]、气相色谱-串联质谱法(GC-MS/MS)[7]、液相色谱法(LC)[8]、液相色谱-质谱法(LC-MS)[9]、液相色谱-串联质谱法(LC-MS/MS)[10]等。由于茶叶成分复杂,基质对目标组分干扰严重,采用GC、LC 可能导致假阳性。GC-MS、LC-MS 虽能准确定性和定量,但与三重四极杆串联质谱相比,其抗干扰能力和灵敏度不够理想。GC-MS/MS和LC-MS/MS具有抗干扰能力强、灵敏度高、准确度高等特点,近年来被普遍应用于茶叶中农残的检测[11]。
常用的茶叶前处理方法主要有振荡提取[6,12]、涡旋提取[9]、超声提取[5,7-8]、加速溶剂萃取[10,13]、固相萃取[10,13]、分散固相萃取[6-7]、固相微萃取[14]、凝胶渗透色谱[7,15]等。QuEChERS法是在分散固相萃取技术基础上发展的一种新型前处理方法,具有快速简单、经济高效、可靠安全等优点,在茶叶农残检测 领 域 得 到 广 泛 应 用[5,8,16-17]。国 家 标 准GB 23200.113-2018[12]、GB 23200.121-2021[18]均 以QuEChERS 法作为前处理方法。为降低分析方法的误差,用QuEChERS 法进行前处理时常采用内标法进行定量。内标法可分为内标前置和内标后置两种方式,内标前置即在样品前处理前加入内标(ISTD),内标后置即在样品前处理后加入内标。传统的内标法选择与目标化合物性质相近的化合物作为内标,一般采用内标后置方式(如GB 23200.113-2018[12]),能够校正信号变化和仪器不稳定性带来的误差,但无法补偿前处理过程造成的待测物损失。同位素内标法选择经同位素标记的化合物作为内标,一般采用内标前置方式[19],能够较好地消除前处理过程和仪器不稳定性带来的误差,但由于同位素内标物价格昂贵且不易获得,其在茶叶中农药多残留检测中的应用受限。本文拟采用QuEChERS 结合GC-MS/MS 对茶叶中具有代表性的37 种农药残留进行检测(包括14 种有机磷类、10 种有机氯类、8 种拟除虫菊酯类和5 种有机杂环类),以内标前置法加入环氧七氯内标并进行定量,以校正前处理过程中的目标物损失以及仪器测定过程产生的误差,从而建立一种操作简单、快速高效、回收率高、成本低的茶叶中农药残留检测方法。
1 实验部分
1.1 仪器、试剂与材料
GCMS-TQ8040 气相色谱-三重四极杆质谱仪、SH-RXi-5Sil MS 石英毛细管色谱柱(日本Shimadzu公司);IKA VORTEX2涡旋混匀器(德国IKA公司);MFV-24智能氮吹仪(广州得泰仪器科技有限公司);Milli-Q超纯水仪(美国Millipore公司);MS1003S电子天平(瑞士Mettler Toledo公司)。
37种农药标准品和内标环氧七氯(农业部环境保护科研监测所,质量浓度均为100 mg/L);乙腈(色谱纯,美国Sigma-Aldrich公司);乙酸乙酯(色谱纯,美国Mreda公司);正己烷、丙酮(色谱纯,美国Fisher Scientific 公司);QuEChERS 萃取盐包(含6 g 硫酸镁、1.5 g 乙酸钠)、QuEChERS 萃取净化管(含1200 mg硫酸镁、400 mg PSA、400 mg C18、400 mg GCB)(月旭科技(上海)股份有限公司);绿茶、红茶为日常送检样品,白茶、黑茶购于本地超市。
1.2 实验方法
1.2.1 标准溶液的配制混合标准工作溶液:分别移取37 种农药标准品(100 mg/L)各1 mL 于50 mL容量瓶中,用乙酸乙酯定容至刻度,配制成2 mg/L 的混合标准溶液。取适量混合标准溶液用乙酸乙酯逐级配制成质量浓度分别为0.2、1、2、10、20、100、200、400、800µg/L的系列混合标准工作溶液。
内标溶液:取1 mL 环氧七氯(100 mg/L)于20 mL容量瓶中,用乙酸乙酯定容至刻度,配制成5 mg/L的内标溶液。
基质混合标准工作溶液:将空白基质溶液氮气吹干,加入20µL 内标溶液,以1 mL 混合标准工作溶液复溶,过0.22µm有机相微孔滤膜,得到相应质量浓度的基质混合标准工作溶液。
1.2.2 QuEChERS 前处理内标前置法:准确称取2 g(精确至0.001 g)粉碎均匀的茶叶样品置于50 mL 塑料离心管中,加入200 µL 内标溶液和10 mL 水混匀,浸泡30 min。加入20 mL 乙腈,涡旋1 min,超声提取20 min,加入QuEChERS 萃取盐包(含6 g 硫酸镁、1.5 g 乙酸钠),涡旋1 min,5000 r/min 离心5 min。吸取10 mL 上清液加至15 mL 塑料QuEChERS 萃取净化管中(含有1200 mg硫酸镁、400 mg PSA、400 mg C18、400 mg GCB),涡旋1 min,5000 r/min 离心5 min。吸取2 mL净化液于10 mL 塑料试管中,40 ℃氮吹至近干,加入1 mL 乙酸乙酯复溶,过0.22 µm 有机滤膜,待检测。
内标后置法:除以下操作外,其余步骤均与内标前置法相同:①茶叶样品置于50 mL 塑料离心管后,不加入200µL内标溶液;②净化液氮气吹至近干后,先加入20µL内标溶液,再加入1 mL乙酸乙酯复溶。
1.2.3 仪器条件气相色谱条件:色谱柱为SH-RXi-5Sil MS(30 m×0.25 mm×0.25µm);进样口温度:250 ℃;升温程序:50 ℃保持1 min,以25 ℃/min 升至125 ℃,再以10 ℃/min 升至300 ℃,保持10 min;进样方式:不分流进样;柱流量:1.5 mL/min;载气:氦气(纯度大于99.999%);进样量:1µL。
质谱条件:电子轰击离子源(EI);离子源电压:70 eV;离子源温度:200 ℃;接口温度:250 ℃;溶剂延迟时间:4 min;碰撞气:氩气(纯度大于99.999%);扫描方式:多反应离子监测模式(MRM)。
2 结果与讨论
2.1 GC-MS/MS条件优化
将400µg/L 的37种农药混合标准工作溶液进行单四极杆质谱全扫描,利用谱库检索间接确定各农药的保留时间,通过优化柱箱升温程序,37 种农药可在22.31 min 内得到有效分离。再通过Smart Database MRM 优化工具确定各农药的碎片离子信息和碰撞能量,具体参数见表1。在优化的质谱条件下,37种农药在绿茶空白基质匹配标准溶液(400µg/L)中的总离子流色谱图如图1所示。
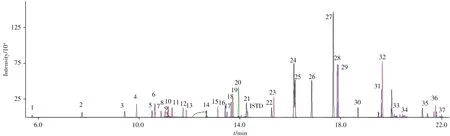
图1 37种农药在绿茶空白基质匹配标准溶液(400µg/L)中的总离子流色谱图Fig.1 Total ion chromatogram of green tea blank matrix-matched standard solution(400µg/L)of the 37 pesticides
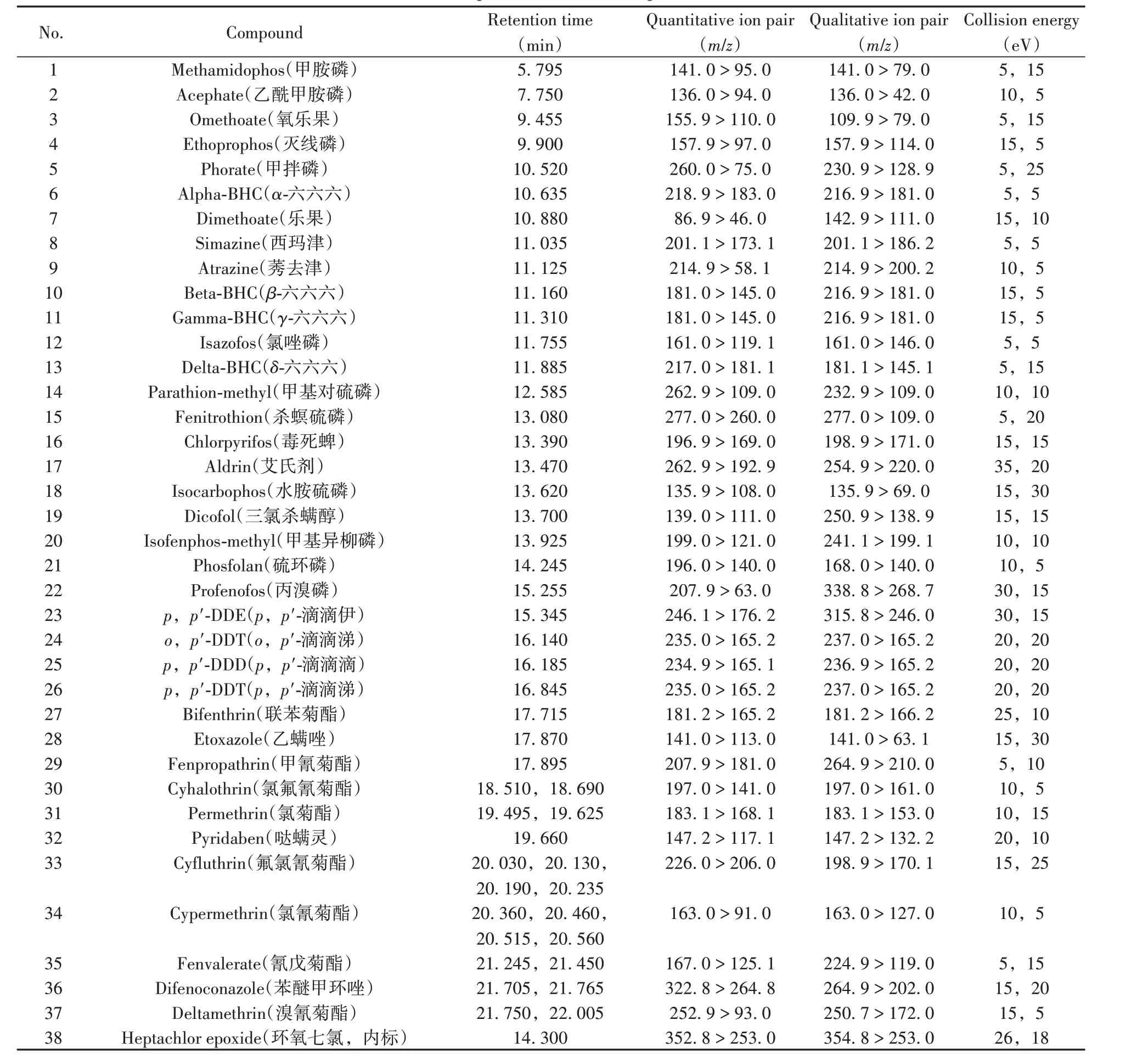
表1 37种农药及内标的保留时间和质谱参数Table 1 Retention times and MS parameters of the 37 pesticides and internal standard
2.2 提取溶剂的选择
茶叶中农药残留检测的常用提取溶剂有乙腈、丙酮、乙酸乙酯、正己烷等。为确定最优的提取溶剂,分别采用乙腈、乙酸乙酯、丙酮、丙酮-正己烷(1∶1,体积比)、正己烷5 种溶剂按照“1.2.2”内标前置法进行绿茶空白基质加标回收实验,37 种农药的加标水平为0.1 mg/kg,所有加标样品均静置24 h以上。结果表明,不同提取溶剂得到的提取液颜色由深至浅分别为丙酮>丙酮-正己烷(1∶1)>乙腈>乙酸乙酯>正己烷,且用丙酮、丙酮-正己烷(1∶1)两种溶剂提取净化,氮吹后得到的残渣较多。根据GB/T 27404-2008[20]的要求,当待测农药含量为0.1 mg/kg 时,回收率应在80%~110%范围内。通过比较不同溶剂提取后的回收率分布情况(见图2)可知,使用不同提取溶剂时,平均加标回收率在80%~110%范围内的农药数量均不相同,由高到低分别为乙腈(33种)>乙酸乙酯(27种)>丙酮(21种)>丙酮-正己烷(1∶1)>(20种)>正己烷(3种)。综上所述,本文最终选择乙腈作为提取溶剂。
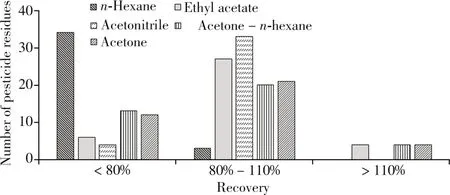
图2 不同溶剂提取后37种农药的回收率分布(绿茶基质)Fig.2 Recovery distribution of the 37 pesticides in green tea by different extraction solvents
2.3 加水量的确定
茶叶的含水量较低,前处理过程若加入一定量的水进行浸泡,可以增加茶叶细胞的通透性,从而提高农残的析出。然而,茶叶用水浸泡后,水溶性杂质也随之溶出并转移到提取液中,增加净化难度。加水量越多,水溶性杂质的含量越高,提取液颜色越深,净化难度越大。通过空白基质加标回收实验(加标水平为0.1 mg/kg),分别比较了添加0(即不添加水)、5、10、15 mL水时对37种农药回收率的影响。结果显示,不加水浸泡,大部分农药无法被有效提取,有33种农药的平均回收率在80%以下。加水浸泡后,这一情况得到显著改善。与添加5、15 mL水相比,添加10 mL水时,有32种农药的平均回收率在80%~110%范围内,均高于两者。因此,实验选择加水量为10 mL。
2.4 内标前置法与内标后置法的比较
内标法是质谱分析中常见的定量方法,通过添加内标可以校准前处理和仪器检测过程的偏差。为比较内标的不同放置方式对回收率的影响,按照“1.2.2”分别用内标前置法和内标后置法对绿茶空白基质进行加标回收实验,37 种农药的加标水平为0.1 mg/kg,结果见图3。由图可知,采用内标前置法,平均回收率在80%~110%之间的农药有34种,高于内标后置法(30 种)。另外,平均回收率为80%~110%的大部分农药,采用内标前置法的回收率与100%的绝对差值低于内标后置法。如乙酰甲胺磷、乙螨唑和毒死蜱,用内标前置法时三者的平均回收率分别为91.4%、93.1%和101%,而用内标后置法的平均回收率分别为83.7%、83.8%和89.7%。其原因可能在于,内标后置法是在前处理结束后上机前加入内标,因QuEChERS 方法中无水硫酸镁与水放热导致离心管的温度升高,可能会使农药降解损失,且前处理过程中提取、转移、氮吹等步骤也可能导致农药损失,这些损失无法用内标后置法进行补偿。而内标前置法的内标物是在前处理前加入样品中,整个前处理和仪器分析过程均伴随待测目标物,可以更好地校正前处理和仪器带来的误差,使农药的回收率相对稳定,提高了方法的准确度。

图3 采用内标前置法和内标后置法时37种农药的回收率分布(绿茶基质)Fig.3 Recovery distribution of the 37 pesticides in green tea by adding ISTD before pre-treatment and after pre-treatment
2.5 基质效应
茶叶成分复杂,在质谱分析过程中可能产生基质效应(ME),导致目标化合物在仪器上的响应增强或减弱,不利于农残分析。其计算公式为:ME=B/A×100%,其中,A为纯溶剂标准溶液中农药的响应值,B为空白基质标准溶液中相同含量农药的响应值。ME 低于80%为强基质抑制效应,ME 在80%~100%之间为弱基质抑制效应,ME 在100%~120%之间为弱基质增强效应,高于120%则为强基质增强效应[21]。本文分别用绿茶、红茶、白茶、黑茶空白基质和乙酸乙酯配制质量浓度为200µg/L 的37种农药混合标准溶液,上机测试。结果表明,4 种茶叶均以基质增强效应为主,ME 高于120%的农药数量在4种茶叶中占比均最高,ME低于80%的农药数量在4种茶叶中均为0。本实验采用基质匹配标准曲线进行定量,以消除基质效应的影响。通过比较发现,基质溶液中目标化合物的色谱峰形较好,无拖尾现象,而纯溶剂中部分目标化合物(如甲胺磷、乙酰甲胺磷、氧乐果等)的色谱峰形较宽,有明显拖尾(图4)。这可能是因为茶叶的基质组分限制了GC 进样口和色谱柱中产生的活性位点,从而改善了农药在纯溶剂中的峰拖尾情况[22]。

图4 纯溶剂标准溶液(A)和绿茶基质标准溶液(B)中甲胺磷(400µg/L)的色谱图Fig.4 Chromatograms of methamidophos(400µg/L)in solvent standard(A)and green tea matrix-matched standard(B)
2.6 线性范围、检出限与定量下限
按照“1.2.1”分别用绿茶、红茶、白茶、黑茶空白基质配制质量浓度为0.2、1、2、10、20、100、200、400、800 µg/L 的系列空白基质混合标准工作溶液,以各农药与内标的峰面积之比为纵坐标,各农药与内标的质量浓度之比为横坐标绘制标准曲线。结果表明,在相应的质量浓度范围内,37种农药在4种茶叶基质中的相关系数(r2)均大于0.99,呈现出良好的线性关系。以信噪比为3(S/N=3)确定方法检出限(LOD),以S/N=10确定方法定量下限(LOQ)。结果显示,37种农药在绿茶基质中的检出限为0.3~15.7µg/kg,定量下限为1.0~52.2µg/kg;在红茶基质中的检出限为0.2~15.5µg/kg,定量下限为0.7~51.8µg/kg;在白茶基质中的检出限为0.2~14.5µg/kg,定量下限为0.8~48.4µg/kg;在黑茶基质中的检出限为0.3~15.3µg/kg,定量下限为0.9~51.1µg/kg。除了乙酰甲胺磷、哒螨灵的定量下限与GB 23200.113标准方法相近外,其余农药的定量下限均低于标准方法的定量下限(为10~50µg/kg[12]),显示出较好的灵敏度。结果亦表明,同一种农药在不同茶叶基质中的检出限、定量下限数值较为接近。表2为37种农药在绿茶基质中的线性关系、检出限与定量下限。

表2 绿茶中37种农药的线性范围、相关系数(r2)、检出限(LOD)、定量下限(LOQ)、加标回收率和相对标准偏差Table 2 Linear ranges,correlation coefficients(r2),limits of detection(LODs),limits of quantitation(LOQs),spiked recoveries and RSDs of the 37 pesticides in green tea
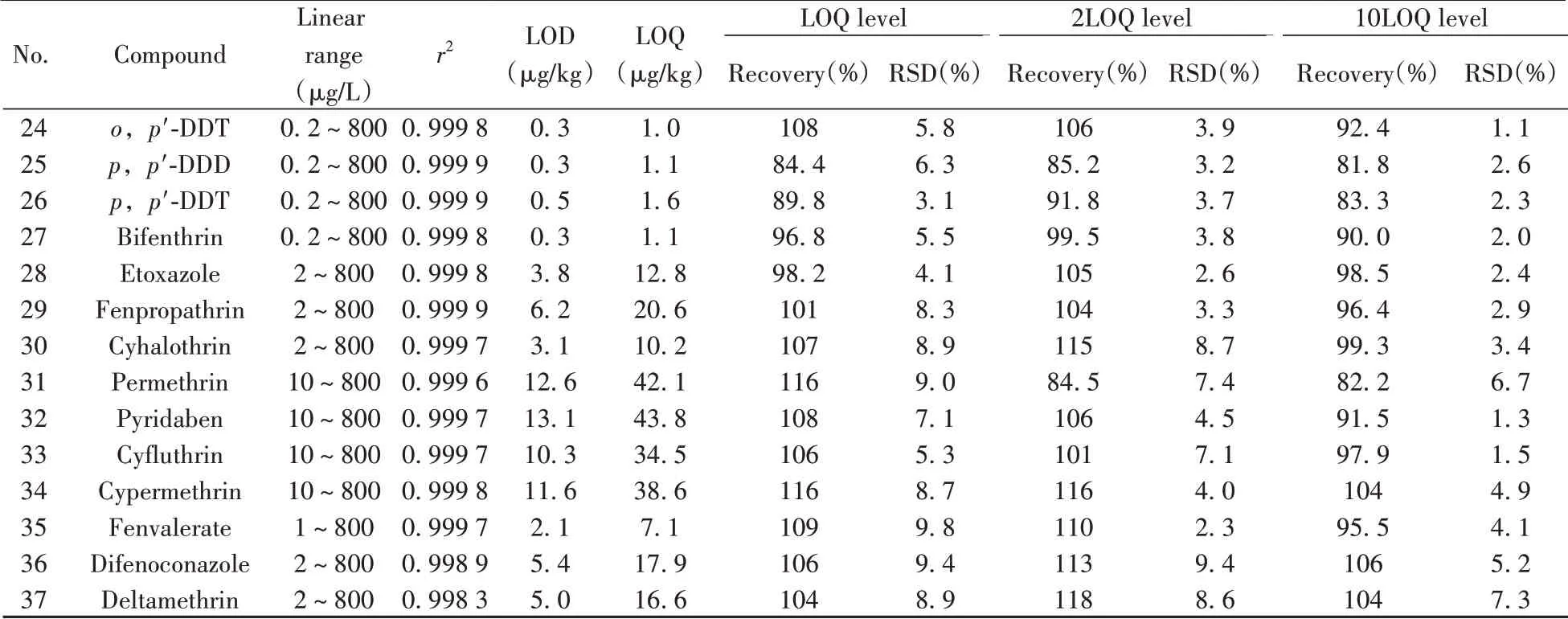
(续表2)
2.7 回收率与相对标准偏差
对空白绿茶、红茶、白茶和黑茶样品进行37 种农药的加标回收实验,加标水平为LOQ、2LOQ 和10LOQ,每个水平重复6 次。结果显示,在不同茶叶以及不同加标水平下,37 种农药的回收率为70.2%~120%,相对标准偏差(RSD)为1.1%~11%,符合GB/T 27404-2008[20]的要求,表明方法的准确度和精密度均能达到满意结果。表2为37种农药在绿茶基质中的回收率与相对标准偏差。
2.8 与文献方法的比较
将本文建立的方法与文献报道[23-28]的茶叶农残检测方法进行比较,结果见表3。本文采用的QuEChERS 前处理方法有机溶剂用量较少,环境友好,操作简单,耗时短;运用内标前置方式结合GC-MS/MS 检测,方法的灵敏度高、回收率好、精密度高。文献[28]方法与本方法相似,利用QuEChERS和GC-MS/MS检测茶叶中31种农药残留,但采用内标后置法,其检出限高于本方法,且回收率不理想。
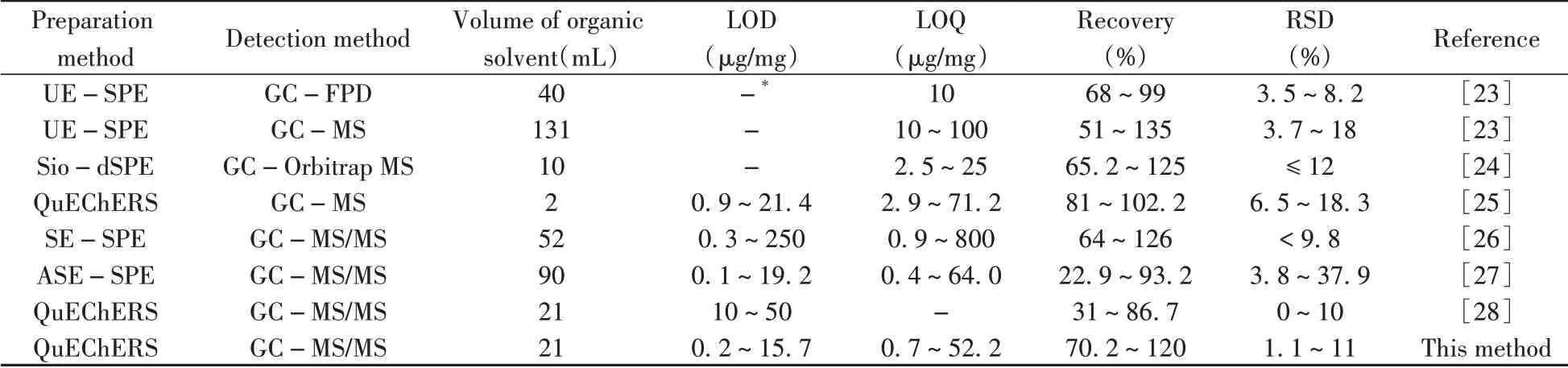
表3 本方法与文献方法的比较Table 3 Comparison of this method with other methods from references
2.9 实际样品的测定
利用本方法对2021年下半年至2022年一季度送检的27份绿茶(主要为汉中仙毫、汉中毛尖、汉中炒青等汉中本地茶叶)、11 份红茶以及市售的8 份白茶、10 份黑茶进行37 种农药残留的检测。结果显示,在56份茶叶中,有11份检出农药残留,检出率为19.6%。共检出9种农药,检出频次由高到低分别为氯氟氰菊酯(6次)、联苯菊酯(6次)、毒死蜱(6次)、氯氰菊酯(4次)、甲氰菊酯(4次)、氧乐果(4次)、乐果(2 次)、苯醚甲环唑(2 次)、氰戊菊酯(1 次)。以上检出农药的含量均未超过GB 2763-2021 规定的最大残留限量值。
3 结论
本文利用QuEChERS 前处理技术,采用内标前置方式,建立了茶叶中37种农药残留的气相色谱-串联质谱检测方法。通过优化提取条件和内标加入方式,以及采用基质匹配标准曲线定量,解决了前处理过程因目标物损失导致的回收率不高的问题,降低了基质干扰,提高了结果的准确性和稳定性。本方法具有操作简单、准确高效、成本较低等优点,满足日常检测要求,为大批量茶叶农药残留检测提供了新的途径。

