血清过氧化氢酶活度臧红T 荧光猝灭检测方法的建立及优化
张爱菊,白莹,薛林科,戴兴德,张小林,董娜
甘肃医学院药学系,甘肃 平凉 744000
过氧化氢酶(catalase,CAT)广泛存在于人体内[1-4],CAT 活度是与抗肿瘤及抗衰老密切相关的酶学指标,已纳入临床常规检测。CAT 活度测定方法有紫外-可见光度法、滴定法等[5-7],近年研发的显色光度法和褪色光度法备受关注[8-12],其中显色光度法的显色剂溶液需现用现配,难以满足临床快速检验要求;褪色光度法的准确度相对较低。因此,亟需研发一种高效、快速、实用的新方法。
荧光检测法具有背景信号小、灵敏度及准确度高等优点,已应用于活度分析[13-14]。基于Fenton 试剂(H2O2/Fe2+)作用下的荧光试剂臧红 T(safranine T,ST)在 575 nm 发射波长处有最大荧光峰[15-19],本研究利用CAT 对H2O2氧化ST 反应具有抑制作用的原理,建立测定CAT 活度的荧光猝灭法,该方法分为酶促反应和荧光猝灭反应2个阶段,并对方法中的酶促反应和荧光猝灭反应条件进行优化,以期将建立的方法应用于CAT 活度的临床快速检测。
1 材料与方法
1.1 血清 人血清样品(共6 份,编号1 ~6,性别分别为男、女、男、女、男、女,年龄分别为 8、8、38、38、69、69岁)由甘肃医学院附属医院体检中心提供。
1.2 主要试剂及仪器 30%的双氧水(分析纯)购自国药集团化学试剂有限公司;CAT 固体(生物试剂,标示量 ≥ 3 000 U / mg)购自如吉生物科技发展有限公司;ST 固体(生物试剂)购自天津市大茂化学试剂厂;FeSO·47 H2O 固体(分析纯)购自福晨化学试剂有限公司;930N 荧光分光光度计购自上海精密科学仪器有限公司。
1.3 溶液配制 H2O2底液:用蒸馏水将0.50 mL 30%的双氧水稀释至250 mL,高锰酸钾法测定其浓度,根据测定值稀释至 1 mmol / L(即 1 μmol / mL);CAT 标准溶液:称取CAT 固体5 mg,蒸馏水定容至100 mL,高锰酸钾法测定其活度,根据测定结果稀释为 1 U / mL;ST 溶液:称取 0.701 6 g ST 固体,蒸馏水定容至 1 000 mL,即浓度为 2 mmol / L;Fe2+溶液:称取0.695 0 g FeSO·47 H2O 固体,用蒸馏水溶定容至250 mL,即浓度为 0.01 mol / L。
1.4 方法的建立 取人体血清25 ~100 μL,置50 mL容量瓶中,加入H2O2底液,30 ℃恒温反应;立即加入催化剂和ST,室温反应后定容。以ST 空白作参比,在1 cm 吸收池中测定575 nm 发射波长处荧光强度F,同步测定酶空白体系F(0在H2O2之前加入Fe2+完成酶失活,其他方法同上),CAT 活度E 由△F(F - F0)、标准曲线方程、样品稀释倍数计算确定。用 μmol / mL(U / mL)表示酶活度,即 1 mL 酶液所能分解过氧化氢物质的量(μmol)。
1.5 荧光猝灭反应条件优化
1.5.1 催化剂的确定 取4个50 mL 容量瓶,分别加入 ST、H2O2+ST、H2O2+ST+Fe3+、H2O2+ST+Fe2+,其中 ST 为 3.00 mL,H2O2为 1.00 mL,Fe3+和 Fe2+均为0.80 mL,室温反应15 min,蒸馏水定容,按1.4项方法测定F。
1.5.2 催化剂用量的确定 取7个50 mL 容量瓶,均加入1.00 mL H2O2及3.00 mL 的ST,再分别加入0.00 ~ 1.20 mL 的 Fe2+溶液,室温反应 15 min,蒸馏水定容,按1.4 项方法测定F。
1.5.3 ST 用量的确定 取7个50 mL 容量瓶,分别加入0 ~6 mL 的ST,蒸馏水定容,按1.4 项方法测定F。
1.5.4 硫酸用量的确定 取6个50 mL 容量瓶,均加入 1.00 mL H2O2、0.80 mL Fe2+和 3.00 mL ST,分别加入0 ~1 mL 的硫酸,室温反应15 min,蒸馏水定容,按1.4 项方法测定F。同时设ST 对照(仅加ST,不加 H2O2和 Fe2+)。
1.5.5 荧光猝灭时间的确定 取12个50 mL 容量瓶,均加入 1.00 mL H2O2、0.80 mL Fe2+和 3.00 mL ST,于室温分别反应 0、2.5、5.0、7.5、10.0、12.5、15.0、20.0、30.0、40.0、50.0、60.0 min,蒸馏水定容,按1.4 项方法测定F。
1.6 酶促反应条件的优化
1.6.1 反应底物H2O2用量的确定 取11个50 mL容量瓶,分别加入 0.00、0.25、0.05、0.75、1.00、1.25、1.50、1.75、2.00、2.50、3.00 mL 的 H2O2,再加入0.80 mL Fe2+和 3.00 mL ST,室温反应 15 min,蒸馏水定容,按1.4 项方法测定F。
1.6.2 酶促反应时间的确定 取7个50 mL 容量瓶,均加入1.00 mL CAT 标准溶液及1.00 mL 的H2O2底液,室温分别反应0 ~30 min,蒸馏水定容,按1.4 项方法测定△F。
1.7 方法的验证
1.7.1 标准曲线的建立 取CAT 标准溶液0、125、250、375、500、750、1 000 μL,按 1.4 项方法测定 F,计算△F 和 CAT 活度,以 CAT 活度(U / mL)为横坐标,△F 为纵坐标,绘制标准曲线;平行测定酶空白10次,计算标准偏差,标准曲线斜率除以3 倍的标准偏差获得检测限。
1.7.2 干扰试验 取1.00 mL CAT 标准溶液,置50 mL容量瓶,按1.4 项方法检测酶活度;另取1.00 mL CAT标准溶液,加入浓度小于H2O2底液1 / 2 的共存还原性物质(1 mmol / L Vc、葡萄糖、果糖、乳糖、半乳糖各0.5 mL),按1.4 项方法检测酶活度。
1.7.3 准确性 取编号1 ~3 的人血清样品,分别加入终浓度 5.0 U / mL 的 CAT 标准溶液;取编号 4 ~ 6的人血清样品,分别加入终浓度10.0 U / mL 的CAT标准溶液。按建立的方法检测CAT 活度,每份样品检测6次,并按下式计算回收率。
回收率(%)=(加标样品检测值-未加标样品检测值)/加标样品检测值× 100%
2 结 果
2.1 荧光猝灭条件的优化
2.1.1 最佳催化剂 在ST 基础上单纯加入H2O2,反应不明显,荧光强度下降幅度仅为5%;Fe3+对H2O2氧化ST 无催化作用,荧光强度保持不变;加入Fe2+后,ST 荧光猝灭,猝灭率达70%。见图1。表明Fe2+可有效降低H2O2的分解活化能,产生更具氧化功能的羟自由基。因此选择Fe2+作为催化剂。

图1 催化剂的优化结果Fig.1 Optimization of catalyzer
2.1.2 最佳Fe2+用量 Fe2+溶液体积为0.00 mL时,ST 与 H2O2几乎不反应;Fe2+溶液体积在 0.10 ~0.80 mL 范围内时,荧光猝灭反应程度直接取决于Fe2+用量;Fe2+溶液体积 > 0.80 mL 时,高浓度 Fe2+将促使H2O2分解,荧光猝灭反应受抑制。见图2。因此,确定催化剂Fe2+的最佳用量为0.80 mL。

图2 Fe2+用量的优化结果Fig.2 Optimization of dosage of Fe2+
2.1.3 最佳ST 用量 随着ST 体积的增加,F 逐渐升高,2 mmol / L ST 溶液在 0.00 ~ 3.00 mL 范围内与荧光强度呈线性关系,见图3。因此确定ST 最佳体积为为3.00 mL。
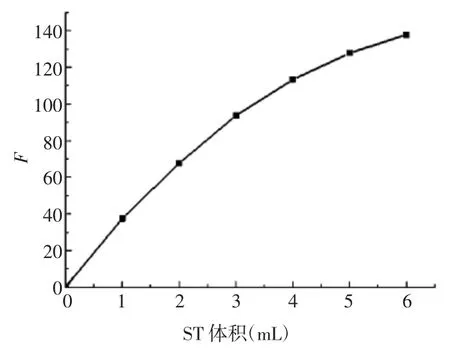
图3 ST 用量的优化结果Fig.3 Optimization of dosage of ST
2.1.4 最佳硫酸用量 随着硫酸加入体积的增大,高酸度使ST 质子化效应增强,荧光强度减弱;ST 猝灭反应体系受H2SO4影响较小,荧光强度基本保持恒定。即H2SO4取0.00 mL 时,ST 对照溶液的pH为4.82,ST 猝灭反应体系的pH 为4.11,相对荧光强度变化量达最大。见图4。因此,确定荧光猝灭反应不需加入硫酸(pH 范围为4.11 ~4.82)。

图4 硫酸用量的优化结果Fig.4 Optimization of dosage of sulfuric acid
2.1.5 最佳荧光猝灭时间 随着荧光猝灭时间的延长,F 快速下降。猝灭时间在2.5 ~10 min 内,与F 呈线性关系,15 min 后F 降至最低并趋于恒定,60 min 内F 保持不变。见图5。因此,确定最佳猝灭时间为15 min。

图5 荧光猝灭反应时间的优化结果Fig.5 Optimization of time for fluorescence quenching
2.2 酶促反应条件优化
2.2.1 反应底物H2O2的最佳用量 随着H2O2加入量的增加,F 逐渐降低。H2O2加入量在0.00 ~1.00 mL 范围内时,其体积与F 呈良好的线性关系;H2O2加入量>1.50 mL 时,荧光猝灭程度降低。见图6。因此,确定H2O2溶液的最佳用量为1.00 mL。

图6 底液H2O2 用量的优化结果Fig.6 Optimization of consumption of H2O2
2.2.2 最佳酶促反应时间 酶促时间在0 ~5 min内与△F 成线性;延长至10 min 后,△F 趋于恒定。见图7。因此确定酶促反应时间为10 min。

图7 酶促反应时间的优化结果Fig.7 Optimization of time for enzymatic reaction
2.3 方法的验证
2.3.1 线性范围 CAT 活度的标准曲线见图8。CAT 活度在 5 × 10-5~ 0.02 U / mL 范围内,与△F 呈良好的线性关系,线性方程为y=180 7 x + 0.752 7,r = 0.998 0,检测限为 3.81 × 10-5U / mL。

图8 CAT 活度的标准曲线Fig.8 Standard curve for determination of catalase activity
2.3.2 干扰试验 未加干扰物质时,CAT 活度为0.02 U / mL;当反应液中存在 1 × 10-5mol / L 的 Vc、葡萄糖、果糖、乳糖、半乳糖时,CAT 活度分别为0.020 5、0.020 2、0.020 6、0.020 1、0.020 3 U /mL,测定误差<5%。
2.3.3 准确性 6 份血清加标样品的检测值在40.7 ~ 69.7 U / mL 范围内,加标回收率为 98.0% ~102.0%,均在95% ~105%范围内,见表1。表明该方法具有良好的准确性。

表1 准确性验证结果Tab.1 Verification for accuracy
3 讨 论
ST 是一种水溶性偶氮染料,带黄红色荧光,具有一定的还原性。H2O2具有一定的氧化能力,在Fe2+的作用下,形成更具氧化性的羟基自由基,使ST 荧光猝灭,猝灭程度取决于H2O2的含量;CAT 是H2O2的专用分解酶,CAT 使荧光猝灭受抑制,因此加CAT 前后荧光变化可表明CAT 活度。
本研究建立了血清CAT 活度的ST 荧光猝灭检测法,并对ST 荧光猝灭反应和酶促反应条件进行了优化,结果表明,最佳催化剂为Fe2+,用量为0.80 mL;ST 用量为 3.00 mL;荧光猝灭反应 pH 范围为4.11 ~4.82,不需加入硫酸;猝灭时间为15 min;H2O2溶液用量为1.00 mL;酶促反应时间为10 min。两个反应环境适应性强,反应快速,测定过程更为简化。同时,对建立的方法进行了验证,结果表明,CAT活度在 5 × 10-5~ 0.02 U / mL 范围内,与△F 呈良好的线性关系,线性方程为y = 180 7 x + 0.752 7,r = 0.998 0,检测限为 3.81 × 10-5U / mL;检测体系液中存在 1 × 10-5mol / L 的 Vc、葡萄糖、果糖、乳糖、半乳糖时测定误差为<5%,由于人体血清样品每次取样约50 μL,即样品中上述干扰物的浓度控制在10 mmol / L 以内时,不影响酶活度测定;6 份血清加标样品的回收率均在95% ~105%范围内,与文献[20]结果一致,并发现正常人血清CAT 活度与年龄相关,儿童及老年人血清中的CAT 活度较高,由于检测样品数量较少,该结论有待进一步验证。
综上所述,本研究建立的方法具有良好的准确性,检测限更低,进一步克服了血清样品共存还原性物质的干扰,且操作程序简便,可直接用于人体血清CAT 活度分析,用于临床疾病诊断,具有广阔的应用前景。今后,将进行大范围血清样品的CAT 活度分析,包括正常人、临床患者等,针对性别、年龄及患者疾病类型进行系统分析,进一步探讨CAT 活性与患者疾病间的相关性;另外,还将对方法的实验条件和试剂用量等进行进一步优化,为研发低成本、实用性好的血清荧光试剂盒奠定基础。

