人乳头瘤病毒6 型L1 蛋白的原核表达及免疫原性评价
贺蕾 ,包小华 ,李相梅 ,周晶莹 ,褚彦飞 ,孙博 ,谷铁军
1.吉林大学生命科学学院,吉林 长春 130012;2.吉林大学艾滋病疫苗国家工程实验室,吉林 长春 130012 ;3.中国人民解放军联勤保障部队第964 医院消化内科,吉林 长春 130000;4.上海瑞宙生物科技有限公司,吉林 长春 130012
人乳头瘤病毒(human papillomavirus,HPV)感染易导致全球15 ~44岁女性罹患宫颈癌,是常见的女性恶性肿瘤之一。HPV 常见型别有HPV6、11、16、18、31、33、35、39、45、51、52 等。国际癌症研究机构将黏膜型HPV 根据病毒致癌潜力,分为低危型(low-risk types)和高危型(high-risk types)[1]。低危型HPV 感染会促使生殖器疣的增生;高危型 HPV在女性中会引起子宫颈、外阴、阴道和肛门等多个部位发生癌症[2],而在男性中,可导致肛门癌和阴茎癌[3]。
感染细菌和病毒是已知的癌症危险因素,而在世界范围内,HPV 感染引起的癌症率仅次于引起胃癌的幽门螺旋杆菌[4]。持续的高危型HPV 感染会导致宫颈癌发生。因此,预防宫颈癌的主要方法是进行定期的人体筛查。截至目前为止,宫颈癌的检查方法主要包括HPV-DNA 的检测及对于宫颈细胞异型增生的检测[5]。同时,接种疫苗也是一种常见的预防手段。目前已上市或在研的HPV 预防性疫苗均以HPV L1 VLP 为主要抗原成分。HPV L1 蛋白具有自主装能力,可自发组装成由72个五聚体组成的VLP[6-7]。就国内市场而言,已成功上市的Gardasil®(Merck)、Gardasil®9(Merck)、Cervarix®(GSK)[8-9]、Cecolin®(厦门万泰)均是以 HPV L1 VLP 蛋白为主要抗原,通过不同的表达系统表达蛋白,采用多个蛋白与佐剂联合使用的方法,起到预防多个HPV 型别感染的作用。
本研究构建了重组表达质粒pET30a-6L1,通过添加分子伴侣(TF、GroES-GroEL、DnaK-DnaJ-GrpE)筛选能够增加目的蛋白表达的最佳条件,将纯化的HPV6 L1 VLP 蛋白免疫 BALB / c 小鼠,采用假病毒中和试验检测小鼠血清中和抗体水平,为后续其他型别,尤其是高危型HPV L1 蛋白表达的研究提供参考,也为宫颈癌疫苗的研发提供实验数据。
1 材料与方法
1.1 菌种、质粒、细胞及病毒 感受态大肠埃希菌ER2566 购自上海唯地生物技术有限公司;pUC57-6L1、pET30a(+)质粒由南京金斯瑞生物科技有限公司合成;分别表达分子伴侣TF、GroES-GroEL 和DnaK-DnaJ-GrpE 的质粒 pTf16、pGro7 和 pKJE7 以及HPV6 型假病毒由吉林大学艾滋病疫苗国家工程实验室保存;HEK-293FT 细胞购自美国Thermo 公司,由吉林大学艾滋病疫苗国家工程实验室扩大培养并冻存。
1.2 主要试剂及仪器 限制性内切酶NdeⅠ、HindⅢ购自日本 TaKaRa 公司;T4 DNA Ligase、2 × Rapid Ligation Buffer 购自美国 Promaga 公司;1 kb DNA marker 购自美国 NEB 公司;DMEM 液体培养基、FBS、胰酶、台盼蓝购自美国Gibco 公司;单克隆抗体CamVir 1 购自英国Abcam 公司;L-阿拉伯糖购自上海瑞永生物科技有限公司;IPTG 购自北京索莱宝科技有限公司;蔗糖购自辽宁泉瑞试剂有限公司;AP标记的山羊抗小鼠IgG 购自美国Jackson 公司;BCIP / NBT 显色试剂盒购自美国 Sigma 公司;POROSTMXS 阳离子交换层析柱购自Thermo 公司;PAC300 型蛋白电泳仪、Trans-blot SD 型半干转移电泳槽及细胞成像多功能检测系统(Cytation3)购自美国BIO-TEK 公司;Nano ZS 型动态光散射检测仪购自马尔文帕纳科(中国)公司。
1.3 实验动物 SPF 级 BALB / c 小鼠,雌性,6 ~ 8周龄,体重约27 g,购自辽宁长生生物技术股份有限公司,动物许可证号为:SCXK(辽)2015-0001。本动物实验遵守国家实验动物管理法律、法规、技术标准和有关规定,使用合格的实验动物。按照我国《实验动物福利伦理审查指南(GB / T 35892-2018)》要求,通过实验动物福利伦理审查,落实实验动物福利伦理。
1.4 重组质粒pET30a-6L1 的构建 根据NCBI 登录的全基因序列(Txid:31552),委托南京金斯瑞生物科技有限公司合成具有密码子优化的HPV6 L1基因片段,经NdeⅠ和HindⅢ双酶切后,与原核表达载体 pET30a(+)25 ℃连接 30 min,构建重组质粒pET30a-6L1。
1.5 HPV6 L1 蛋白在大肠埃希菌中的可溶性表达将重组质粒pET30a-6L1 转化至感受态ER2566中,挑取单克隆菌落,接种至 5 mL 含 10 μg / mL 卡那霉素的LB 液体培养基,于大容量全温振荡器,37 ℃,220 r / min 培养过夜;将菌液按 1 ∶100 的比例接种至 500 mL 含 50 μg / mL 卡那霉素的 LB 液体培养基,37 ℃,220 r / min 振荡培养至对数生长期(A600= 0.6 ~ 0.8);加入终浓度 0.1 mmol / L的 IPTG 进行低温诱导,25 ℃继续培养 16 h;4 ℃,2 831 × g 离心 30 min;弃上清,收集菌体,分装并称重,置-20 ℃冷冻保存。按 1 ∶10 比例加入 PBS,重悬菌体,冰浴条件下进行超声(超声功率37% ~39%,超声 5 s,停 5 s,超声周期 30 min);4 ℃,30 966 × g离心30 min;收集上清,用 30%蔗糖垫(wt / wt)浓缩后重悬,经10% ~50%蔗糖密度梯度离心,分段收集蛋白样品。
1.6 HPV6 蛋白共表达分子伴侣的筛选 将pET30a-6L1 质粒与 pGro7、pKJE7 和 pTf16 分别共转化至感受态E.coli ER2566 中,挑取单菌落,接种至5 mL含 50 μg / mL 卡那霉素和 20 μg / mL 氯霉素的 LB液体培养基,37 ℃,220 r / min 振荡培养过夜;按 1 ∶100 的比例接种至 500 mL 含 50 μg / mL 卡那霉素和 20 μg / mL 氯霉素的 LB 液体培养基中,37 ℃,220 r / min 振荡培养至对数期(A600= 0.6 ~ 0.8);将培养温度降至25 ℃,加入终浓度0.1 mmol / L 的IPTG 和 2 mg / mL 的 L-阿拉伯糖,诱导 16 h;4 ℃,2 831 × g 离心 30 min;弃上清,收集菌体,分装并称重,置-20 ℃冷冻保存。按 1 ∶10 比例加入 PBS,重悬菌体,冰浴条件下进行超声(超声功率37% ~39%,超声 5 s,停 5 s,超声周期 30 min);4 ℃,30 966 × g离心 30 min;收集上清,用 30%蔗糖垫(wt / wt)浓缩后重悬,经10% ~50%蔗糖密度梯度离心,分段收集蛋白样品。
1.7 HPV6 L1 蛋白的鉴定 将菌体超声液、30%蔗糖垫浓缩液及分段收集的蛋白样品进行12% SDSPAGE 鉴定。用上述方法将样品经12% SDS-PAGE分离后,电压 16 V,转膜 16 min,3%牛奶-PBS 溶液室温振荡封闭1 h;以Camvir 1 小鼠HPV 单克隆抗体为一抗(1 ∶5 000 稀释),室温振荡孵育 1 h;AP 标记的山羊抗小鼠 IgG 为二抗(1 ∶5 000 稀释),室温振荡孵育45 min;加入显色液(10 mL 碱性磷酸酶Buffer 中加入 33 μL BCIP 和 66 μL NBT),避光显色至条带清晰,进行Western blot 鉴定。
1.8 HPV6 L1 蛋白的纯化 将分段收集的蛋白样品透析。将缓冲体系更换为缓冲液A(50 mmol / L Mops,250 mmol / L NaCl,10 mmol / L DTT,pH 7),并用缓冲液A 平衡POROSTMXS 阳离子交换层析柱,上样,缓冲液 B(50 mmol / L Mops,1.5 mol / L NaCl,10 mmol / L DTT,pH 7)经 20%、40%、60%、80%、100%梯度洗脱,分别得到含 0.5、0.75、1.0、1.25、1.5 mol/L NaCl 的洗脱液,进行 12%SDS-PAGE 鉴定。
1.9 HPV6 L1 蛋白结构表征的分析 采用粒度分析仪检测纯化后含1.25 mol / L NaCl 洗脱样品的粒径大小,并将粒径正确的样品送中国农业科学院哈尔滨兽医研究所,透射电镜下观察VLP 形态。
1.10 HPV6 L1 VLP 免疫原性评价 将 BALB / c 小鼠随机分为实验组和PBS 对照组,每组6 只。将HPV6 L1 蛋白与A(lOH)3佐剂按1 ∶3 比例混合吸附,经小鼠大腿外部肌肉免疫,2 μg HPV6 L1 + 6 μg A(lOH)3/ 只,共免疫2 次,间隔2 周。于初次免疫后2 周,经眼眶采血,分离血清,直至28 周。
采用假病毒中和试验检测中和抗体滴度:预先6 h 铺 HEK-293FT 细胞于 96 孔板中,1.5 × 104个 /(孔·100 μL),37 ℃,5% CO2培养箱培养。将阳性血清进行系列稀释(2 周血清:1.6 × 103、3.2 × 103、6.4 × 103、1.28 × 104、2.56 × 104、5.12 × 104;28 周血清:4 × 102、8 × 102、1.6 × 103、3.2 × 103、6.4 ×103、1.28 × 104)。在 96 孔稀释板上,每孔加入 60 μL假病毒稀释液(200 TCID50/ 50 μL)及 60 μL 阳性血清稀释液,振动混合30 s,每个稀释度设4个复孔,同时设完全培养基替代阳性血清的阳性对照孔(VC)及培养基对照孔(CC)。将稀释板冰浴1 h,从各孔取100 μL 假病毒血清混合物(或培养基)加至预先已铺好细胞的培养板对应孔中,混匀,培养72 h。用细胞成像多功能检测系统分别检测各孔荧光斑点数。用SPSS Statistics 22 软件计算各时间点血清中和抗体滴度,概率为50%时对应的稀释度即为样品血清中和抗体滴度。以小鼠采血时间为横坐标,其对应的中和抗体滴度的对数值为纵坐标,用GraphPad Prism 5 软件绘制不同免疫组血清中和抗体滴度随时间变化情况的曲线图。
2 结 果
2.1 重组质粒pET30a-6L1 的鉴定 质粒的双酶切(NdeⅠ/ HindⅢ)产物经1%琼脂糖凝胶电泳分析,可见约1 500 bp 的目的条带,大小与HPV6 L1 基因相符,见图1。表明重组质粒pET30a-6L1 构建正确。

图1 重组质粒 pET30a-6L1 的双酶切(NdeⅠ/ HindⅢ)鉴定Fig.1 Restriction map of recombinant plasmid pET30a-6L1(NdeⅠ/ HindⅢ)
2.2 表达的HPV6 L1 蛋白的鉴定及共表达分子伴侣的筛选 表达的HPV6 L1 蛋白经12% SDS-PAGE分析,相对分子质量大小约55 000,与分子伴侣TF或GroES-GroEL 共表达时,HPV6 L1 蛋白表达量均有所提高,而与分子伴侣DnaK-DnaJ-GrpE 共表达时,HPV6 L1 蛋白表达量明显降低,见图2。通过灰度扫描量化分析可知,与分子伴侣TF 或GroES-GroEL共表达时,HPV6 L1 蛋白的表达量分别为未加分子伴侣时的2.08 和1.65 倍;而与分子伴侣DnaKDnaJ-GrpE 共表达时,蛋白表达量仅为初始水平的21.67%。表明分子伴侣TF 能使HPV6 L1 蛋白的可溶性表达量获得较大提升。

图2 HPV6 L1 蛋白的表达及共表达分子伴侣筛选的电泳图Fig.2 Electrophoretic profile of expressed HPV6 L1 protein and screened co-expression molecular chaperone
2.3 纯化HPV6 L1 蛋白的鉴定 阳离子交换层析纯化后各梯度洗脱蛋白经12% SDS-PAGE 分析,含1.25 mol / L NaCl 的洗脱液目的蛋白纯度可达90%以上,见图3。

图3 纯化的HPV6 L1 蛋白的SDS-PAGE 鉴定Fig.3 SDS-PAGE profile of purified HPV6 L1 protein
2.4 HPV6 L1 结构表征 HPV6 L1 蛋白在液体中呈均一度较好的病毒样颗粒,粒径为61.40 nm,多分散指数(polymer dispersity index,PDI)为 0.071,见图4。
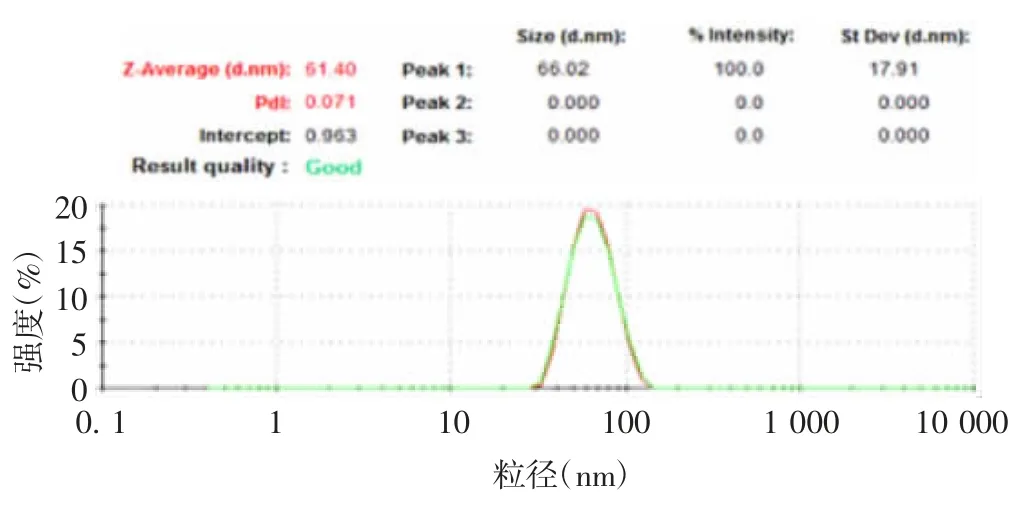
图4 HPV6 L1 VLP 蛋白的动态光散射分析Fig.4 Dynamic light scattering analysis of HPV6 L1 VLPs
2.5 HPV6 L1 VLP 形态观察 HPV6 L1 VLP 是呈均一的、直径45 ~65 nm 的球状结构,与HPV6 天然病毒颗粒的形态、大小相似,见图5。

图5 HPV6 L1 VLP 的透射电镜观察(× 30 000)Fig.5 Transmission electron microscopy of HPV6 L1 VLPs(× 30 000)
2.6 免疫原性 小鼠血清中和抗体滴度约从初次免疫后2 周起产生,第8 周时达到峰值,为105以上,之后虽略有下降进入平台期,但仍保持在较高水平,直至20 周仍可产生较好保护效果,见图6。

图6 HPV6 L1 VLP 免疫小鼠血清中和抗体滴度Fig.6 Titers of serum neutralizing antibody in mice immunized with HPV6 L1 VLP
3 讨 论
每年约7 900 万人感染HPV[10]。据估计,99%的宫颈癌、90%的肛癌、65%的阴道癌、50%的外阴癌和 45% ~ 90%的口咽癌是由 HPV 感染引起[11],疫苗接种已成为控制HPV 感染的必要手段。本研究选用HPV6 L1 蛋白进行表达条件的筛选及免疫原性评价,为后续疫苗研发提供了数据支撑。
本研究构建了能够成功表达HPV6 L1 蛋白的重组质粒,同时优化了表达条件。鉴于HPV L1 VLP 在大肠埃希菌中的表达多以包涵体形式存在[12],同时分子伴侣可帮助其他大分子结构的构象折叠或展开以及组装或拆卸[13],因此,本研究期望可通过添加分子伴侣来增加可溶性目的蛋白的表达。候选的TF、GroES-GroEL、DnaK-DnaJ-GrpE 分子伴侣具有不同特点。TF 分子伴侣是一种组成型表达蛋白,可避免在翻译过程中产生无用的分子内作用,协助蛋白质折叠并增加蛋白表达[14],而本文结果也证实了这一结论。分子伴侣GroEL 及其伴侣蛋白GroES 属于热休克蛋白家族Hsp60 /Hsp10,可介导蛋白质的折叠[15]。DnaK(Hsp70)是相对分子质量69 000 的单分子双结构域蛋白,在促进多聚体蛋白的折叠、易位以及组装和拆卸等方面发挥核心作用,可防止错误折叠和聚集。为了在体内正常发挥作用,DnaK 需要另外两种辅助因子 DnaJ(Hsp40)和 GrpE 的协助。DnaJ 包含 1个保守的J 结构域,是与DnaK 结合所必需的。DnaJ 可独立地以低亲和力结合未折叠的蛋白质。GrpE 可触发ADP从 DnaK 释放,然后随着 ATP 重新结合 DnaK[16-18]。
在病毒学中经常使用假病毒中和试验,可体外检测阻止病毒进入细胞的抗体或药物的有效性,也适用于疫苗开发[19]。世界卫生组织(WHO)将中和抗体水平作为评价HPV 预防型疫苗是否有效的金标准[20]。因此,本研究也选用该方法检测了HPV6 L1 蛋白免疫小鼠血清中和抗体水平,峰值处可达105以上,且较高抗体水平可维持约20 周,具有良好的应用前景。
本研究对HPV6 L1 蛋白表达条件的优化,可为后续其他型别蛋白的表达条件的探索提供参考;同时,中和抗体检测结果显示,获得的HPV6 L1 VLP具有一定的保护效果,可为后续多价宫颈癌疫苗的开发提供经验和数据。
——一道江苏高考题的奥秘解读和拓展

