CSRP1 在前列腺癌组织和细胞中的表达及其对前列腺癌侵袭转移的影响
李璇,马伟雄 ,陈文璞 ,汤金荣 ,俞国锋 ,陈忠 ,2
1.上海市第六人民医院金山分院泌尿外科,上海 201599;2.上海市第六人民医院泌尿外科,上海 200030
前列腺癌是世界范围内排名第5 位的恶性肿瘤,虽然手术治疗对于局限性前列腺癌有效,但15% ~35%的前列腺癌患者最终会发生转移[1-2]。骨是前列腺癌远处转移最常见的部位,约90%的转移性前列腺癌患者有骨骼病变。骨转移依赖于前列腺癌细胞、骨髓微环境、成骨细胞和破骨细胞之间的动态作用[3-5]。原发组织的前列腺癌细胞经过内皮间质转化(epithelial-mesenchymal transition,EMT),并获得骨样表型,在骨组织中转移。激素消融治疗是转移性前列腺癌的标准治疗方法。大多数接受雄激素消融治疗的前列腺癌患者最终会在1 ~3年内发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),中位生存时间为12年。当骨转移出现时,前列腺特异性抗原进展的中位时间显著缩短[6]。前列腺癌骨转移形成成骨细胞病变,其特征是骨生成增加[7]。一些参与富含半胱氨酸和甘氨酸蛋白1(cysteine and glycine-rich protein 1,CSRP1)信号转导的蛋白参与了前列腺肿瘤诱导的成骨细胞活性[8],提示靶向CSRP1 信号的小分子可能是前列腺癌转移的有效干预。
CSRP1 蛋白是CSRP 家族成员,在中胚层及其衍生物中表达[9]。CSRP 蛋白的特征性结构是具有2个LIM 结构域及1个保守的甘氨酸富集区域,LIM结构域包含1个保守的双锌指结构,该结构具有进化保守性,存在于多种具有独特生物学作用的蛋白质中[10]。LIM 结构域被认为是胞质和细胞核中蛋白-蛋白相互作用的中介。目前已知这些与特定蛋白伴侣的相互作用会影响其亚细胞定位和活性。CSRP1 蛋白与 Dis-hevelled 2(Dvl2)和 Diversin(Div)相互作用,后者通过非经典Wnt 和JNK 途径控制细胞形态、调节多种生物学过程[11],包括细胞周期进展、凋亡、分化、代谢、存活和衰老[12-13]。当 CSRP1信息被敲除时,会引起异常的收敛性伸长细胞运动,导致中线结构严重变形。有研究报道,CSRP1 参与了特发性肺纤维化的进展,而特发性肺纤维化患者发生肺癌的风险显著增加[14]。此外,有研究表明,肝癌中CSRP1 基因可通过异常甲基化在肝癌中失活,提示其可能是恶性肿瘤的重要生物标志物[15]。随着研究的深入,CSRP1 可能会成为新型分子标志物,对许多肿瘤的发生、发展具有较大的提示意义。但有关CSRP1 在前列腺癌中的作用尚未见报道。
本研究旨在探讨CSRP1 在前列腺癌组织中的表达及其对前列腺癌侵袭转移的影响和机制。
1 材料与方法
1.1 标本 收集2018年1 月 — 2019年1 月在我院经病理诊断确认为前列腺癌并进行手术切除的30例前列腺癌患者组织和相应的癌旁组织标本,且所有患者均未接受内分泌和放化疗治疗,从手术中获得的组织标本存储于液氮中。本研究获得上海市第六人民医院金山分院人体研究伦理委员会的批准。所有患者均获得书面知情同意书。所有标本均按照伦理和法律标准进行匿名处理。
1.2 细胞 人正常前列腺上皮细胞RWPE-1、前列腺癌PC-3 和LNCaP 细胞系均购自中科院上海细胞所。
1.3 主要试剂 无角质形成细胞血清培养基、RPMI1640 培养基和OPTI-MEMI 培养基均购自美国Gbico 公司;荧光定量PCR 反转录和扩增试剂盒均购自日本 TaKaRa 公司(RR047A / RR420A);兔抗人CSRP1 多抗(ab175319)和小鼠抗人 GAPDH 单抗(ab8245)购自英国Abcam 公司;兔抗人E-cadherin单抗(#1702-1)购自美国Epitomics 公司;兔抗人Vimentin 多抗(sc-5565)购自美国 Santa 公司;ECL 荧光底物试剂盒购自美国Pierce 公司;Transwell 小室购自美国康宁公司。
1.4 细胞培养 用含1%青链霉素双抗的无角质形成细胞血清培养基培养正常人前列腺上皮细胞系RWPE-1,含10%胎牛血清和1%双抗的RPMI1640完全培养基培养PC-3 和LNCaP 细胞。所有细胞在37 ℃,5% CO2,95%湿度条件下培养。
1.5 前列腺癌组织中CSRP1 表达水平的检测 采用免疫组织化学法。固定临床前列腺癌标本,石蜡包埋,冰冻切片机切成5 mm 厚度的切片,并按照标准免疫组织化学进行染色。通过阳性细胞百分比和染色强度综合进行免疫反应性评分(immune reactivity score,IRS)。阳性细胞百分比评分:阳性细胞0 ~ 5%为 0 分,6% ~ 25%为 1 分,26% ~ 50%为 2分,51%~75%为3 分,>75%为4 分;染色强度评分:阴性为0 分,微弱为1 分,中等为2 分,强为3 分。每个病例的最终IRS=百分比评分×染色强度评分。
1.6 前列腺癌细胞中CSRP1 表达水平的检测 采用实时荧光定量PCR。Trizol / 氯仿 / 异丙醇法提取RWPE-1、PC-3、LNCaP 细胞总 RNA,分光光度计测定RNA 的浓度和纯度,逆转录成cDNA。应用Primer Premier 软件设计引物,CSRP1 基因上游引物:5′-TGCCGAAGAGGTTCAGTGC-3′,下游引物:5′-AGCAGGACTTGCAGTAAATCTC-3′;内参 GAPDH 基因上游引物:5′-CGCTGAGTACGTCGTGGAGTC-3′,下游引物:5′-GCTGATGATCTTGAGGCTGTTGTC-3′,引物由上海捷瑞有限公司合成。反应条件:95 ℃预变性30 min;95 ℃变性 12 s,60 ℃退火、延伸 12 s,共 40个循环。记录各样品中目的基因及内参GAPDH 基因的CT 值,计算各样品待测基因的ΔCT 值(目的基因 CT 值 - GAPDH 基因 CT 值);以正常组 ΔCT值为参照,得出各组ΔΔCT 值;计算各基因的相对表达量(变化倍数 = 2-ΔΔCT)。
1.7 CSRP1 基因siRNA 序列的合成及细胞转染 根据 CSRP1 基因 CDS 序列设计 siRNA 序列:5′-GTCATTAGTGATATGTGGCTT-3′(siCSRP1),以及无关序列:5′-GCUUCGCGCCGUAGUCUUATT-3′(siNC),由上海捷瑞生物科技有限公司合成。于6 孔板中常规培养PC-3 细胞,待细胞融合度达40% ~60%时,吸弃培养基,每孔加入不含血清的OPTI-MEMI 培养基2 mL;再用250 μL OPTI-MEMI 培养基稀释Lipofectamine RNAiMAX 6 μL 和 siRNA(60 nmol / L),室温放置 5 min 后,将 Lipofectamine RNAiMAX 与siRNA 混合,室温放置30 min,充分形成混合物;将混合液加入细胞板中,混匀后于恒温箱中继续培养4 ~6 h,吸弃上清液,更换为RPMI1640 完全培养基,置培养箱中培养过夜。
1.8 转染细胞中CSRP1 蛋白表达的检测 采用Western blot 法。收集对数生长期的PC-3 细胞,用预冷PBS 洗涤3 次,用RIPA 缓冲液裂解细胞,经超声、离心后去除其他细胞成分,用BCA 蛋白测定仪测定蛋白浓度。取各组样品蛋白40 μg,经10%SDS-PAGE 分离后,转移至PVDF 膜上,以含5%脱脂奶粉的PBS-T 室温封闭2 h;加入抗CSRP1 抗体(1 ∶1 000 稀释)和抗 GAPDH 抗体(1 ∶5 000 稀释),4 ℃孵育过夜;加入HPR 标记的山羊抗小鼠、抗兔IgG(1 ∶5 000 稀释),室温孵育 2 h;化学发光法检测目的蛋白表达,并进行灰度值分析。
1.9 沉默CSRP1 表达对前列腺癌细胞侵袭能力影响的检测 采用Transwell 小室试验。取对数生长期的PC-3 细胞(为消除不同组细胞生长的影响,饥饿24 h 使各组细胞处于同一生长周期),用胰酶消化,经离心、计数后制成 1 × 106个 / mL 的悬液;提前1 d 将Transwell 板用无血清培养基水化24 h,试验当天取出,在下室中加入750 μL 含10% FBS 的完全培养基,上室加入上述细胞悬液100 μL(共1 × 105个细胞),上室培养基中不含FBS,置37 ℃,5% CO2恒温培养箱中培养(根据不同细胞调整培养时间);将小室移至新的Transwell 空白孔,经多聚甲醛固定10 min;洗涤后加入0.1%结晶紫染色10 min;移去染色剂,PBS 轻洗2 次,医用棉签擦去小室内表面未穿过膜的细胞,将小室置于倒置显微镜下,随机选取膜上9个不同视野,计算穿透膜的细胞数,取平均值。
1.10 沉默CSRP1 表达对前列腺癌细胞迁移能力影响的检测 采用划痕试验。于6 孔板中培养PC-3细胞,待细胞密度达 80% ~ 90%时,用 200 μL 黄色枪头均匀用力进行划痕,PBS 洗涤划痕后漂浮的细胞,拍照0 h 以及各时间点的细胞,每次在同一视野下拍照,记录各时间点距离0 点细胞迁移的距离。
1.11 沉默CSRP1 表达对前列腺癌细胞EMT 发生影响的检测 采用Western blot 法。以抗E-cadherin抗体、抗Vimentin 抗体、抗GAPDH 抗体为一抗,其余步骤同1.8 项。
1.12 统计学分析 应用统计学软件SPSS 18.0 进行统计学分析,实验数据采用均数 ± 标准差()表示,多组间比较采用方差分析,两组间比较采用两独立t 检测,以P <0.05 为差异有统计学意义。试验均重复3 次。
2 结 果
2.1 前列腺癌组织中CSRP1 的表达水平 免疫组化结果显示,CSRP1 在前列腺癌组织中的表达水平高于癌旁组织,见图1 和表1。

图1 免疫组化分析CSPR1在前列腺癌组织中的表达(×400)Fig.1 Immunohistochemical assay of expression of CSPR1 in prostate cancer tissue(× 400)

表1 临床前列腺组织中CSRP1 的表达水平及IRS 评分Tab.1 Expression level and IRS score of CSRP1 in clinical prostate cancer tissue
2.2 前列腺癌组织中CSRP1 的表达水平 实时荧光定量PCR 检测细胞水平的结果与临床标本一致,CSRP1 在前列腺癌细胞 PC-3、LNCaP 中 mRNA 的表达水平显著高于正常前列腺上皮细胞RWPE-1(t 分别为 157.5 和 190.2,P 均 < 0.01),见图 2。

图2 CSPR1 mRNA 在前列腺癌细胞中的表达水平Fig.2 Expression level of CSPR1 mRNA in prostate cancer cells
2.3 转染细胞中CSRP1 蛋白的表达 Western blot分析显示,转染CSRP1 siRNA 序列后,PC-3 细胞中CSRP1 蛋白的沉默效率达90%以上,见图3。

图3 Western blot 检测转染PC-3 细胞中CSRP1 蛋白的表达水平Fig.3 Determination of expression level of CSRP1 in PC-3 cells by Western blot
2.4 沉默CSRP1 表达对前列腺癌细胞侵袭及迁移能力的影响 试验结果显示,沉默CSRP1 表达后,与siNC 组相比,siCSRP1 组PC-3 细胞的侵袭率和迁移率均明显降低(t 分别为-176.4 和 55.4,P <0.05),见图 4 和图 5。

图4 Transwell 小室试验检测PC-3 细胞的侵袭能力(×200)Fig.4 Transwell assay of invasion ability of PC-3 cells(× 200)

图5 划痕试验检测PC-3 细胞的迁移能力Fig.5 Scratch test for migration ability of PC-3 cells
2.5 沉默CSRP1 表达对前列腺癌细胞EMT 发生的影响 Western blot 分析显示,沉默CSRP1 表达后,PC-3 细胞中 E-cadherin 的表达显著升高(t=85.6,P < 0.05),而 Vimentin 的表达明显受到抑制(t =-79.6,P < 0.05),见图 6。表明 CSRP1 下调可抑制前列腺癌EMT 的发生。
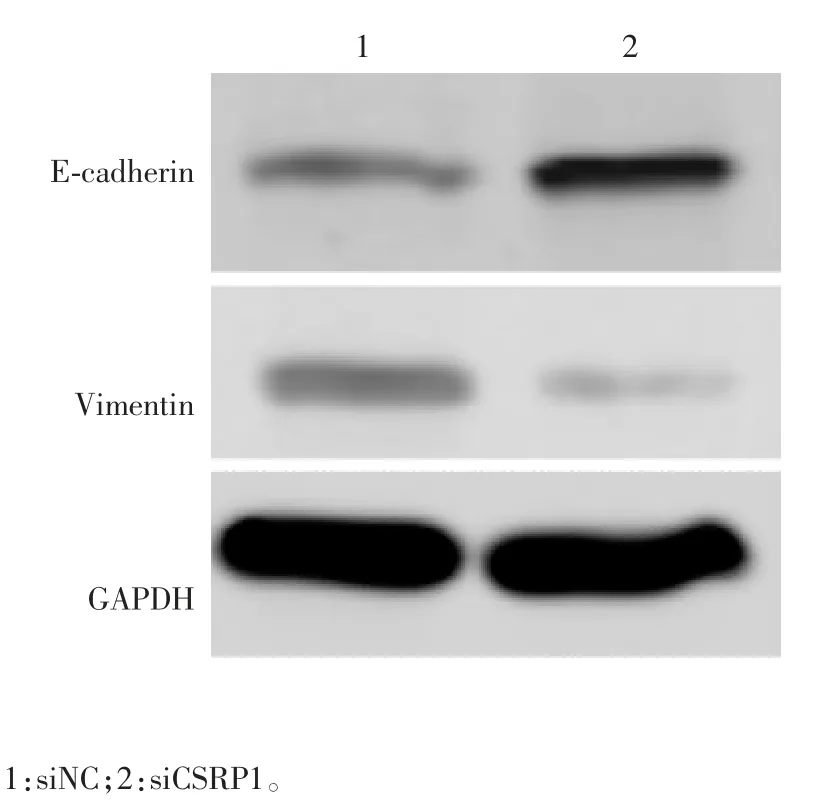
图6 Western blot 分析 PC-3 细胞EMT 的发生Fig.6 Western blotting of EMT in PC-3 cells
3 讨 论
前列腺癌是男性泌尿系统肿瘤常见的恶性肿瘤,在欧美国家特别是美国发病率较高[16-17]。我国前列腺癌发病率较低,但近年来发病率有逐年增高的趋势[18]。前列腺癌在未发生转移前预后良好,其5年生存率接近100%,但一旦发生转移(特别是骨转移),患者5年生存率不到31%[19]。骨转移是前列腺癌最常见的转移部位,也是患者最主要的死亡原因之一。超过60%的晚期前列腺癌患者被发现有骨转移,尸检发现90%以上的前列腺癌患者有骨转移的证据[20]。目前临床对骨转移的治疗策略主要集中在并发症上,并不能提高骨转移的远期生存率。因此,更好地了解肿瘤转移的分子机制有利于治疗前列腺癌骨转移。
CSRP 家族是一组进化上相对保守的蛋白质。已有研究证明,该家族中的某一成员是心脏和肌肉发育的重要调节因子[21]。迄今为止,科学家们已证明在脊椎动物中表征的3 种CSRP 均由双拷贝锌结合LIM 结构域和相关的富含甘氨酸的重复序列组成。这3 种蛋白与人体多种器官的功能密切相关,其中CSRP1 已被证实在多种癌症和疾病中出现表达失调[22-25]。有研究表明,全球低甲基化被认为是前列腺癌的常见事件,前列腺癌中CSRP1 的上调与5′非翻译区(UTR)低甲基化有关,该基因在前列腺癌患者中出现较明显的过表达现象[26]。该发现也进一步证实,CSRP1 与前列腺癌的发生、发展密切相关。
本研究检测了CSRP1 在前列腺癌组织中的表达情况,CSRP1 在前列腺癌细胞和正常细胞中均主要分布在细胞质和细胞核中,且CSRP1 在前列腺癌组织中的表达高于正常癌旁组织。研究还发现,与正常前列腺上皮细胞相比,前列腺癌细胞中CSRP1表达上调。提示CSRP1 表达可能与前列腺癌的发生有关。为了确定CSRP1 在前列腺癌中的作用,本研究转染靶向CSRP1 基因的siRNA 沉默其表达,结果发现,CSRP1 沉默后抑制了前列腺癌细胞的侵袭与迁移能力,上调E-cadhefin 表达并抑制Vimentin表达水平,抑制了EMT 的发生,表明CSRP1 可能是防治前列腺癌侵袭转移的新靶点。

