凝血功能及炎症因子变化与Ⅲ/Ⅳ期子宫内膜异位症疼痛、盆腔粘连关系
赵丽敏 章美芬
1.浙江省景宁县人民医院(323500);2.浙江省丽水市中心医院
子宫内膜异位症(EMs)虽属良性疾病,但难以彻底治愈。美国生育学会修正子宫内膜异位症分期法(r-AFS)分级为Ⅲ/Ⅳ期的中重度EMs患者常伴有不同程度的慢性盆腔痛、痛经、性交痛等,部分患者可能发生盆腔粘连甚至导致不孕[1]。EMs所致疼痛及盆腔粘连等原因及机制尚不完全明确,既往研究多从解剖学、神经学、内分泌及免疫学等角度阐述,尤其是免疫炎症反应被证实与EMs的发生发展关系密切[2]。近年来,部分研究认为EMs的发生发展伴有周期性组织损伤与修复,而修复过程中需要凝血、免疫及炎症等系统的共同参与,故认为凝血、免疫-炎症机制紊乱可能与EMs致疼痛及盆腔粘连有关[3]。本研究尝试分析Ⅲ/Ⅳ期EMs患者的凝血指标及炎症因子谱变化,观察不同疼痛度、盆腔粘连程度患者间差异,旨在揭示凝血、免疫-炎症系统功能紊乱与EMs发生发展及相关性疼痛、盆腔粘连产生的关系,为临床诊治提供参考依据。
1 资料和方法
1.1 研究对象
选择2020年3月-2021年8月本院就诊的Ⅲ/Ⅳ期EMs患者207例为EMs组。纳入标准:①符合《子宫内膜异位症的诊治指南》EMs临床诊断标准[4];②r-AFS为Ⅲ、Ⅳ期,且经手术病理证实;③年龄20~45岁;④近6个月内无抗凝、免疫抑制剂治疗史;⑤认知功能及沟通能力正常,能够配合临床研究。排除标准:①合并子宫腺肌病、子宫肌瘤、生殖系统或全身恶性肿瘤;②合并血液系统疾病、自身免疫性疾病、心肺功能障碍或其他重要脏器功能障碍;③既往具有盆腹腔手术史;④合并贫血、严重高血压及糖尿病。200名同期年龄匹配的健康妇女为正常对照组(对照组)。本次研究获得医院伦理委员会审核通过。患者均签署知情同意书。
1.2 检测方法
EMs组在治疗前24h内,采集晨空腹外周静脉血2管,对照组于入组当日或日次采血。其中一管静脉血采用全自动血凝分析仪检测活化部分凝血酶时间(APTT)、凝血酶原时间(TT)、凝血酶时间(PT)、纤维蛋白原(FIB)和D-二聚体(D-D);另一管离心分离血清,采用酶联免疫吸附法检测血清单核细胞趋化因子-1(MCP-1)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)。采用全自动血球分析仪检测中性粒细胞计数与淋巴细胞计数,计算中性粒细胞与淋巴细胞计数比(NLR)。
1.3 分组
EMs患者根据r-AFS分期标准[4]分组,16~40分为Ⅲ期,>40分为Ⅳ期;疼痛程度根据数字模拟量表(NRS)[5]评价,总分0~10分,0分为无痛组,1~6分为轻中度疼痛组,≥7分为重度疼痛组;参照北京协和医院盆腔粘连分级标准[6]评价盆腔粘连程度,0~1分为无粘连组,2~9分为轻中度粘连组,≥10分为重度粘连组。
1.4 统计学方法
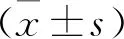
2 结果
2.1 一般情况
EMs组年龄(31.0±5.1)岁(24~50岁),体质指数(BMI)(22.6±2.1)kg/m2(19.5~25.1 kg/m2),孕次(2.3±0.6)次(0~6次),产次(0.9±0.2)次(0~2次)。对照组年龄(30.5±5.0)岁(20~48岁),BMI(22.3±2.1)kg/m2(19.5~24.8 kg/m2),孕次(2.2±0.5)次(0~5次),产次(0.8±0.2)次(0~2次)。两组基线资料均衡可比(P>0.05)。
2.2 各组凝血功能指标比较
EMs组PT、ATPP及TT较对照组缩短,FIB及D-D较对照组提高(P<0.05);ATPP、TT Ⅳ期组与Ⅲ期组无差异(P>0.05),但Ⅳ期组PT低于Ⅲ期组,FIB及D-D高于Ⅲ期组(P<0.05);EMs组不同疼痛程度患者的凝血功能指标无差异(P>0.05),不同盆腔粘连程度患者ATPP、TT比较无差异(P>0.05),但随着盆腔粘连程度加重,PT缩短、FIB和D-D水平升高(均P<0.05)。见表1。

表1 各组凝血功能指标比较
2.3 各组血清炎症因子指标比较
NLR、MCP-1、TNF-α、IL-6及IL-8水平EMs组均高于对照组,且Ⅳ期组高于Ⅲ期组(P<0.05);EMs组不同EMs相关性疼痛程度患者NLR、MCP-1、TNF-α、IL-6、IL-8水平随着疼痛程度加重呈升高趋势,不同盆腔粘连程度患者血清MCP-1、TNF-α、IL-6、IL-8水平随着粘连程度加重呈升高趋势(均P<0.05)。见表2。

表2 各组血清炎症因子指标比较

*与对照组比较 #与Ⅲ期比较 **与本症无比较 ***与本症轻中度比较 P<0.05
2.4 凝血功能指标及炎症因子与EMs患者疼痛及盆腔粘连程度的相关性
EMs患者的PT、ATPP、TT与疼痛程度无明显相关性(P>0.05),PT与盆腔粘连程度呈显著负相关性(P<0.05);FIB、D-D、NLR、MCP-1、TNF-α、IL-6及IL-8与疼痛程度、盆腔粘连程度均呈显著正相关性(P<0.05)。见表3。

表3 凝血及炎症因子指标与EMs患者各症状程度的相关性(r)
3 讨论
疼痛及盆腔粘连是EMs常见临床表现,尤其是在中重度EMs患者中具有发病率高、程度重等特点,增加了治疗难度及复发风险[7]。目前,关于EMs所致疼痛及盆腔粘连的机制并不完全明确,炎症与凝血机制紊乱被认为可能参与了该过程。有报道[8]认为,凝血与炎症反应可能具有相互影响作用,在炎症反应状态下场伴有血小板被动激活,而后者又可刺激促炎物质的生成,进一步扩大炎症反应,参与疾病的发生发展。
本研究发现,与对照组相比,EMs组PT、ATPP、TT缩短,FIB及D-D提高。PT与APTT分别是外源性与内源性凝血筛选指标,TT则是酶促反应过程的体现,FIB则是该反应的底物,D-D是纤维蛋白的反应产物。由此提示,EMs患者存在血液高凝状态,这可能也是部分研究[9]显示EMs是心血管疾病潜在危险人群的原因之一。本文进一步比较分析发现,Ⅳ期组的PT较Ⅲ期组缩短,FIB及D-D高于Ⅲ期组,但不同分期患者ATPP、TT差异不显著。提示外源性凝血系统激活可能在EMs患者的高凝状态中占主要作用,这与林巧等[10]报道基本一致。本研究还显示,在不同疼痛程度EMs患者中,PT、ATPP、TT、FIB及D-D均未见差异,但在盆腔粘连者中PT明显缩短,而FIB和D-D水平明显升高。提示血液高凝对EMs相关性疼痛的影响有限,但与盆腔粘连的发生发展有关。分析原因:考虑为血液高凝状态下可导致血小板聚集、活化,不利于受损组织的修复,进而增加盆腔粘连发生风险[11]。本文相关性分析显示,PT与盆腔粘连程度呈负相关,FIB、D-D与盆腔粘连程度呈正相关,即EMs患者血液高凝状态越严重,则盆腔粘连发生风险或程度越高。
免疫炎症反应已被证实与EMs的发生发展有关,由EMs所诱发的局部炎症性刺激中,由巨噬细胞生成的多种炎性因子可导致周围神经敏感性增强,从而引起疼痛[12]。同时,内膜环境中MCP-1等异常高表达可刺激巨噬细胞向病灶局部聚集,而巨噬细胞产生的TNF-α、IL-8及MCP-1均可进一步刺激病灶,还可促进中性粒细胞的存活以及聚集,进一步加重炎症损伤[13]。在应激反应状态下,由于中性粒细胞增多而淋巴细胞减少,可导致NLR值升高,故NLR也可较敏感反映炎症状态[14]。IL-6可诱导B细胞的分化并促进肝急性时相蛋白的产生,介导免疫与炎症反应,还可刺激前列腺素的合成与胶原沉积,诱导盆腔粘连以及纤维化[15];IL-8可诱导血管内皮细胞的增殖与迁移,还可扩大炎症反应[16]。本研究中,EMs组NLR、MCP-1、TNF-α、IL-6、IL-8水平均高于对照组,且Ⅳ期组高于Ⅲ期组,证实免疫-炎症紊乱与EMs的发生发展有关;在疼痛及盆腔粘连者中,NLR、MCP-1、TNF-α、IL-6、IL-8水平也表现出明显升高趋势,且随着疼痛程度或盆腔粘连程度的加重进一步升高。提示炎症反应与EMs所致疼痛及盆腔粘连的发生有关;相关性分析显示,NLR、MCP-1、TNF-α、IL-6、IL-8水平与疼痛程度、盆腔粘连均呈正相关性,证实炎症反应在EMs所致疼痛及盆腔粘连的发生过程中具有重要作用。
综上所述,Ⅲ/Ⅳ期EMs患者可能处于相对血液高凝及炎症激活状态,且凝血及炎症指标与病情严重程度、盆腔粘连的发生密切相关,同时炎症反应与EMs所致疼痛也具有紧密关系。因此,检测凝血指标及炎症因子有利于评估EMs病情,评价EMs所致疼痛及盆腔粘连的发生及严重程度,指导临床干预治疗。

