miR-219a-5p 在胃癌中的甲基化调控及生物学功能研究
罗 敏章 帆王利民李红霞卿克勤
(成都市第一人民医院检验科,成都 610000)
胃癌是起源于胃黏膜上皮组织的恶性肿瘤,严重威胁人类健康。 根据国际癌症研究机构2020 全球最新癌症数据显示:中国胃癌的发病人数约为47.8 万(占全球43.9%),死亡人数约为37.3 万(占全球48.6%) ,发病率和死亡率均位列第三位[1]。
胃癌患者的高死亡率主要是由于肿瘤的复发和转移,DNA 甲基化调控在胃癌的发生过程中具有重要意义[2],而肿瘤相关的microRNA 研究揭示出许多在肿瘤发生发展、耐药以及预后等方面起重要作用[3]。 miR-219a-5p 已被报道在多种类型的肿瘤细胞中发挥重要调控作用:miR-219a-5p 抑制乳腺癌细胞的迁移和侵袭[4];miR-219a-5p 上调抑制了黑色素瘤的生长和转移并增强了黑色素瘤细胞的化学敏感性[5];miR-219a-5p 抑制上皮性卵巢癌细胞增殖,迁移和侵袭[6];miR-219a-5p 增强胆囊癌进展[7]。 但miR-219a-5p 及其甲基化调控在胃癌的发生发展中的机制尚不清楚。 本研究发现miR-219a-5p 在胃癌患者组织中受甲基化调控而出现表达水平明显下调,通过体外实验进一步验证过表达miR-219a-5p 后能明显抑制细胞增殖和迁移侵袭的能力,提示在胃癌发生发展过程中发挥抑癌基因的作用,为胃癌的诊治提供新的思路。
1 材料和方法
1.1 实验材料
1.1.1 细胞
人胃癌细胞株MGC-803(中国医学科学院基础研究所细胞中心)。
1.1.2 组织
胃癌组织及其相应癌旁组织共110 例(均来自北京市肿瘤医院2013~2016 年手术切除后冻存组织标本)。 已通过成都市第一人民医院(成都市中西医结合医院)伦理审查(2020 年KT 第006 号)。
1.2 主要试剂与仪器
1640 培养基和胎牛血清(Hyclone 公司);荧光定量PCR 试剂盒(北京全式金生物技术有限公司);Lipofectamine 2000 细胞转染试剂(Invitrogen 公司);miR-219a-5p-mimic(上海吉玛生物技术有限公司);亚硫酸氢盐转化试剂盒EpiTect@Bisulfite kit(Qiagen 公司,货号58694I);兔抗人P-caspase-3 抗体(Cell Signaling 公司,货号8664L);CCK-8(Cell Counting Kit-8)(日本株式会社同仁化学研究所Dojindo,货号CK04);凋亡试剂盒PE Annexin V Apoptosis Detection Kit I (BD Biosciences 公司,货号579563)。 Transwell 小 室(Minipore 公 司, 货 号PIMP12R48);荧光定量PCR 仪(美国Bio-Rad IQ5);流式细胞仪(美国Coulter Flow c6)。
1.3 实验方法
1.3.1 实时荧光定量RT-PCR
文中所有引物的设计均根据Primer Premier 5 软 件 设 计。 miR-219a-5p 逆 转 录 引 物: 5 ’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTG GATACGACAGAATT-3’; U6 逆 转 录 引 物: 5’- AAAATATGGAACGCTTCACGAATTTG-3 ’; miR-219a-5p 定 量PCR 上 游 引物:5’-CAGCTGATTG TCCAAACGC-3’;miR-219a-5p 定量PCR 下游引物:5’-GTGCAGGGTCCGAGGT-3’;U6 定量PCR 上游引物:5’-CTCGCTTCGGCAGCACATATACT-3’;U6 定量 PCR 下 游 引 物: 5 ’-ACGCTTCACGAATTT GCGTGTC-3’。 定量PCR 反应条件为:95℃ 5 min,95℃ 30 s,60℃ 30 s,72℃ 30 s,40 个循环,72℃ 10 min。 均设复孔3 个。 IQ5 荧光定量PCR 仪进行PCR 检测。 利用IQ5 自带分析软件导出相对表达值进行统计学分析。
1.3.2 甲基化特异性PCR 及甲基转移酶抑制剂5’aza-2’-脱氧胞苷(5’ AZa-CDR)处理细胞
提取肿瘤组织及癌旁组织DNA,通过亚硫酸氢盐转化试剂盒处理后进行甲基化特异性PCR。 CPG岛预测及甲基化引物设计利用在线软件Methprimer (http:/ /www.urogene.org/methprimer/index1.html)及Primer Premier 5 软件:甲基化上游引物:5’-TTGATTGTTTAAACGTAATTTTCGA-3’;甲基化下游引物:5’-CTAAAAACACACCTAAATCCCGAT-3’;非甲基化上游引物:5’-TTGATTGTTTAAATGTAATT TTTGA-3’;非甲基化下游引物:5’-CCTAAAAAC ACACCTAAATCCCA-3’。 甲基化特异性PCR 采用Touchdown PCR 的方法,反应条件如下:95℃ 5 min,95℃ 30 s,58℃ 30 s,72℃ 40 s,每个循环降0.6℃,10 个循环后,52℃ 30 s,72℃ 40 s,35 个循环,72℃ 10 min。 用5、15、30 μmol/L 的不同浓度梯度的5’ AZa-CDR 和组蛋白去乙酰化酶抑制剂曲古抑菌素A (TSA)处理胃癌细胞MGC-803 后,分析处理前后miR-219a-p 的表达变化情况。
1.3.3 细胞转染和分组处理
MGC-803 细胞株培养于含10%胎牛血清的1640 完全培养基,37℃、5% CO2。 将MGC-803 细胞接种于6 孔板,待细胞融合度达到70%~80%时(贴壁24 h 内),脂质体转染方法:每孔100 μL 的无血清培养基中稀释20 μL mimic,另外100 μL 的无血清培养基中稀释Lipofectamine 2000 转染试剂3 μL,各静置5 min 后混合再静置20 min;将上述混合液加入含细胞的6 孔板中,终体积为1 mL 无血清无双抗1640 培养基,6 h 后更换新鲜完全培养基2 mL。转染后继续培养48 h,收获细胞提取RNA 和蛋白质。 把转染control-mimic 和miR-219a-5p-mimic 的胃癌细胞MGC-803 命名为control-mimic(对照组)和miR-219a-5p-mimic(miR-219a-5p 过表达组)。 把没有转染的细胞命名为un-treated(未处理组)。
1.3.4 组织标本与细胞总RNA 提取
按TRIzol 说明书操作提取组织或者细胞总RNA。 总RNA 通过琼脂糖凝胶电泳法检测其完整性。
1.3.5 检测细胞增殖
取转染后24 h 的MGC-803 细胞,重新铺于96孔板中,相同实验组各设4 个复孔。 每孔铺5000 个细胞,分别设0、24、36、48、72 h 5 个时间点,检测450 nm 与630 nm 双波长下的光密度值(optical density, OD) ,制作时间增殖曲线,所有操作均按CCK-8 试剂盒说明书操作。
1.3.6 检测细胞凋亡
取转染后48 h 的胃癌细胞系MGC-803 用预冷的PBS 洗涤2 次,用Bind buffer 重悬,经PE Annexin V 和7-Amino-actinomycin (7-AAD)双染后1 h 内送流式细胞仪检测。
1.3.7 Western blot 检测p-caspase-3 蛋白的表达
提取细胞(约1×106个)总蛋白,并将20 μg 总蛋白于10% SDS-聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDSPAGE)中电泳并转移到硝酸纤维素膜上,5%脱脂奶室温封闭2 h,将膜封闭于含有相应一抗的抗体稀释液中(1 ∶ 1000) ,4℃过夜。 次日用TBST(tris buffered saline with 0.05% Tween-20)缓冲液洗膜3次,每次10 min,然后加入相应的二抗(1 ∶1000),室温温育1 h,TBST 洗膜3 次后显影。 内参甘油醛-3-磷酸脱氢酶重组蛋白(recombinant glyceraldehyde-3-phosphate dehydrogenase, GAPDH) 一抗(1 ∶2000),二抗(1 ∶5000)。 用增强化学发光法显色,X光片曝光显影。
1.3.8 迁移和侵袭实验
接种细胞前1 d 在Transwell 小室上准备基质胶,基质胶与预冷的无血清1640 按1 ∶7 的比例以总量32 μL 铺室面(做肿瘤迁移实验则不需要此步);取不含血清的培养液制备单细胞悬液(每毫升2.5×105个)400 μL 加入上室中;在下室即24 孔板内加入600 μL 含20% FBS 的1640 培养液。 将24孔板置于37℃、5% CO2细胞培养箱内,培养24 h 后用湿棉签檫去膜上面未穿过膜的细胞,无水乙醇固定20 min 后结晶紫染色,染色完毕后将小室自然风干,用手术刀片沿压痕将小室膜轻轻切下,置于载玻片上在显微镜下观察、计数。
1.4 统计学方法
应用SPSS 20.0 软件进行数据统计,实验数据以平均数±标准差(±s)表示,各组均数通过方差齐性检验后,两组间的比较采用t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 miR-219a-5p 在胃癌组织及其癌旁组织中的差异表达
通过实时荧光定量PCR 我们分析了110 例胃癌患者癌组织(C)及癌旁组织(N) 标本中的表达情况,数据用Log1.5 (C/N)表示,有72 例患者miR-219a-5p 的表达水平在癌组织中低于癌旁组织,另外38 例患者表达上调(见图1A)。 miR-219a-5p 在癌组织中的表达值为(0.769±0.95),癌旁组织表达值为(2.114±5.10),差异具有统计学意义(P=0.0063)(见图1B)。
2.2 miR-219a-5p 在胃癌组织中的表达与临床病理分期分型的相关性
本研究分析了110 例胃癌患者中miR-219a-5p的表达与临床病理因素之间的相关性,其表达与年龄性别等无统计学差异,与临床病理分型及分期有一定的相关性,miR-219a-5p 的表达随着肿瘤分期的增加而进一步降低,差异具有统计学意义(P<0.05),见表1。
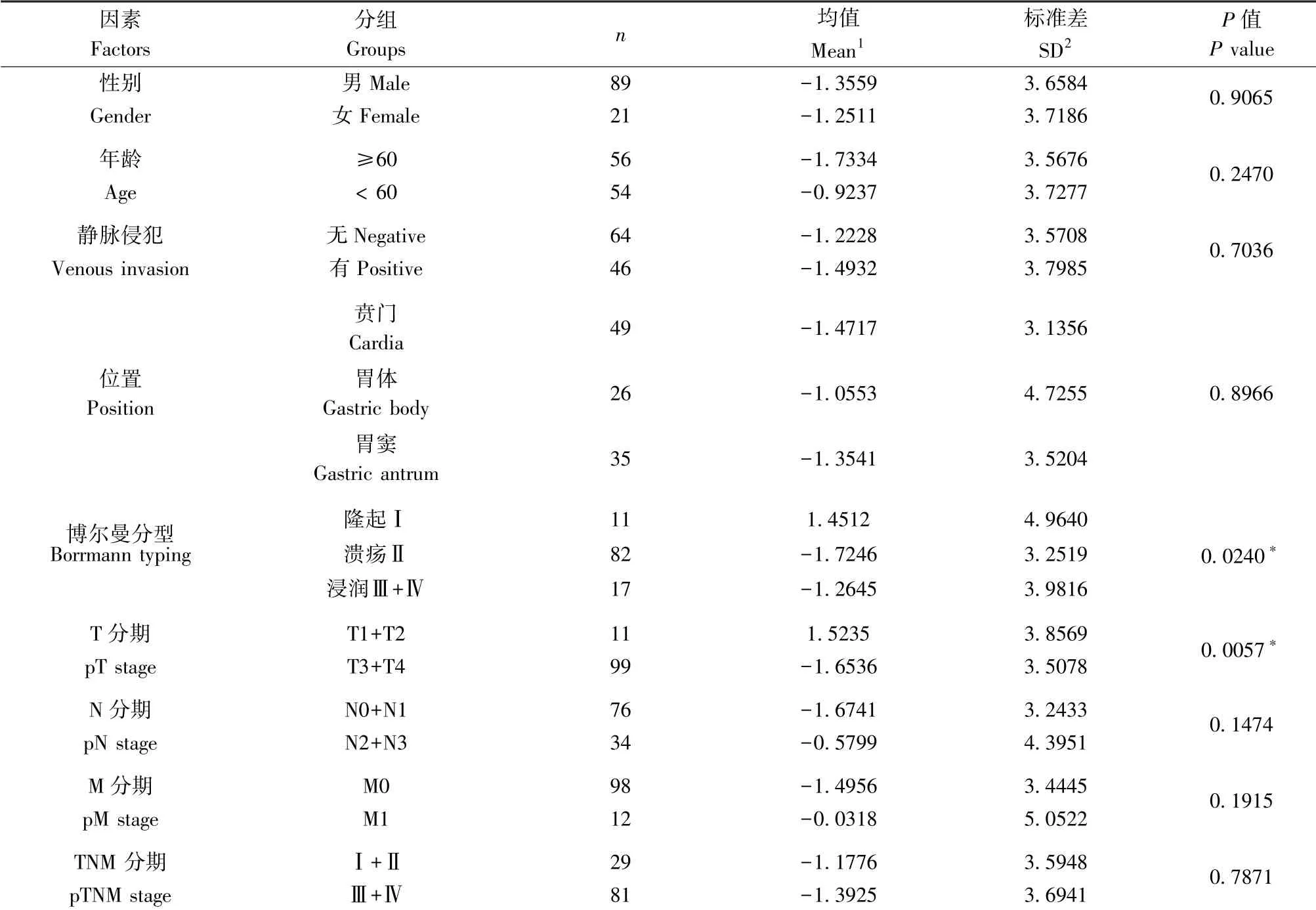
表1 miR-219a-5p 表达和胃癌患者临床病理特征的关系(n=110)Table 1 Relationship between miR-219a-5p expression and clinicopathological characteristics of gastric cancer patients
2.3 miR-219a-5p 的表达受表观遗传学调控
为了明确miR-219a-5p 在胃癌细胞中表达下调的原因,本研究首先进行生物信息学分析,利用MethPrimer 软件预测miR-219a-5p 上游区域的CpG岛(图2A)。 采用MSP 检测11 对miR-219a-5p 表达下调组和9 对表达上调组的胃癌组织和癌旁组织中miR-219a-5p 的甲基化状态。 本研究发现miR-219a-5p 基因启动子区域的高甲基化比例在miR-219a-5p表达下调组(72.7%,8/11)比表达上调组的甲基化比例(55.6%,5/9)更高(图2B)。 此外,MGC-803经5’ AZa-CDR 处理后,miR-219a-5p 的表达上调(图2C),TSA 的联合处理排除无其他表观遗传调控的影响。 综上所述,这些数据表明,miR-219a-5p 在胃癌中由于上游区域甲基化而表达下调。
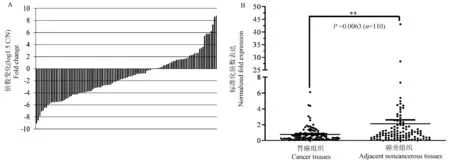
注:A: 患者miR-219a-5p 在癌组织中的相对下调表达比例;B: miR-219a-5p 在癌组织及癌旁组织中的表达值分布情况。 与癌旁组织相比,∗∗P<0.01。图1 miR-219a-5p 在胃癌组织及其癌旁组织中的表达情况Note.A, Relative down-regulated expression ratio of miR-219a-5p in cancer tissues of patients.B, Distribution of expression values of miR-219a-5p in cancer tissues and adjacent tissues.Compared with adjacent noncancerous tissues group, ∗∗P<0.01.Figure 1 Expression of miR-219a-5p in gastric cancer tissues and adjacent tissues
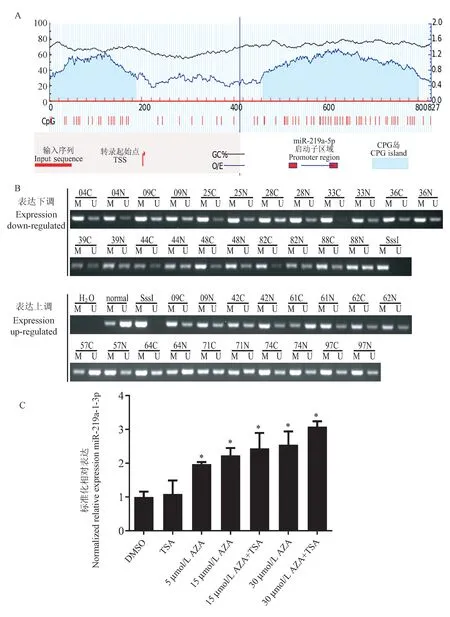
注:A: MiR-219a-5p 上游区域的CpG 岛; B: MiR-219a-5p 基因启动子区域的甲基化情况;C: MGC-803 细胞经5’ AZa-CDR 处理后miR-219a-5p 的表达情况。 DMSO:二甲基亚砜;AZA:5-氮杂-2-脱氧胞嘧啶(5’ AZa-CDR);TSA:组蛋白脱乙酰酶曲古抑菌素A;C:癌组织;N:癌旁组织;M:甲基化引物PCR 产物;U:未甲基化引物PCR 产物。 与DMSO 处理组相比, ∗P<0.05。图2 miR-219a-5p 的表达受甲基化表观遗传学调控Note.A, CpG island in the upstream region of miR-219a-5p.B, Methylation in the promoter region of miR-219a-5p gene.C, Expression of miR-219a-5p in MGC-803 cells treated with 5’ AZa-CDR.DMSO, Dimethyl sulfoxide.AZA, 5-aza-2-deoxycyfidine (5’ AZa-CDR).TSA, Histone deacetylase Trichostatin A.C, Cancer tissues.N, Adjacent noncancerous tissues.M, Methylated primer PCR product.U, Unmethylated primer PCR product.Compared with DMSO treatment group, ∗P<0.05.Figure 2 Expression of miR-219a-5p is regulated by methylation epigenetics
2.4 过表达miR-219a-5p 抑制胃癌细胞MGC-803的增殖能力
通过脂质体转染模拟体mimic 使MGC-803 细胞过表达成功,过表达组miR-219a-5p 表达水平升高近9583 倍,见图3A。 CCK-8 结果显示,与未处理组(un-treated) 和对照组(control-mimic)相比,过表达组(miR-219a-5p-mimic)的细胞增殖能力明显受到抑制,72 h 时间点的CCK-8 检测值(OD450和OD630)分别是(1.83±0.02)、(1.78±0.02)、(1.18±0.06),差异具有统计学意义(P<0.001)(见图3B)。
2.5 过表达miR-219a-5p 促进胃癌细胞MGC-803的凋亡
流式细胞仪结果显示,与un-treated 组和controlmimic 组相比,miR-219a-5p 过表达组MGC-803 细胞的凋亡比例明显增加,见图4A 所示,control-mimic 组与miR-219a-5p 过表达组的早期凋亡比例分别是(26.6±0.94)%和(51.6±1.74)%,晚期凋亡比例分别是(11.3±1.21)%和(9.6±0.95)%,早期凋亡率明显增高(P<0.05)。 Western blot 结果显示,MGC-803 细胞转染miR-219a-5p-mimic 48 h 后,凋亡相关蛋白caspase-3 的表达水平明显比对照组的表达水平高,GAPDH 为内参,见图4B。
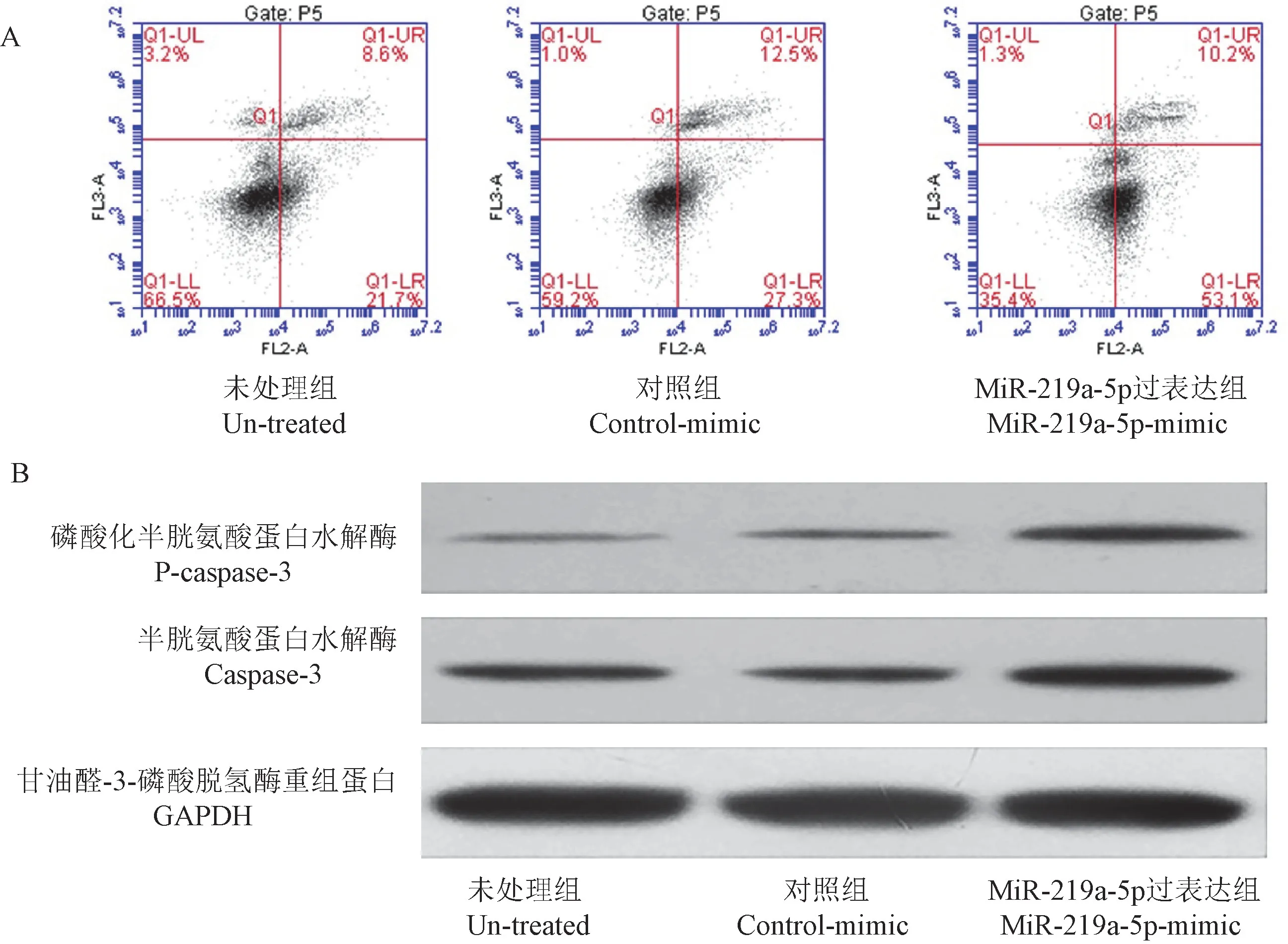
图4 MiR-219a-5p 过表达后对MGC-803 细胞凋亡的影响Figure 4 Effect of miR-219a-5p overexpression on MGC-803 cell apoptosis
2.6 过表达miR-219a-5p 抑制胃癌细胞MGC-803迁移和侵袭能力
图5A、5B 所示,Transwell 小室迁移实验结果显示,过表达miR-219a-5p 组高倍镜每视野平均穿膜细胞数明显少于un-treated 组和control-mimic 组,差异具有统计学意义(P<0.05) 。 图5A、5C 所示,在有基质胶的transwell 小室侵袭实验发现,miR-219a-5p 过表达组高倍镜每视野平均穿膜细胞细胞数同样明显少于un-treated 组和control-mimic 组,差异具有统计学意义(P<0.05)。 以上实验表明,miR-219a-5p 能减弱胃癌细胞的迁移和侵袭能力。
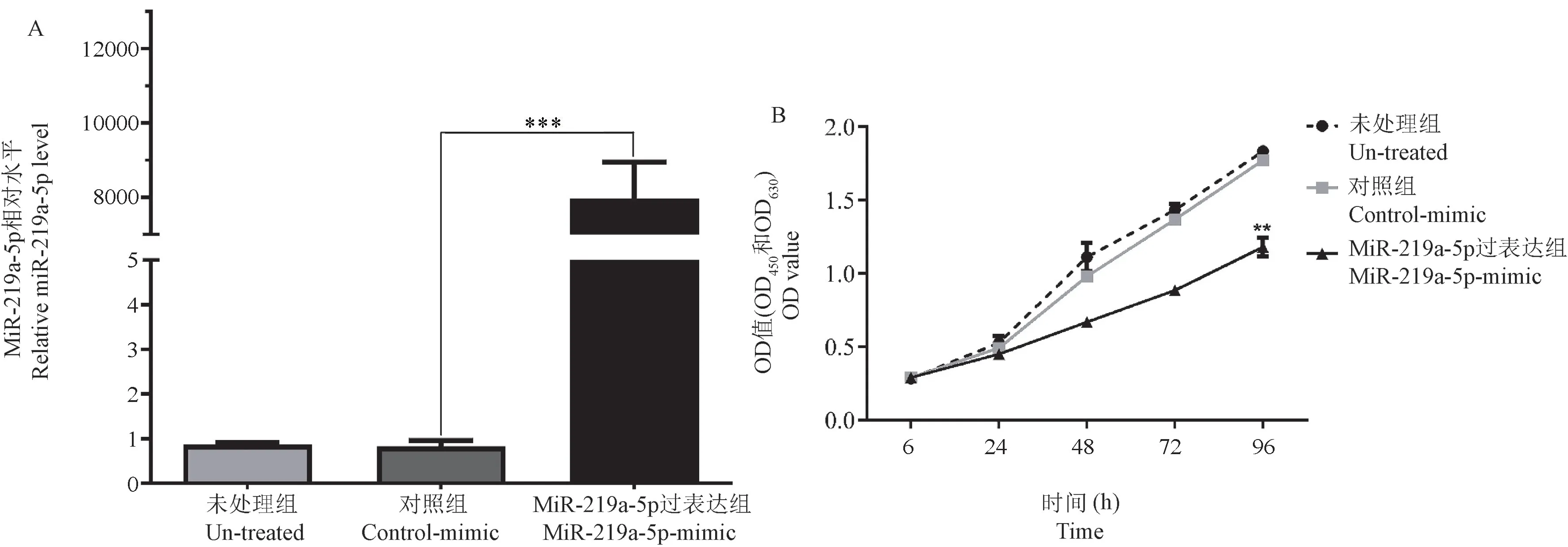
注:A: MGC-803 细胞转染mimic 后miR-219a-5p 过表达成功;B: miR-219a-5p 过表达后抑制MGC-803 细胞的增殖。 与对照组相比,∗∗∗P <0.001。图3 miR-219a-5p 过表达后对MGC-803 细胞增殖的影响Note.A, Overexpression of miR-219a-5p successfully transfected mimic into MGC-803 cells.B, Overexpression of miR-219a-5p inhibited the proliferation of MGC-803 cells.Compared with control-mimic group,∗∗∗P <0.001.Figure 3 Effect of miR-219a-5p overexpression on the proliferation of MGC-803 cells
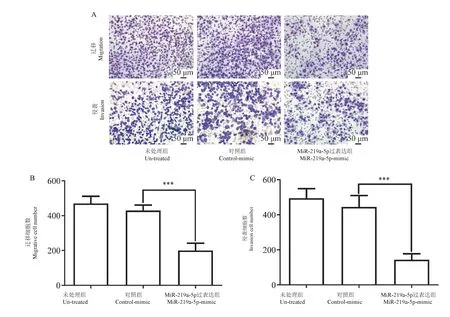
注:A: MiR-219a-5p 过表达后抑制MGC-803 细胞的迁移和侵袭;B: 3 组高倍镜每视野平均穿膜细胞数。 与对照组相比, ∗P<0.05。图5 MiR-219a-5p 过表达后对MGC-803 细胞迁移和侵袭能力的影响Note.A, Overexpression of miR-219a-5p inhibited the migration and invasion ability of MGC-803 cells.B, The average number of transmembrane cells per field of view of the three groups of high magnification.Compared with control-mimic group, ∗P<0.05.Figure 5 Effect of miR-219a-5p overexpression on the migration and invasion ability of MGC-803 cells
3 讨论
胃癌患者发病一般无明显症状,常与胃炎、胃溃疡等胃慢性疾病症状相似,由于缺乏有效的早期诊断的肿瘤分子标志物,大多数胃癌患者确诊时已是进展期,而患者预后高度依赖肿瘤临床分期,早期胃癌患者术后5 年生存率可达90%,而进展期胃癌的5 年生存率却低于30%[8],可见胃癌的及时诊断和预后评估对于优化治疗策略至关重要,传统的各种血清抗原标志物如癌胚抗原(CEA)、糖类抗原19-9(CA19-9)、胃蛋白酶原(PG)等的检测仅通常被用作表明癌症风险的特征[9-10]。 因此,寻找胃癌新的肿瘤分子标志物是临床对胃癌精准诊疗的迫切需求。 miRNA 通过对靶mRNA 的降解或翻译抑制,从而发挥其对靶基因表达的转录后调控作用,在肿瘤进展和转移过程中发挥重要的调节作用[11-12]。 Li 等[13]研究发现血清miR-17-92 能很好的区分早期胃癌患者和健康对照组,具有致癌潜力,其中miR-20a-5p 在诊断胃癌时受试者工作特征曲线下面积(AUC)较高,大于0.95,敏感性和特异性均大于90%,可见miRNA 可以很好的作为胃癌诊断的潜在分子标志物。
在本研究中,通过实时荧光定量PCR 方法手段发现miR-219a-5p 在胃癌患者癌组织中呈现普遍低表达情况,本课题组下一步研究计划就是收集胃癌患者血清标本,检测血清标本中miR-219a-5p 的含量,分析是否能为筛选胃癌早期诊断标志物提供参考价值。 为了探索miR-219a-5p 为什么会出现癌组织表达下调,我们分析了miR-219a-5p 所跨越的基因组启动子区域序列,利用MethPrimer 在线软件(http:/ /www.urogene.org/methprimer/index1.html)我们发现存在CpG 岛,miRNA 表达的失调是癌症的发生、发展的重要特征,miRNA 的表达具有组织和时空特异性,并受到表观遗传机制调控,CpG 岛的高甲基化具有沉默基因表达的作用[14]。 miR-320a在胃癌组织中受DNA 甲基化调控,在癌组织中表达普遍下调,并可抑制肿瘤进展[15]。 我们的实验结果也提示在胃癌组织中显著低表达的miR-219a-5p 很可能受甲基化的表观遗传调控。 同时我们发现miR-219a-5p 的表达随着肿瘤恶性程度的增加而降低,研究结果表明其表达的改变可能在胃癌的进展中扮演一定角色。
miRNA 在胃癌治疗、监测复发和判断预后方面也有着广阔的应用前景,多项研究表明miRNA 与胃癌的转移、复发和耐药等紧密相关[16-18]。 本研究利用模拟体miR-219a-5p-mimic,在胃癌细胞系MGC-803 中成功过表达miR-219a-5p 后,可明显抑制肿瘤细胞的增殖、迁移和侵袭,并促进凋亡,这说明了miR-219a-5p 可能是胃癌发生发展过程中一种重要的抑癌miRNA,调控胃癌细胞增殖、凋亡、转移等生物特性过程,虽然具体机制还有待进一步研究,但为临床治疗胃癌提供了新的靶点。 Wang 等[17]报道miR-454 在胃癌组织和细胞系中显著下调,miR-454的低表达与淋巴结转移、浸润深度和TNM 分期呈正相关,并提出miR-454 可能负调控结合丝裂原活化蛋白激酶1 而在胃癌中发挥抑癌基因作用,抑制胃癌细胞的增殖和侵袭,诱导了细胞的凋亡。 由此可见,miRNA 作为基因的重要调控因子,可望成为胃癌精准治疗的最有前景的新靶点。
Ji 等[18]研究发现miR-374a-5p 在胃癌患者血清中明显高表达且与患者进展及预后不良相关,且装载了miR-374a-5p 抑制剂的外泌体能够逆转奥沙利铂体内外抗性,显著抑制肿瘤的生长,这些发现提示,体外抗miR-374a-5p 可能是一种潜在的胃癌耐药治疗方法,也说明利用外泌体的转运功能以及较好生物相容性的特性在治疗肿瘤中显示出优势,这将为miRNA 靶向治疗开拓一片广阔领域。 如果将目的miRNA 装载至外泌体过表达抑癌基因,其抑制肿瘤活性的效果可能将更明显[19]。

