宫腔镜下宫颈锥切术在绝经后女性宫颈高级别鳞状上皮内瘤变诊治中的应用
李捷 王军霞
宫颈癌居于我国女性生殖系统恶性肿瘤之首,2015年新发宫颈癌中,23.7%为55岁以上女性[1],严重威胁女性健康。随着宫颈癌筛查的普及,宫颈癌前病变及宫颈癌的筛出率日益提升。由于绝经后女性鳞柱交界内移至宫颈管内,或宫颈严重萎缩,往往不能得到满意的阴道镜评估,增加了诊治难度。对于绝经后已经诊断为宫颈鳞状上皮内瘤变的女性应积极行手术治疗,传统手术方式包括宫颈冷刀锥切术(CKC)、宫颈环形电切术或子宫切除术等。近年来,宫腔镜下宫颈锥切术(TCRC)在临床上的应用越来越广泛,效果日益显著。本研究就绝经后女性宫颈高级别鳞状上皮内瘤变行不同手术方式的患者相关临床资料进行分析,现报道如下。
1 材料与方法
1.1 一般资料 选取2019年11月1日~2020年12月31日于我院住院治疗,临床资料完整的绝经后宫颈高级别鳞状上皮内瘤变患者共116例,依据手术方式不同分为2组,其中CKC组60例,TCRC组56例。纳入标准:①术前均接受液基薄层细胞学检查(Thinprep cytologic test,TCT)及人乳头瘤病毒(Human papilloma virus,HPV)检测,并进行阴道镜下宫颈活组织检查,组织病理学诊断结果为宫颈高级别上皮内瘤变;②已绝经者。排除标准:①生殖道感染者;②合并子宫内膜息肉、黏膜下子宫肌瘤等需进行宫腔镜下手术治疗者;③合并严重内、外科疾病者。本研究经医院伦理委员会批准,全部患者术前均已签署知情同意书。
1.2 方法
1.2.1 手术方法 术前完善血常规、肝功、肾功、凝血、妇科、腹部、泌尿系超声、心电图、胸片检查,无手术禁忌证。术前2天常规阴道擦洗。
CKC组常规选择腰麻、膀胱截石位,消毒铺巾,留置导尿管,窥阴器暴露宫颈,使用2%碘伏消毒阴道和宫颈,3%碘酊宫颈染色,明确病变范围,左手持组织钳钳夹宫颈前唇,分别于宫颈3、6、9、12点间质注射稀释的垂体后叶素5ml(0.06IU/ml)。冷刀沿碘染不着色区域外3mm处做环形切口,切除宫颈锥高2~2.5cm,肉眼所见切缘无残留。1-0薇乔连续缝合宫颈创面,确保宫颈管未闭合。检查无渗血,阴道内填塞碘仿纱布1块、纱布1块,术后24h取出。
TCRC组患者一般选择静脉麻醉,麻醉成功后取膀胱截石位,常规消毒外阴、铺单,消毒阴道宫颈3遍,碘酊染色,确定病变范围。术前半小时静脉滴注间苯三酚80mg软化宫颈。使用日本奥林巴斯的UES40型、连续灌流式宫腔电切镜和高频电源发生器,切割功率设定为90W,凝固功率为70W,0.9%氯化钠液作膨宫液,压力设定至100mmHg。扩张宫颈至9.5mm,置入电切镜,自宫颈内口上0.5cm处由内向外逐步切除宫颈组织至宫颈外口,切除深度0.2~0.3cm,尽量完整长条状切除宫颈管组织,用丝线按照顺时针切除方向,缝合标记宫颈鳞柱交界上皮组织的对侧。切除组织常规送病理检查。1.2.2评价指标 记录患者年龄、绝经年龄、绝经年限、TCT及HPV感染情况、手术时间、术中出血量、术前及术后病理符合情况、切缘阳性等。
1.3 统计学方法 采用SPSS 20.0进行数据分析,计量资料用±s表示,组间比较采用t检验,计数资料以率表示,采用χ2检验,以双侧α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 两组平均年龄、绝经年限相比,差异有统计学意义(P<0.05)。两组术前HPV感染率分别为90.00%、82.14%,TCT分类差异均无统计学意义。见表1。
表1 两组患者一般资料比较(±s)
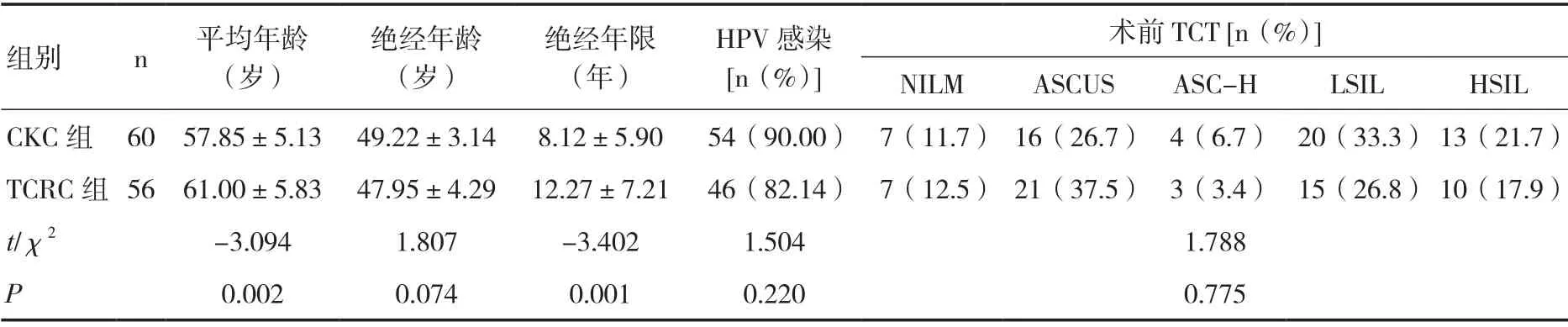
表1 两组患者一般资料比较(±s)
组别 n 平均年龄(岁)绝经年龄(岁)绝经年限(年)HPV感染[n(%)]术前TCT [n(%)]NILM ASCUS ASC-H LSIL HSIL CKC组 60 57.85±5.13 49.22±3.14 8.12±5.90 54(90.00) 7(11.7)16(26.7) 4(6.7) 20(33.3)13(21.7)TCRC组56 61.00±5.83 47.95±4.29 12.27±7.21 46(82.14) 7(12.5)21(37.5) 3(3.4) 15(26.8)10(17.9)t/χ2 -3.094 1.807 -3.402 1.504 1.788 P 0.002 0.074 0.001 0.220 0.775
2.2 观察指标 两组患者均行拟定手术,术后未发生感染。两组平均手术时间及术中出血量相比差异有统计学意义(P<0.05)。CKC组与TCRC组病理升级率分别为31.7%(19/60)、10.7%(6/56),病理降级率分别为16.7%(10/60)、39.3%(22/56)。见表2。
表2 两组围手术期指标比较(±s)
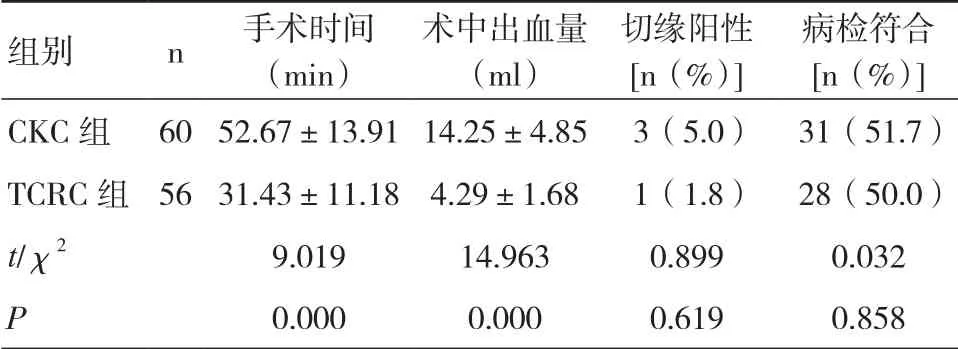
表2 两组围手术期指标比较(±s)
组别 n 手术时间(min)术中出血量(ml)切缘阳性[n(%)]病检符合[n(%)]CKC组 60 52.67±13.91 14.25±4.85 3(5.0) 31(51.7)TCRC组 56 31.43±11.18 4.29±1.68 1(1.8) 28(50.0)t/χ2 9.019 14.963 0.899 0.032 P 0.000 0.000 0.619 0.858
3 讨论
宫颈癌的三阶梯原则(筛查-阴道镜评估-组织活检)是筛查宫颈癌的标准模式,大部分育龄期女性都能够得到及早发现、及早治疗。近年来宫颈癌疫苗的出现大大降低了9~45岁女性宫颈癌及癌前病变的发生。而绝经后女性主动筛查意识较弱,且对绝经后出血或分泌物异常重视度较低,导致癌前病变筛出率低,临床发现时大多已是中晚期。另外,绝经后女性柱状上皮萎缩,鳞柱交界内移,退缩至宫颈管内,且伴随不同程度的宫颈萎缩,宫颈癌前病变或者宫颈浸润癌的漏诊率较高。现广泛使用的子宫颈细胞学分类系统The Bethesda System(TBS)、HPV检测及宫颈管搔刮(ECC)[2],极大地降低了漏诊率。因此,绝经后女性应该注重HPV的筛查。
李艳梅等[3]研究指出,绝经后组和绝经前组阴道镜下多点活检联合ECC诊断宫颈病变的一致率分别较单纯阴道镜下多点活检提高16.67%(71.57%vs 88.24%)和10.79%(84.31% vs 95.1%);且阴道镜下多点活检联合ECC诊断宫颈病变的灵敏度、特异性、阳性预测值、诊断符合率和Kappa值均较单独阴道镜下多点活检高,推荐绝经后女性阴道镜评估下多点活检联合ECC,提高诊断率。王晓丹等[4]的研究结论与其相似,推荐定期检测HPV感染情况、持续感染情况及阴道镜定位活检,提高宫颈癌前病变检出率。
对于绝经后诊断为高级别病变的女性,根据阴道镜活检选择不同的手术方式,包括CKC、宫颈环形电切术(Loop electrosurgical excision procedure,LEEP)、TCRC及全子宫切除术(Total hysterectomy,TH)等。
CKC是治疗宫颈病变的常规术式之一,其优势是:能够切除足够的宫颈标本,避免电器械对宫颈组织的烧灼,对术后病理结果影响较小[5]。缺点是手术创面较大,术中及术后出血风险较高,愈合后宫颈创面不光整,甚至可能出现宫颈管粘连[6]。
TCRC采用高频混合电流,在直视下观察宫颈病变并切除,同时还能快速止血。莫艳丽等[7]的研究指出,68例行宫腔镜下宫颈锥切术患者平均术中出血量为15.02ml,平均住院周期为4.38天,均较CKC组(23.38ml,5.73天)少,差异有统计学意义(P<0.05),且术后病理符合率、切缘阳性率、宫颈管狭窄及复发率无明显差异,提高手术安全性及HPV阴转率,可临床推广。与相关研究[8~10]结果一致。本研究中,TCRC组患者术中出血量明显少于CKC组,TCRC组手术时长明显较短(P<0.05),差异有统计学意义。两组术后病理符合率及切缘阳性率差异无统计学意义(P>0.05)。刘宇等[11]将114例TCRC及62例CKC患者术中情况进行对比,发现TCRC患者平均术中出血量为(29.80±20.55)ml,CKC组为(14.16±14.10)ml,差异有统计学意义,分析可能与CKC组缝合止血方法有关。
张霄等[12]对750位绝经后宫颈鳞状上皮内病变女性进行研究,依据绝经年限不同对其TCT、活检及锥切病理符合情况进行分析,发现绝经时间≤5年患者的术后病理升级比例明显低于绝经时间>5年者(27.7%、40.3%,OR=1.8,95%CI为1.1~2.8,P=0.029)。而TCT结果为LSIL时,绝经时间≤5年患者的子宫颈锥切术后病理升级比例明显低于绝经时间>5年者(分别为26.3%、60.0%,OR=4.2,95%CI为1.1~15.8,P=0.033),建议绝经时间>5年者,锥切术后病理升级比例升高,应谨慎对待阴道镜活检结果,尤其是TCT为ASCUS及以上时,临床上应引起重视。
综上所述,TCRC治疗绝经后宫颈上皮内瘤变较CKC具有术中出血少、手术时间缩短的优点,不影响术后病理诊断,可作为一种安全、微创的方法应用于临床,对于符合手术条件的患者可优先选择TCRC。

