加入结合胆红素与游离胆红素培养的人脐静脉内皮细胞增殖、迁移及血管生成能力比较
周雪丽,李曼,季文斌,吕振宇,杨燕,朱建
1 蚌埠医学院第一附属医院肿瘤内科,安徽蚌埠 233004;2 蚌埠医学院第一附属医院心内科
血道转移是恶性肿瘤转移的主要途径之一,血管内皮损伤增加了恶性肿瘤经血道转移的概率[1-2]。胆红素(BR)主要来源于血红素的代谢分解,起初被简单认为是一种代谢废物,但随后研究显示其具有抗氧化、抗炎、抗细胞增殖以及影响内皮细胞功能等多种作用[3-4]。正常情况下,BR 来源于衰老和异常红细胞释放的血红蛋白,在肝、脾脏及骨髓中的单核巨噬系统中降解形成;这时形成的BR 主要为游离胆红素(UCB),在血液中与血浆白蛋白结合,经过肝脏代谢后的UCB 与葡萄醛酸结合可形成结合胆红素(CB),并降低与蛋白的亲和性。UCB 含氢键,具有疏水性,而经过酯化作用后的CB失去分子内氢键而具有水溶性或两亲性[5]。不同的理化性质使得UCB容易被肠道细胞重吸收入血,而CB则易被排出体外。目前的研究热点是体内BR 通过抗氧化作用对血管内皮细胞的保护作用,但关于不同类型BR对血管内皮细胞生物学行为的影响及其机制鲜见报道。2021 年7 月—12 月,本研究观察了CB 和UCB对人脐静脉内皮细胞(HUVECs)增殖、迁移、血管生成等生物学行为的影响及其潜在分子机制,以期揭示BR 对血管内皮细胞功能的调节作用,为恶性肿瘤的发病及转移机制提供更多的理论依据。
1 材料与方法
1.1 材料 细胞:HUVECs购自上海中科院细胞库,将其培养于含10%胎牛血清的RPIM 1640 培养基中,置于37 ℃、5%CO2培养箱内常规培养,待细胞生长融合度为80%~90%时,消化传代培养进行后续实验。主要试剂:CB、UCB 及二甲基亚砜(DMSO)均购自美国Sigma 公司,MTS 试剂购自美国Promega 公司,Matrigel 胶购自美国Corning 公司,蛋白激酶B(Akt)、p-Akt308/473、细胞外信号调节激酶(ERK)、p-ERK1/2 抗体均购自美国CST 公司,GAPDH 抗体购自美国Santa Cruz 公司,各种二抗均购自美国Jack⁃son Immuno Research 公司,BCA 蛋白浓度检测试剂盒购自美国Thermo Fisher Scientific 公司,ECL-plus化学发光试剂盒购自美国Millipore公司。
1.2 CB、UCB溶液制备 用DMSO将CB粉剂溶解,储存液浓度为50 mmol/L。取适量的UCB 粉剂溶解于NaOH 溶液中,并使用HCl 溶液将其pH 调整为7.4,储存液浓度为20 mmol/L;将制备完成的CB 及UCB溶液置于−20 ℃冰箱保存待用,在实验前将其冰上解冻,并用RPMI 1640培养基稀释至所需浓度。
1.3 细胞分组处理 取传代培养的HUVECs,加入胰蛋白酶消化后收集对数生长期的细胞,制成单细胞悬液,调整细胞密度为4×105/mL。将细胞接种于96 孔板,每孔100 µL,细胞培养过夜贴壁后,分为CB 组、UCB 组及Control 组。CB 组加入20 µmol/L CB,UCB组加入20µmol/L UCB,Control组加入最大药物浓度的DMSO(体积比≤0.1%)。
1.4 细胞生物学行为观察
1.4.1 细胞增殖能力 采用MTS 法。取三组培养48 h 后的细胞,加入MTS 试剂30 µL,37 ℃、5% CO2培养箱继续培养1 h,酶标仪检测各孔490 nm 处的光密度(OD)值。每组设5个复孔,取平均值。
1.4.2 细胞迁移能力 采用细胞划痕实验。将HU⁃VECs 消化计数后,调整细胞密度为1×106/mL,取2 mL细胞悬液接种于6孔板中,待细胞生长融合度为70%~80%时,用1 mL 无菌枪头沿直尺垂直孔板平面,作出一条平整均匀的划痕。使用无菌PBS洗掉脱落的细胞,参照1.3的方法进行分组处理,分别于培养0、10、24 h在显微镜下拍照,采用Image J软件测量划痕区域的宽度,计算培养10、24 h的划痕修复率。
1.4.3 细胞血管生成能力 采用小管形成实验。将Matrigel 胶按照50 µL/孔加入96 孔板,整个操作过程于冰上进行,结束后置于操作台上,轻轻振荡使胶面平整,置于37 ℃培养箱中保湿孵育过夜。将HUVECs 消化后按照5×105/孔接种于96 孔板,参照1.3的方法进行分组处理,37 ℃培养箱中培养4、8、24 h,显微镜拍照后计数管样结构的数量。
1.5 细胞ERK、p-ERK1/2 及Akt、p-Akt308、p-Akt473蛋白表达检测 采用Western blotting 法。取三组细胞,分组处理30 min后提取各组总蛋白,离心取上清液后进行蛋白定量。取20µg 蛋白加入5×SDS 上样缓冲液中,经水浴变性后进行SDS-PAGE电泳,100 V恒压湿转至NC 膜,5%脱脂牛奶室温封闭30 min,TBST 洗膜3 次。分别加入ERK、p-ERK1/2、Akt、p-Akt308、p-Akt473及内参GAPDH 一抗(稀释比例均为1∶1 000),4 ℃孵育过夜,TBST洗膜3次;加入辣根过氧化物酶(HRP)标记的二抗,室温孵育1 h,洗膜3次。ECL 显影、曝光,利用Image J 软件进行半定量分析,以目的蛋白与内参GAPDH 蛋白条带灰度值的比值计算相对表达量。
1.6 统计学方法 采用GraphPad Prism 8.0统计软件。计量资料采用S-W 正态性检验,呈正态分布以±s表示,多组间比较采用方差分析,两组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖能力比较 UCB组、Control组、CB组的OD 值分别为0.48 ± 0.05、0.81 ± 0.02、1.56 ±0.07,三组OD值依次升高(P均<0.05)。
2.2 各组细胞迁移能力比较 与Control组比较,CB组培养10、24 h 划痕修复率均升高,UCB 组培养10、24 h划痕修复率均降低(P均<0.05)。见表1。
表1 各组培养不同时间点划痕修复率比较(%,±s)

表1 各组培养不同时间点划痕修复率比较(%,±s)
注:与Control组比较,*P<0.05;与UCB组比较,#P<0.05。
?
2.3 各组细胞血管生成能力比较 与Control 组培养4、8、24 h 比较,CB 组管样结构数量均升高,UCB组均降低(P均<0.05)。见表2。
表2 各组培养不同时间点管样结构数量比较(个,±s)
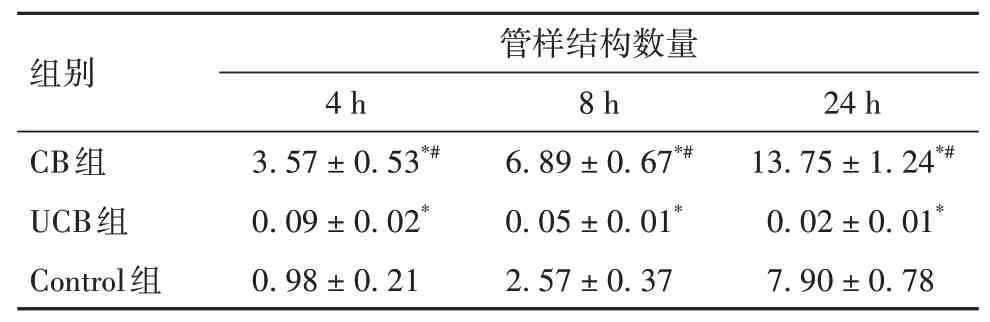
表2 各组培养不同时间点管样结构数量比较(个,±s)
注:与Control组比较,*P<0.05;与UCB组比较,#P<0.05。
?
2.4 各组细胞ERK、Akt 通路相关蛋白表达比较 与Control 组比较,CB 组细胞ERK、Akt 蛋白表达均无明显变化(P均>0.05),UCB 组细胞ERK、Akt 蛋白表达均升高(P均<0.05)。与Control 组比较,CB 组及UCB 组细胞p-ERK1/2、p-Akt308、p-Akt473蛋白表达均升高,且UCB 组升高更明显(P均<0.05)。见表3。
表3 各组细胞ERK、p-ERK1/2、Akt、p-Akt308、p-Akt473蛋白表达比较(±s)
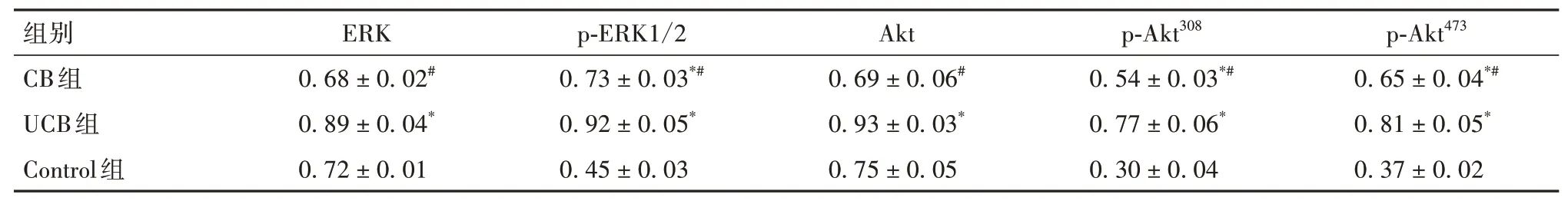
表3 各组细胞ERK、p-ERK1/2、Akt、p-Akt308、p-Akt473蛋白表达比较(±s)
注:与Control组比较,*P<0.05;与UCB组比较,#P<0.05。
?
3 讨论
恶性肿瘤难以控制的主要原因之一是其具有可转移性,肿瘤细胞发生迁移可通过发出信号诱导内皮细胞凋亡来实现这一功能[6]。现有证据表明,BR是一种高生物活性分子,对包括恶性肿瘤在内的多种慢性疾病有不同程度的影响,肠腔中的BR 可诱导结肠腺癌细胞凋亡[7-8]。BR 也被报道可抑制鼻咽癌细胞的侵袭能力,并有成为鼻咽癌患者预后标志物的潜在价值[9]。以上研究提示了BR 在肿瘤的发生发展中发挥了一定的作用,但这种作用机制是否与影响血管内皮细胞功能有关至今尚不明了。
研究表明,BR的形成是血红素加氧酶发挥内皮血管保护作用的关键因素[10]。IKEDA 等[11]采用BR治疗单侧后肢缺血小鼠的研究表明,和对照组相比,BR治疗组小鼠缺血内收肌的血管密度显著升高,但由BR 中的哪一种成分影响血管内皮细胞增殖却不得而知。与此同时,BR也被发现可以诱导细胞周期阻滞和促进细胞凋亡,是一种天然的抗细胞增殖分子[12]。PEYTON 等[13]研究表明,BR 能够抑制大鼠颈动脉损伤后新生内膜的形成,以及人动脉平滑肌细胞的增殖和迁移。然而也有研究发现,BR对神经母细胞瘤的细胞生长、DNA 及蛋白合成等方面均产生了不良作用[14]。本实验研究结果显示,CB 可促进HUVECs 的细胞增殖、迁移和血管生成能力,而UCB对这些生物学行为均表现出抑制效应,提示BR 对HUVECs 细胞生物学行为的不同影响可能是由于成分不同所导致的。TAMAI等[15]研究也发现,CB能够通过增加多药耐药相关蛋白2(MRP2)mRNA 表达,使得大鼠肝癌细胞对顺铂的敏感性降低,而UCB 则不会影响MRP mRNA 表达。正常人体血液中BR 水平为6.1~21.8 µmol/L,而CB 的参考值为1.9~8.0µmol/L[16]。高浓度的UCB 能进入细胞并产生细胞毒性及促氧化作用,如果人体血液中UCB 水平升高且可在脑组织中沉积,将导致脑微血管内皮细胞的完整性及功能受损,引发精神障碍和神经损伤等[17]。UCB 还能够通过线粒体活性氧(ROS)诱导血小板凋亡,导致血小板数量减少。本研究所用的UCB(20µmol/L)浓度超过了人体正常的生理范围,这可能是高浓度UCB 对HUVECs 表现出细胞毒作用的原因之一。
ERK 及Akt 通路可介导炎症、应激、细胞凋亡、细胞周期和细胞生长等多种生物学反应,其中磷酸化的ERK 及Akt 与肿瘤细胞的增殖、侵袭及血管生成能力均密切相关。研究显示,BR 能够激活Akt 通路而促进小鼠体内血管密度升高以及人主动脉内皮细胞增殖[11];BR 也被报道通过抑制Akt及ERK 通路抑制心肌细胞损伤及凋亡[18]。因此,BR可影响这两条通路的激活状态,进而影响细胞生长。本研究结果显示,CB 及UCB 均可不同程度激活ERK1/2 及Akt 通路,其中CB 可促进HUVECs 内相应磷酸化蛋白(包括p-ERK1/2 和p-Akt308、p-Akt473)表达增加,而ERK 与Akt 表达无明显改变;但UCB 在促进HU⁃VECs细胞p-ERK1/2、p-Akt308、p-Akt473蛋白表达的同时,总的ERK 与Akt 表达也有增加。我们推测,CB促进HUVECs 细胞增殖的机制可能与ERK1/2 及Akt通路激活有关,而UCB 虽激活了上述通路,本应该是促进细胞增殖的,但可能由于本研究所用UCB浓度过高,从而产生了细胞毒性作用,最终反而对HUVECs的生物学行为表现为抑制。
综上所述,CB 可促进HUVECs 的细胞增殖、迁移和血管生成能力,其机制可能与激活ERK1/2 及Akt 信号通路有关,而UCB 对HUVECs 的上述生物学行为则具有相反的作用。但本研究中使用的CB类似于从胆汁中纯化的胆红素葡萄糖醛酸苷,并未包含其他类型的CB,且本研究所用UCB 浓度过高,缺乏无毒浓度的UCB 对HUVECs 增殖、迁移以及血管生成能力影响的数据。因此,未来对于不同类型BR的生物学行为和机制还需进行深入研究,可能对BR的临床价值有更为深入的认识,并为恶性肿瘤的诊治提供新的思路和见解。

