间充质干细胞对原发免疫性血小板减少症患者CD4+ T细胞分化及Th1/Th2因子表达的影响*
肖建红,张阳春,刘泽林
1华中科技大学协和深圳医院血液科,深圳 518052 2深圳市宝安区人民医院骨科中心,深圳 518101 3南华大学附属第一医院血液科,衡阳 421001
原发免疫性血小板减少症(primary immunologic thrombocytopenia,ITP),也称特发性血小板减少性紫癜,是临床最为常见的一种获得性自身免疫性出血性血液病。目前,治疗ITP的常规方法仍以激素、免疫抑制剂、脾切除等为主,但远期疗效差、不良反应多等问题较为突出,同时对那些激素和脾切除治疗均无效的难治性ITP患者至今尚无理想的防治办法[1-3]。因此,从机制入手,探索新的防治方法尤为重要。目前认为,ITP的发生发展主要与机体CD4+T淋巴细胞的免疫失衡密切相关,且已明确ITP患者的CD4+T细胞亚群Th1/Th2处于免疫失衡状态,Th1因子比例明显上调[4-5]。由于Th1因子的异常升高,Th2因子表达下降,促使B淋巴细胞增殖并转化为浆细胞,产生大量的血小板抗体[5]。
在调控机体免疫失衡的治疗策略上,关于间充质干细胞在多个自身免疫性疾病中作用的研究取得显著进展[5-7]。脂肪来源的间充质干细胞(adipose-derived mesenchymal stem cells,ADSCs)是从脂肪组织中分离得到的一种具有多向分化潜能的间充质干细胞,在生物个体之间的免疫原性较低,能够抑制细胞免疫反应、诱导免疫耐受及降低炎症损伤[8]。鉴于此,我们前期研究发现外源性ADSCs输注对ITP小鼠具有免疫调节作用,能改善Th1/Th2免疫失衡状态,提高机体血小板水平,但其具体机制未明[5,9]。本实验拟通过ADSCs与CD4+T细胞共培养,探讨共培养后CD4+T细胞分化、特异性转录因子GATA-3/T-bet表达水平,Th1/Th2相关细胞因子表达改变及其在ITP中的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 脂肪组织的获取 选取于华中科技大学协和深圳医院外科手术室行抽脂或相关部位脂肪组织切除的5名志愿者(其中女性4名,男性1名),年龄20~41岁,排除免疫系统疾病及影响免疫系统的其他疾病。所取组织为手术室无菌条件下获取的无进一步临床应用价值的脂肪组织。志愿者知情同意,实验获我院医学伦理委员会批准。
1.1.2 临床对象的筛选 选取2019年7月至2020年11月我院血液科收治的ITP患者6例,男3例,女3例,中位年龄39岁(18~55岁),均为初治患者,PLT 14(1~29)×109/L,所有研究对象均符合《成人原发免疫性血小板减少症诊断与治疗中国指南(2020年版)》的诊断标准[10],标本采集前未接受过糖皮质激素和免疫抑制剂治疗。招募健康对照者6例(男3例、女3例),中位年龄37(29~50)岁。本研究经医院医学伦理委员会批准,所有研究对象及家属知情同意并签署知情同意书后采集外周血20 mL,肝素抗凝。
1.2 方法
1.2.1 ADSCs分离、纯化及培养 将新鲜脂肪组织迅速送实验室,去除肌肉、筋膜等其他组织,剪成小块后加入胶原酶消化1 h,再用低糖DMEM培养液终止消化。经3次离心、弃上清液及重悬,去除浮游脂粒。最后放于37℃、5%CO2的饱和湿度培养箱培养,第2天换液,再每隔2 d换液1次。细胞生长到80%~90%融合后,按1/3传代。依次传代、纯化及扩增,观察细胞形态。参考前期实验方案,选取增殖较稳定的第5代(P5)细胞,用流式细胞仪检测细胞表面抗原标记CD14/29/31/34/44/45/71/105/106/117的表达,具体实验步骤同前期研究[11]。
1.2.2 ADSCs成脂诱导分化及鉴定 以密度为4×103/cm2的P5代细胞接种于事先置于6孔板内的爬片。待细胞增殖融合至80%时,去除孔板里营养液,诱导成脂细胞组每孔添加成脂诱导剂2 mL,放置37℃、5%CO2的饱和湿度培养箱培养。培育3 d后,以成脂诱导保持液处理24 h。3次循环后,再以成脂保持液处理1周,每3 d换1次培养液。对照组加入含10% FBS的高糖DMEM培养液。19 d后进行油红O染色检测脂肪形成。首先去除成脂保持液,细胞爬片进行PBS清洗5 min,清洗3次。4%多聚甲醛固定15 min。再次进行PBS清洗5 min,清洗3次。加入油红O染色15 min。60%异丙醇漂洗30 s,吸除过剩的染料。最后PBS清洗3次,镜下检查并拍照。
1.2.3 ADSCs成骨诱导分化及鉴定 以密度为4×103/cm2的P5代细胞接种于事先置于6孔板内的爬片。待细胞增殖融合至80%时,去除孔板里营养液,诱导成骨细胞组每孔添加成骨诱导剂2 mL,放置37℃、5%CO2的饱和湿度培养箱培养。每2 d换1次培养液,持续诱导3周。对照组加入含10% FBS的低糖DMEM培养液。3周后进行茜素红染色检测钙质沉积。首先去除成骨诱导剂,细胞爬片进行PBS清洗5 min,清洗3次。4%多聚甲醛固定30 min。再次进行PBS清洗5 min,清洗3次。加入茜素红染色剂染色30 min。双蒸水清洗3次,每次5~10 s。茜素红分化剂清洗1次15 s。最后PBS清洗3次,镜下检查并拍照。
1.2.4 CD4+T淋巴细胞分选 将采集的ITP患者及健康对照者外周静脉血20 mL,肝素抗凝;用Ficoll分层液法密度梯度离心获取外周血单个核细胞(peripheral blood mononuclear cell,PBMC);1×107PBMC重悬于80 μL分选Buffer缓冲液中,加入20 μL CD4+T细胞免疫磁珠,与PBMC重悬液充分混匀,然后放置冰箱4 ℃孵育15 min;在PBMCs重悬液中加入3 mL磁珠分选Buffer液混匀,预先制冷离心机于4 ℃,1000 r/min离心10 min后弃上清液,用磁珠分选Buffer液500 μL重悬细胞沉淀;放置磁珠分选柱于磁力架上,加入500 μL磁珠分选Buffer洗涤分选柱,以免产生气泡;待流尽洗涤液后,缓慢加入细胞重悬液,待细胞重悬液缓慢经过后,用500 μL Buffer液冲洗3遍磁珠分选柱,收集过滤液;分选柱中加入1 mL Buffer液,快速将Buffer经分选柱打出并留置于15 mL离心管中,1000 r/min离心10 min后,获取阳选富集的细胞,PBS重悬并细胞计数;将APC小鼠抗人CD4+流式抗体或其同型对照IgG-APC标记分选后的CD4+T细胞,避光25℃孵育25 min,PBS重悬后1500 r/min离心10 min后洗涤2次;流式细胞仪检测CD4+T细胞纯度,获得阳性细胞(纯度>98%)。
1.2.5 ADSCs与CD4+T细胞共培养 将培养至P5代的ADSCs铺于24孔板,调整细胞数量为1×104/孔,每孔加入1 mL完全DMEM;24 h后观察细胞,待细胞融合达80%后,吸取完全培养液;将CD3 mAb预先包被24孔板中,调整CD4+T细胞数量为1×105/孔;两种细胞在RPMI 1640培养液混合,ADSC与CD4+T细胞比例为1∶5,同时加入植物血凝素(PHA,50 mg/L)。选取ITP患者及健康对照者CD4+T细胞,根据实验目的需要设置组别:T+PHA组、T+PHA+ADSCs组、T细胞单独培养组。干细胞与CD4+T细胞共培养的细胞比例设置、培养时效、共培养方法及实验分组参考既往文献报道[12-13]。
1.2.6 细胞因子检测 收集细胞上清液,ELISA检测各组上清液中IFN-γ、IL-2、IL-4、IL-10细胞因子水平。检测步骤按ELISA试剂盒说明书进行,每个样本和标准品均设3个复孔,酶标检测仪读取波长450 nm处的吸光度(A)值,绘制标准曲线,计算各种细胞因子含量。
1.2.7 Th亚群细胞比例检测 流式细胞仪检测Th1/ Th2细胞,将CD4、IFN-γ阳性定义为Th1细胞,CD4、IL-4阳性定义为Th2细胞。将细胞重悬后,经染色和抗体表面标记后,重新悬浮在500 μL的PBS中,然后上机检测。对流式细胞仪进行光流路质量调控和双色荧光补偿,使仪器各项指标在质控允许值范围。检测时首先根据前向(FSC)和侧向(SSC)散射光信号对淋巴细胞群进行设门,采用Cell ques软件分析检测结果。
1.2.8 Th相关mRNA基因检测 荧光定量PCR检测共培养前后调控Th细胞分化的特异性转录因子GATA-3/T-bet表达水平,及共培养前IFN-γ、IL-2、IL-4、IL-10基因表达,参考既往文献报道[12,14],引物设计序列见表1。细胞总RNA提取按常规操作进行,最后加DEPC水溶解RNA,-80℃保存备用。PCR反应体系25 μL,含cDNA 1 μL,10×缓冲液2.5 μL,25 mmol/L MgCl 24.5 μL,10 mmol/L dNTP 1.0 μL,引物0.25 μL,Taq DNA聚合酶1 μL,DEPC水14.75 μL。PCR buffer成分:10 mmol Tris-HCl(pH8.0),50 mmol KCl,2 mmol MgCl2。PCR条件:93℃ 3 min,然后93℃ 15 s,55℃ 30 s,72℃ 30 s,共40个循环。

表1 Th细胞特异性转录因子及相关细胞因子引物序列Table 1 Th cell-specific transcription factors and primers of related cytokines
1.3 数据统计处理
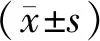
2 结果
2.1 ADSCs细胞形态观察
刚分离培养的ADSCs形态呈小圆形,夹带少量的脂滴及红细胞成分,24 h换液后开始贴壁,大部分贴壁细胞呈多角形、梭形等。48 h后贴壁细胞分裂增殖明显,大多表现为长梭形,随着培养时间延长细胞呈集落式生长,漩涡状排列。经过消化、传代,接种后即时观察,12 d左右可见细胞融合达85%。传代后的细胞,经过5~6 d,细胞生长融合度可达85%,典型漩涡状、集落式生长(图1A)。传代后细胞呈梭形,核居中,有单核或双核仁,核呈圆形或卵圆形(图1B)。传代后平均扩增时间为5 d。经1~2次传代后,ADSCs形态基本一致,增殖良好,能稳定传代10次以上。参考我们前期实验方案,随着传代次数增加,阳性CD分子表达率越来越高,细胞愈加纯化,选取生长状态良好的P5代ADSCs进行共培养实验。
倒置显微镜下观察P5代ADSCs,接种后增殖迅速,贴壁生长,呈集落状分布;高倍镜下可见细胞呈梭形,核居中,有单核或双核仁,核呈圆形或卵圆形;A:×100;B:×200图1 ADSCs形态学观察Fig.1 Morphological observation of ADSCs
2.2 ADSCs表面抗原标记物检测
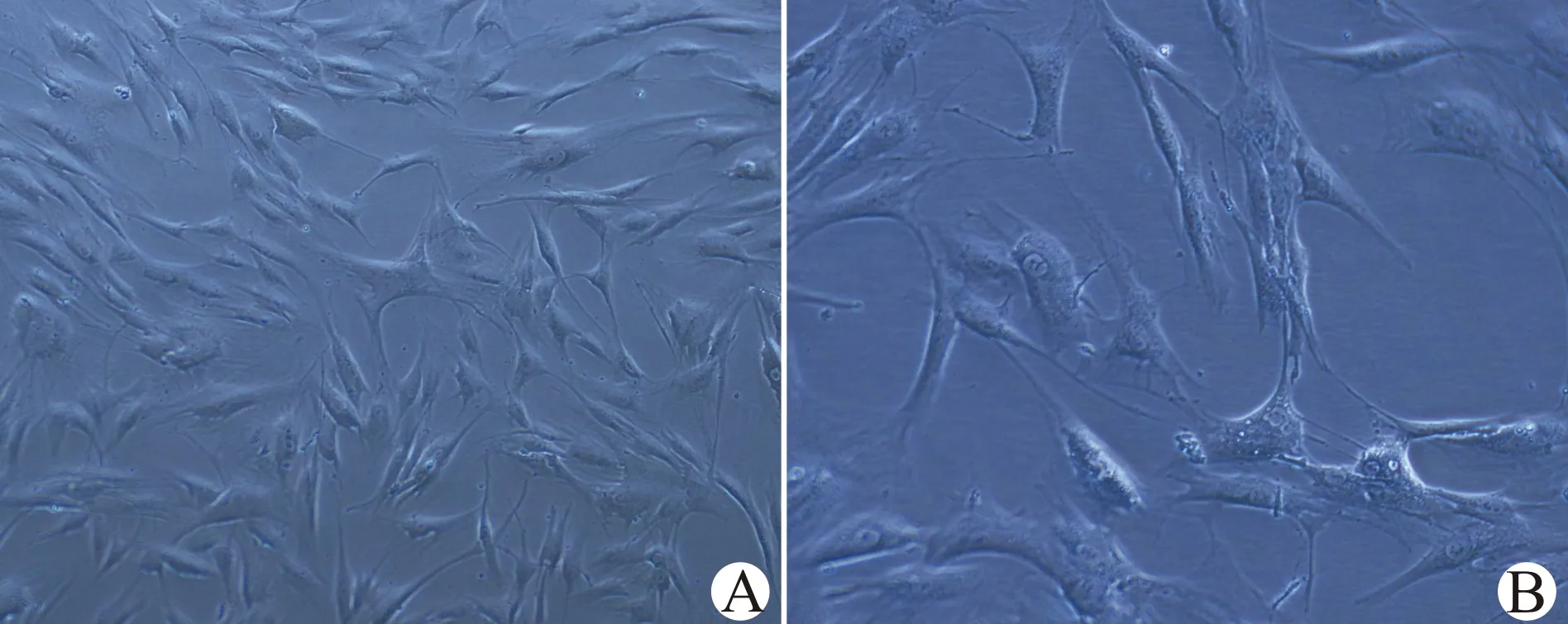
选取的P5代ADSCs细胞表面抗原标记CD29、CD44和CD105表达强阳性,分别为99.54%、99.78%和99.58%;低表达或不表达造血系统及内皮系统抗原标记CD31、CD34、CD45、CD106及CD117,同时,ADSCs低表达免疫原性抗原标记CD14和CD71(图2)。
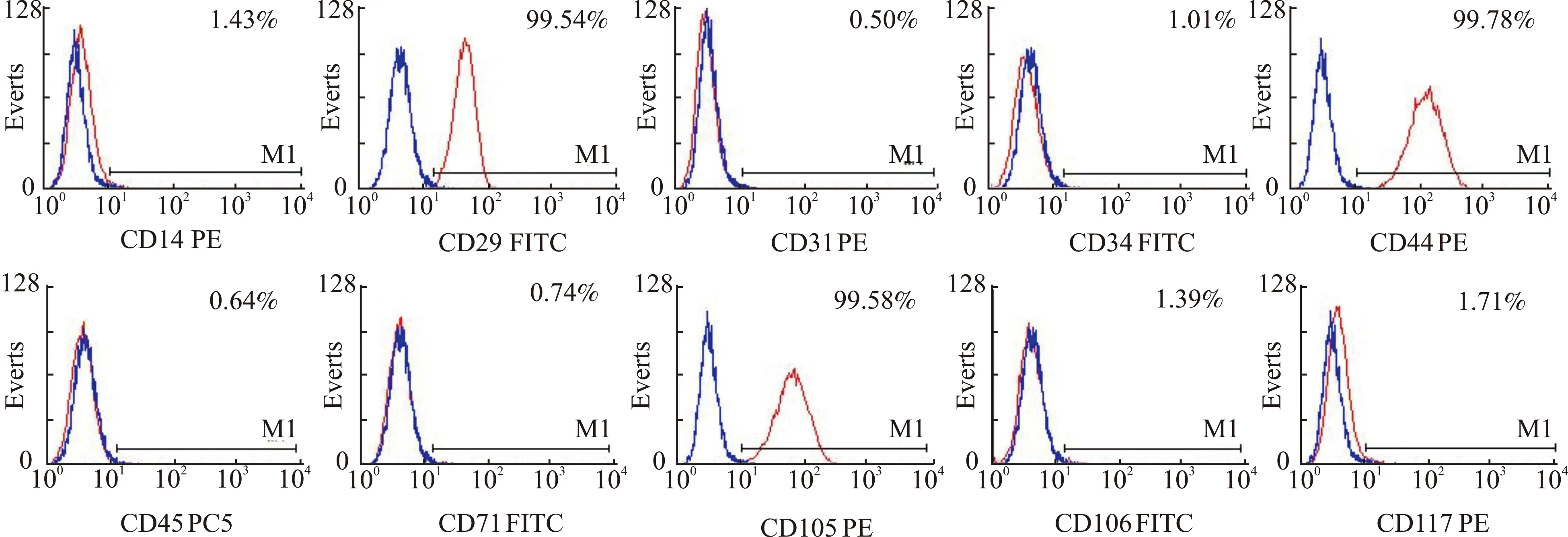
图2 ADSCs细胞表面抗原标记表达情况Fig.2 Expression of cell surface antigen markers of ADSCs
2.3 ADSCs体外多向分化潜能测定
2.3.1 ADSCs成脂诱导分化 P5代ADSCs贴壁稳定后,加入成脂诱导液诱导3 d再镜下观察,细胞内出现脂肪小滴,部分胞膜有环形细颗粒层表现,继续培养,脂肪滴增大及颗粒增多。增大范围由细胞膜向细胞核靠近,细胞形态依然呈梭形,细胞体积变宽大。
14 d后脂肪滴进一步增大增多及融合,油红O染色呈现有红色脂肪滴(图3)。
图3 ADSCs经诱导成脂分化后油红O染色可见细胞内红色脂肪滴(×100)Fig.3 After adipogenic differentiation of ADSCs,red adipose droplets could be seen by oil red O staining(×100)
2.3.2 ADSCs成骨诱导分化 P5代ADSCs贴壁稳定后,加入成骨诱导液诱导3~4 d再镜下观察,细胞体积较前明显增大,细胞形态呈条索状;继续培养7 d后,形态结构发生明显改变,由条索形渐变为多边形,细胞胞质内颗粒增多明显;14 d后颗粒充满胞质,细胞之间出现钙质沉积,再继续培养7 d,经茜素红染色可见大量红色钙结节(图4)。
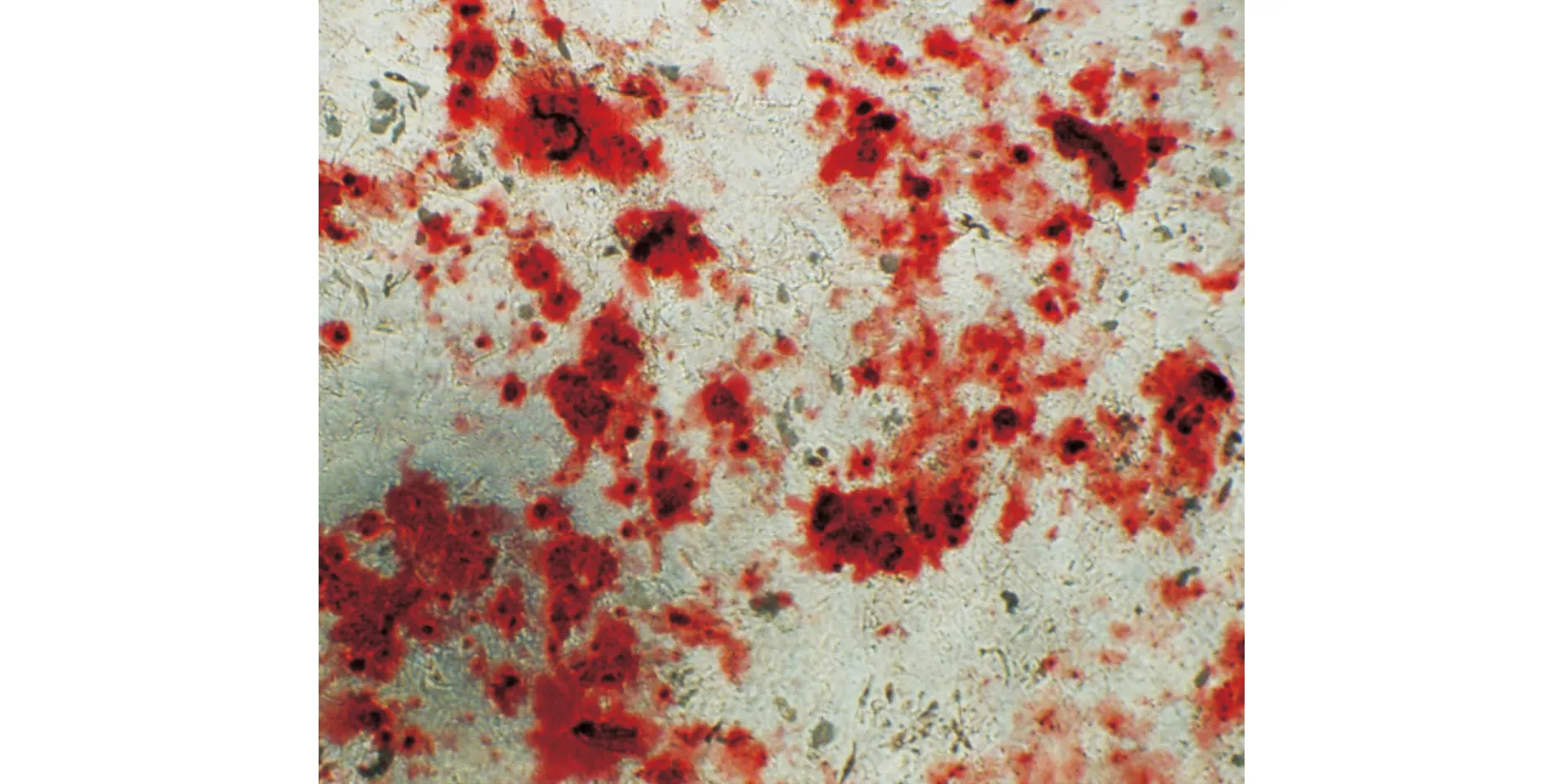
图4 ADSCs经诱导成骨分化后茜素红染色可见钙结节形成(×100)Fig.4 Calcium nodules were observed by alizarin red staining after osteogenic differentiation of ADSCs(×100)
2.4 ADSCs与CD4+T细胞共培养
2.4.1 ADSCs对CD4+T细胞分化的影响 对分选后的健康对照及ITP患者的CD4+T细胞在共培养前进行流式细胞术检测,发现ITP患者淋巴细胞Th1占CD4+T细胞的比例与健康对照相比偏高(P<0.05);Th2占比低于健康对照(P<0.05);Th1/Th2明显高于健康对照(P<0.01)(表2)。ADSCs与CD4+T细胞共培养4 d后,通过流式细胞术检测共培养后Th1、Th2细胞占CD4+T细胞的比例发现,ITP患者共培养后Th1占比与培养前相比有所下降(P<0.05);Th2占比高于培养前(P<0.05);Th1/Th2较共培养前显著降低(P<0.01)(表3)。健康对照共培养后Th1占比、Th2占比及Th1/Th2与共培养前比较,差异均无统计学意义(均P>0.05),见表4。通过RT-PCR检测共培养前、后调控Th细胞分化的特异性转录因子GATA-3/T-bet表达水平,发现ITP患者CD4+T细胞T-bet明显高于健康对照,共培养后的表达低于共培养前(均P<0.01);而ITP患者特异性转录因子GATA-3的表达明显低于健康对照,共培养后的表达高于共培养前(均P<0.01)(图5)。
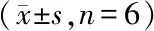
表2 ITP患者及健康对照者CD4+ T细胞共培养前Th1、Th2细胞占比Table 2 Cell proportions of Th1 and Th2 in ITP patients and healthy controls before CD4+ T cell
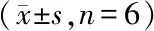
表3 ITP患者CD4+ T细胞共培养前、后的Th1及Th2细胞占比Table 3 Cell proportions of Th1 and Th2 in ITP patients before and after CD4+ T cell
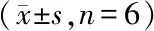
表4 健康对照者CD4+ T细胞共培养前、后的Th1及Th2细胞占比Table 4 Cell proportion of Th1 and Th2 in healthy controls before and after CD4+ T cell
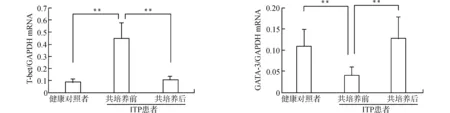
**P<0.01图5 健康对照者及ITP患者CD4+ T特异性转录因子GATA-3/T-bet在共培养前后的表达Fig.5 Expression of CD4+T-specific transcription factor GATA-3 / T-bet in the normal controls and ITP patients before and after co-culture
2.4.2 ADSCs对ITP患者CD4+T细胞Th1/Th2细胞因子表达的影响 通过RT-PCR检测发现,在新鲜分离的ITP患者CD4+T细胞中,IFN-γ、IL-2表达水平较健康对照高(均P<0.05),而IL-4、IL-10表达水平很低(均P<0.05)(图6)。在共培养体系中,PHA刺激下,动态观察ITP患者CD4+T细胞与ADSCs共培养后相关细胞因子表达,通过对细胞上清液的ELISA检测发现,在第4~12天,相对于单独培养组,ADSCs IL-4、IL-10的表达上升,同时IFN-γ、IL-2表达下降(均P<0.05)(图7)。
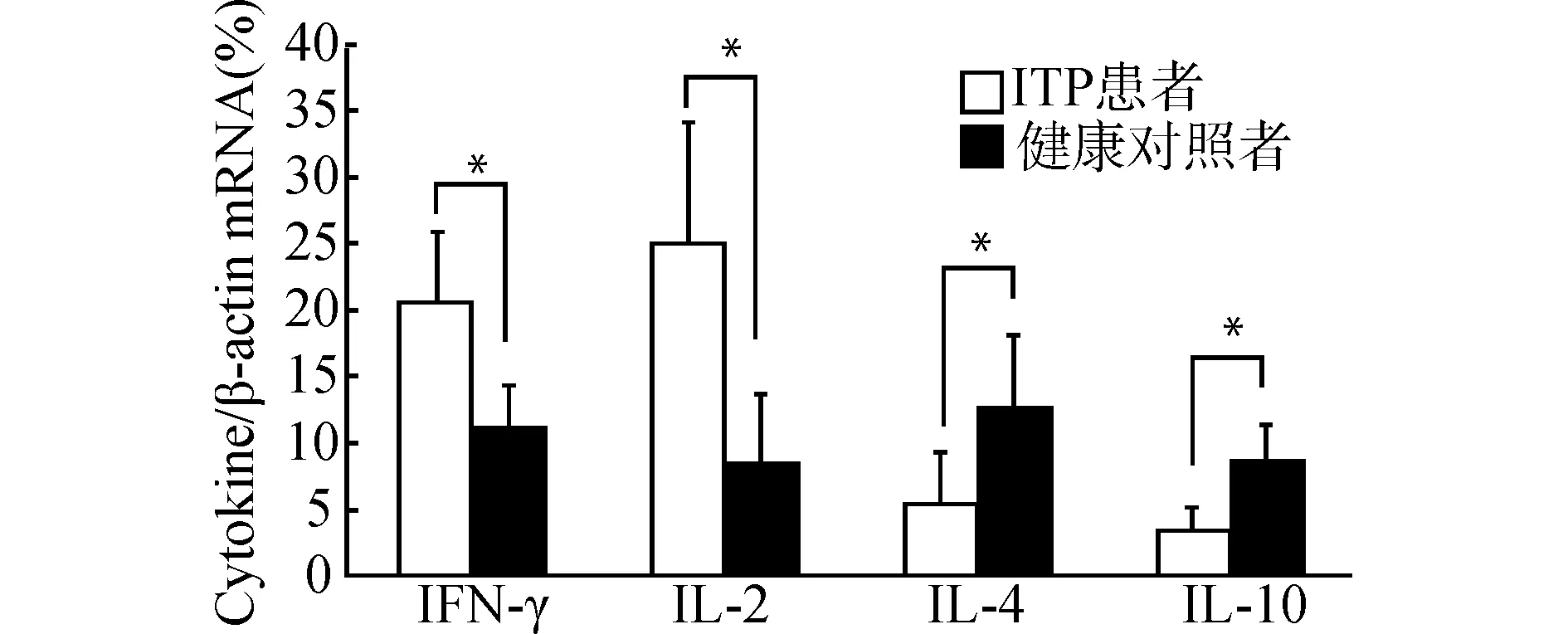
*P<0.05图6 ITP患者及健康对照CD4+ T细胞共培养前Th1/Th2相关因子表达Fig.6 Expression of Th1/Th2 related factors in CD4+ T cells of ITP patients and normal controls before co-culture
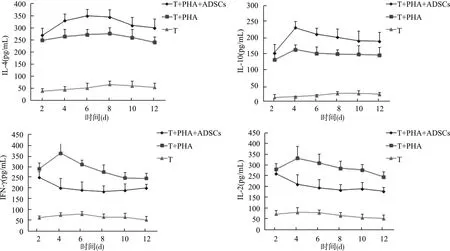
图7 ITP患者CD4+ T细胞与或不与ADSCs共培养Th1/Th2相关因子表达Fig.7 Expression of Th1/Th2 related factors in CD4+ T cells of ITP patients with or without ADSCs culture
3 讨论
ITP是临床上最为常见的一种自身免疫功能异常导致的器官特异性出血性血液病,其直接原因是由于自身抗血小板抗体的产生,导致血小板破坏增加及血小板生成减少或抑制[4,15-16]。针对自身反应性的淋巴B细胞产生的自身抗体被认为是经典的ITP发病的直接机制,但是近年研究发现B细胞产生的自身抗体离不开特异性自身反应性T细胞的辅助,被称为辅助性T细胞(Th),因其表达CD4+分子,也称CD4+T淋巴细胞。目前认为,ITP的发生发展主要与机体CD4+T淋巴细胞的免疫失衡密切相关[4-5,17]。虽然对ITP的作用机制较前有了更深的认识,但由于其具体病理机制迄今尚不完全清楚,同时对常规激素和脾切除治疗无效的难治性ITP患者至今尚无理想的防治方法,因此,从新的视角探索防治ITP的新方法及探讨相关机制始终是血液科医师一个重要的研究方向。
CD4+T细胞的异常分化及其产生的细胞因子失衡在ITP发病中的作用机制越来越受到广泛关注。CD4+T细胞按其不同的生物学特性和产生细胞因子的种类分成4种亚群:Th1型、Th2型、Th3型或调节性T细胞(Treg)和随后发现的Th17细胞,其中在免疫调节中起主要作用的是Th1细胞和Th2细胞[18]。Th1以分泌IL-2、IFN-γ、TNF-β等细胞因子为特征,主要促进T淋巴细胞增殖活化,介导固有免疫等细胞免疫反应[18]。同时在ITP的发生中,IFN-γ细胞因子的分泌增加,可直接导致B淋巴细胞分化成熟为浆细胞,产生血小板抗体异常增多[9,19]。Th2以分泌IL-4、IL-10、IL-6等细胞因子为特征,主要促进B淋巴细胞增殖分化,介导体液免疫反应。研究发现,ITP患者的Th1/Th2细胞处于失衡状态,是一种Th1细胞占优势的自身免疫性疾病,其Th1细胞因子比例也高于正常[9,14,20]。在共培养前,通过对ITP患者及健康对照者检测,我们再次证实,ITP患者Th1占CD4+T细胞的比例较健康对照偏高,差异有统计学意义(P<0.05),Th2占比低于健康对照(P<0.05),同时两者相比ITP患者Th1/Th2显著性高于健康对照。通过对Th1/Th2细胞因子的基因检测,我们亦证实:与健康对照相比,IFN-γ、IL-2表达水平较高,而IL-4、IL-10表达水平很低(均P<0.05),Th1/Th2细胞因子表达趋势与Th1/Th2细胞比基本相同。结合我们研究结果,再次阐明在ITP患者由于Th1细胞及其因子IL-2、IFN-γ表达水平异常升高,Th2及其细胞因子IL-4、IL-10表达水平下降,促使B细胞增殖并转化为浆细胞,导致自身抗血小板抗体的大量产生。
干细胞的生物免疫治疗目前是一种治疗自身免疫性疾病的全新策略,尤其在调控机体Th1/Th2免疫失衡的治疗策略上,间充质干细胞的应用已在多个自身免疫性疾病取得显著进展[21-23]。这一生物学治疗的转变,改变了激素及免疫抑制剂等基础治疗所面对的不良反应、副作用及安全性等问题,临床应用前景广阔。ADSCs是从脂肪组织中分离得到的一种具有多向分化潜能的间充质干细胞,在生物个体之间具有较低的免疫原性,能够抑制机体过度的细胞免疫反应,调节免疫紊乱,同时可诱导免疫耐受及降低炎症损伤[23]。相对于其他来源的间充质干细胞,ADSCs具有来源充足、较低的生物个体间免疫原性等诸多优势[9,23]。鉴于此,我们前期研究发现通过外源性输注人来源的ADSCs对ITP小鼠具有明显的治疗作用,能改善Th1/Th2免疫失衡状态,提高ITP小鼠血小板水平,但其具体机制尚未完全阐明[5,9]。因此,我们通过对ADSCs与CD4+T细胞共培养进一步探讨其在ITP中的作用机制。通过两者的共培养,我们发现ADSCs可直接作用于ITP患者的CD4+T淋巴细胞,抑制CD4+T细胞向Th1转化,促使其向Th2分化,且与共培养前的细胞占比相比差异有统计学意义,而对健康对照者CD4+T淋巴细胞分化的诱导作用则不明显。在共培养体系中,通过对细胞上清液的检测发现,ADSCs增加了ITP患者Th2细胞因子IL-4、IL-10的表达,同时Th1细胞因子IFN-γ、IL-2表达下降。由此说明,ADSCs可直接作用于CD4+T淋巴细胞,改善ITP患者Th1/Th2及其细胞因子免疫失衡状态,提高机体血小板水平。
近年研究发现,Th1/Th2及其细胞因子的平衡与其特异性转录因子GATA-3和T-bet关系密切[24]。GATA-3是一种细胞谱系特异性因子,是T细胞发育中最重要的转录调节因子之一。GATA-3能下调IFN-γ的表达,同时抑制Th1细胞亚群和促进Th2亚群的发展,研究发现几乎所有Th2细胞因子的转录都需要GATA-3的参与[25]。T-bet属于T-box家族的转录因子,表达于包括骨髓、脐血祖细胞及干细胞在内的血细胞,主要为CD4+T细胞[26]。T-bet通过促进IFN-γ基因表达发挥其对Th1细胞发育的正调控作用,其高表达与Th1细胞因子的升高相吻合[26]。正由于GATA-3正调控Th2和T-bet正调控Th1,二者最终决定CD4+T细胞向Th1/Th2的转化比例[24]。在共培养前,我们通过对特异性转录因子GATA-3/T-bet表达检测发现,ITP患者CD4+T细胞T-bet表达明显高于健康对照者,同时GATA-3亦明显低于健康对照者,这一结果与既往文献报道一致。通过与ADSCs直接共培养,ITP患者T-bet表达降低,而GATA-3表达上调。由此我们推测,ADSCs通过对GATA3/T-Bet的转录调控,影响CD4+T细胞分化,改善Th1/Th2及其细胞因子失衡。
综上所述及结合我们既往动物实验,ITP机体存在CD4+T细胞亚群免疫失衡,主要表现为Th1偏移。通过ADSCs与ITP患者CD4+T细胞的共培养发现,ADSCs可能通过对特异性转录因子GATA-3/T-bet的转录调控,抑制Th1细胞分化、促进Th2细胞分化,调节Th1/Th2细胞因子表达,继而改善免疫失衡。因此,进一步探求ADSCs在ITP患者中的具体相关作用机制,为确定ADSCs作为难治性ITP的新方法提供科学依据,具有重要的临床意义。

