结合生物信息数据分析FOXC1在胰腺导管腺癌中的表达及意义*
曾 强,陈林莺,2△,李国平,蔡秀虹,罗 胜
1福建医科大学附属第一医院病理科,2福建省癌症和神经退行性疾病转化研究重点实验室,福州 350005
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是高度恶性的消化道肿瘤,发病率约居所有恶性肿瘤的第10位,但死亡率却高居第4位,预计到2030年将跃居到第2位[1]。PDAC发生的分子基础与一些关键基因的分子改变有关,其综合治疗效果欠佳,寻找新的生物标记并能有效评估患者预后可能是PDAC防治研究的重要内容。
转录因子叉头框蛋白C1(forkhead box protein C1,FOXC1)是叉头转录因子(TFs)家族成员之一,基因定位于6p25,只含1个外显子,编码的蛋白由533个氨基酸组成,与其它转录因子类似,FOXC1含有N-末端转录激活结构域、叉头DNA结合结构域、转录抑制结构域和C-末端转录激活结构域,能直接与DNA结合并调节多种基因表达[2]。在生理情况下,FOXC1参与胚胎发育、器官分化、维持干细胞生态及血管生成等过程,病理状态下参与多种肿瘤的发生发展[3],但在胰腺癌中的研究仅限于小样本的研究报道。
因此,本研究采用免疫组织化学染色方法对石蜡包埋PDAC组织芯片进行FOXC1蛋白染色,并应用生物信息学技术分析FOXC1在胰腺癌中的表达情况,从基因及蛋白水平探讨FOXC1表达与PDAC临床病理特征及预后的关系,为优化PDAC的综合治疗及术后管理提供实验依据。
1 材料与方法
1.1 标本来源
收集自2006年至2016年在福建医科大学第一附属医院诊断并接受肿瘤切除手术的164例胰腺导管腺癌患者资料。复习所有肿瘤组织病理切片,评估组织学分级、肿瘤大小、淋巴结转移和神经侵犯这4项病理特征,其他信息包括年龄、性别均摘自医院病历系统。总生存期(OS)定义为从最初诊断到死亡的时间间隔(截止随访时间是2017年12月31日),无疾病进展生存期(DFS)定义为从最初诊断日期到首次复查CT或其他检查手段发现肿瘤复发或患者死亡的持续时间。本研究获得福建医科大学第一附属医院伦理委员会批准。
1.2 组织芯片(TMA)构建和免疫组化染色
每个病例取2个直径2.5 mm的肿瘤组织和1个正常组织构建组织芯片,连续4 μm切片,其中1张行苏木精-伊红染色以确认肿瘤存在。单克隆抗体FOXC1(克隆号:LS-B1800/10323,购自美国LSBio公司,稀释度1∶5000)。组织芯片经脱蜡、水化和抗原修复(EDTA pH 8.0,37℃ 30 min)后,用DakoEnVision FLEX+检测系统(Dako,丹麦)和DAB检测试剂盒(Ventana,美国)进行染色。染色步骤按说明书进行,所有切片均经苏木精复染。
1.3 组织病理评估标准和免疫组化染色结果评价
根据WHO(2019)消化系统肿瘤分类标准,将PDAC组织学分级分为高、中和低分化;肿瘤大小以肿瘤主体最大径2 cm为界;淋巴结转移为胰腺周围淋巴结被膜内出现肿瘤细胞;神经侵犯为肿瘤细胞部分侵及或包绕神经纤维组织。FOXC1蛋白免疫组化染色评分根据阳性细胞染色强度得分(无0分,弱阳1分,中等强度2分,强阳3分)及阳性细胞百分比得分(无为0分,<10%为1分,≥10%~50%为2分,>50%为3分),两项相乘,得分介于0~12分之间,0~3分判读为阴性,4~9分判读为阳性。对所有组织芯片上的每例标本进行评估,每组实验都附有阳性对照,所有免疫组化结果均由两名高年资病理医师观察后作出判断。
1.4 在公共数据库中调取FOXC1在胰腺癌中的表达情况
FOXC1在人体不同正常组织中的表达水平数据来自NCBI数据库(https://www.ncbi.nlm.nih.gov/gene/),Oncomine(http://www.oncomine.org)拥有高效且强大的分析函数集,可以为研究人员从715个数据集和86733个样本中计算基因表达特征和基因集模块。TIMER 2.0(http://timer.cistrome.org)是肿瘤免疫细胞及基因组特征的在线分析网站。
1.5 生存分析
通过GEPIA 2.0(http://gepia2.cancer-pku.cn/)数据库,检索TCGA和GTEX数据中FOXC1在PDAC组织样本和正常样本中的RNA表达差异数据,基于GTEX和TCGA数据库,通过标准处理方法分析差异基因表达和患者存活率,选择“中位数”作为生存分析组的临界值。Kaplan-Meier绘图平台(http://kmplot.com/analysis/)是一种在线生存分析工具,可快速评估基因表达对21种癌症类型的影响,包括胰腺癌。OncoLnc(http://www.oncolnc.org)可研究21种癌症之间的生存相关性,根据基因表达的中位数将PDAC患者分为FOXC1高表达组和FOXC1低表达组。
1.6 FOXC1基因相关分子通路分析
利用TCGA数据库进行基因本体(GO)、基因富集分析(Gene Set Enrichment Analysis,GSEA)和京都基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析FOXC1在胰腺癌中的潜在分子功能。利用TCGA数据库,根据FOXC1表达水平的中位数,将胰腺癌患者分为高表达组和低表达组,用R语言的limma软件包分析各组间的差异表达基因(DEGs),LogFC>1且Padj<0.05的DEGs是显著上调基因,而LogFC<-1且Padj<0.05的DEGs是显著下调基因,将差异基因集作为一个整体进行GO、KEGG和GSEA富集分析。将P<0.05和矫正后的P值(FDR)<0.05的基因集作为显著富集的基因集。
1.7 统计学方法
使用IBM SPSS 22.0软件分别进行统计和图表分析,卡方检验和Fisher精确概率法检验分析FOXC1与患者年龄、性别、肿瘤大小、组织学分级和神经侵犯的相关性,Kaplan-Meier和多变量Cox回归分析评估生存数据,以P<0.05为差异具有统计学意义。
2 结果
2.1 通过生物信息学技术分析FOXC1基因在胰腺癌组织中的表达
FOXC1基因的表达水平在不同组织或器官中存在差异,来自NCBI的数据显示,FOXC1在正常胰腺组织中的表达比34种人体组织,包括唾液腺、视网膜、肾脏、胆囊、心肌、乳腺、脂肪组织和皮肤等器官或组织低(图1A)。
通过Oncomine数据平台分析表明,FOXC1在乳腺癌、肾癌等中低表达,而在结直肠癌、胃癌、胰腺癌、白血病、淋巴瘤当中呈高表达(图1B),同样的,TCGA和GTEX数据也显示FOXC1基因在人类多种肿瘤组织中表达升高,包括胰腺腺癌(PAAD)组织(图1C)。
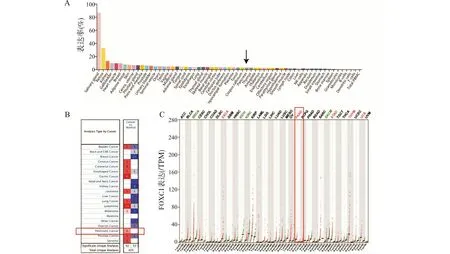
A:FOXC1在正常胰腺组织中的表达较低(数据来自NCBI,箭头所示);B:Oncomine工具显示FOXC1在各种癌症中的表达差异,红色代表FOXC1在肿瘤组织中高表达,蓝色表示其低表达,数字代表相关数据集的数量;C:数据显示FOXC1在各种癌症中的表达差异,红色字体代表癌组织,绿色代表正常组织;PAAD:胰腺腺癌;TPM:每百万份样本图1 FOXC1在人类各种癌症中的表达Fig.1 Expression of FOXC1 in various human cancers
我们进一步的通过Oncomine和GEPIA研究了FOXC1在胰腺癌中mRNA水平的表达情况。Oncomine数据库中,Pei和Badea的数据集显示胰腺肿瘤组织中的FOXC1水平显著高于正常胰腺组织(P值分别是:1.57E-10和8.26E-8)(图2A、2 B),在Buchholz、Grutzmann、Segara和Ishikawa数据集中,除Buchholz数据集以外,癌组织FOXC1表达也略高于癌旁胰腺组织,但差异无统计学意义(资料未显示)。
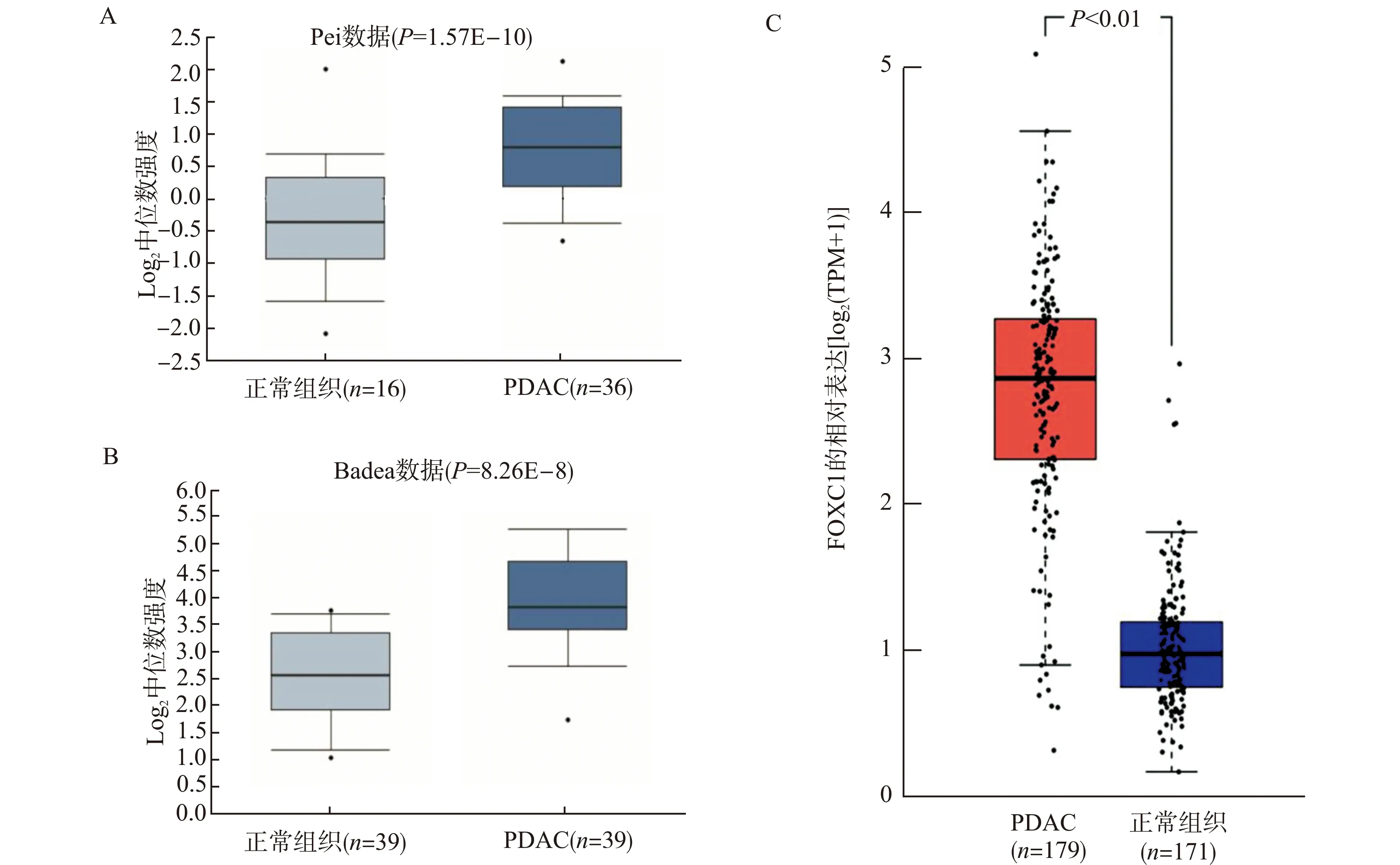
A、B:Oncomine数据库中Pei和Badea数据集显示,相对于正常胰腺组织(源自TCGA数据库和GETX数据库),PDAC组织中FOXC1表达上调;C:GEPIA分析TCGA和GTEX数据库的结果显示PDAC肿瘤组织中FOXC1表达较正常组织高;TPM:每百万份样本图2 不同数据库显示胰腺癌组织中FOXC1 mRNA的表达水平Fig.2 Levels of FOXC1 mRNA in pancreatic cancer tissues from different databases
运用GEPIA在线分析软件联合分析TCGA和GTEX数据中FOXC1的表达,结果显示相对于正常胰腺样本(n=171),PDAC组织(n=179)中FOXC1 mRNA的表达水平显著增强(P<0.01)(图2C)。
2.2 通过分析不同的数据库发现FOXC1与PDAC患者不良预后相关
使用生物信息学数据库包括Kaplan-Meier、GEPIA、OncoLnc和TIMER 2.0在线分析FOXC1基因的表达与胰腺癌预后的关系。Kaplan-Meier数据库分析结果表明,FOXC1的表达与PDAC患者较差的OS和无复发生存期(RFS)密切相关(P值分别为0.0045和0.0300),FOXC1低表达组中位OS为24.6个月,高表达组为16.2个月;低表达组和高表达组的RFS四分位数生存时间分别为20.7个月和16.7个月(图3A、3B)。GEPIA数据结果也显示FOXC1的高表达与PDAC患者的较短的OS和DFS相关(P值分别为0.0094和0.0180)(图3C、3D)。但是,OncoLnc和TIMER数据库的分析结果却显示FOXC1表达与PDAC患者总体生存率没有明显相关性(均P>0.05)(图3E、3F)。
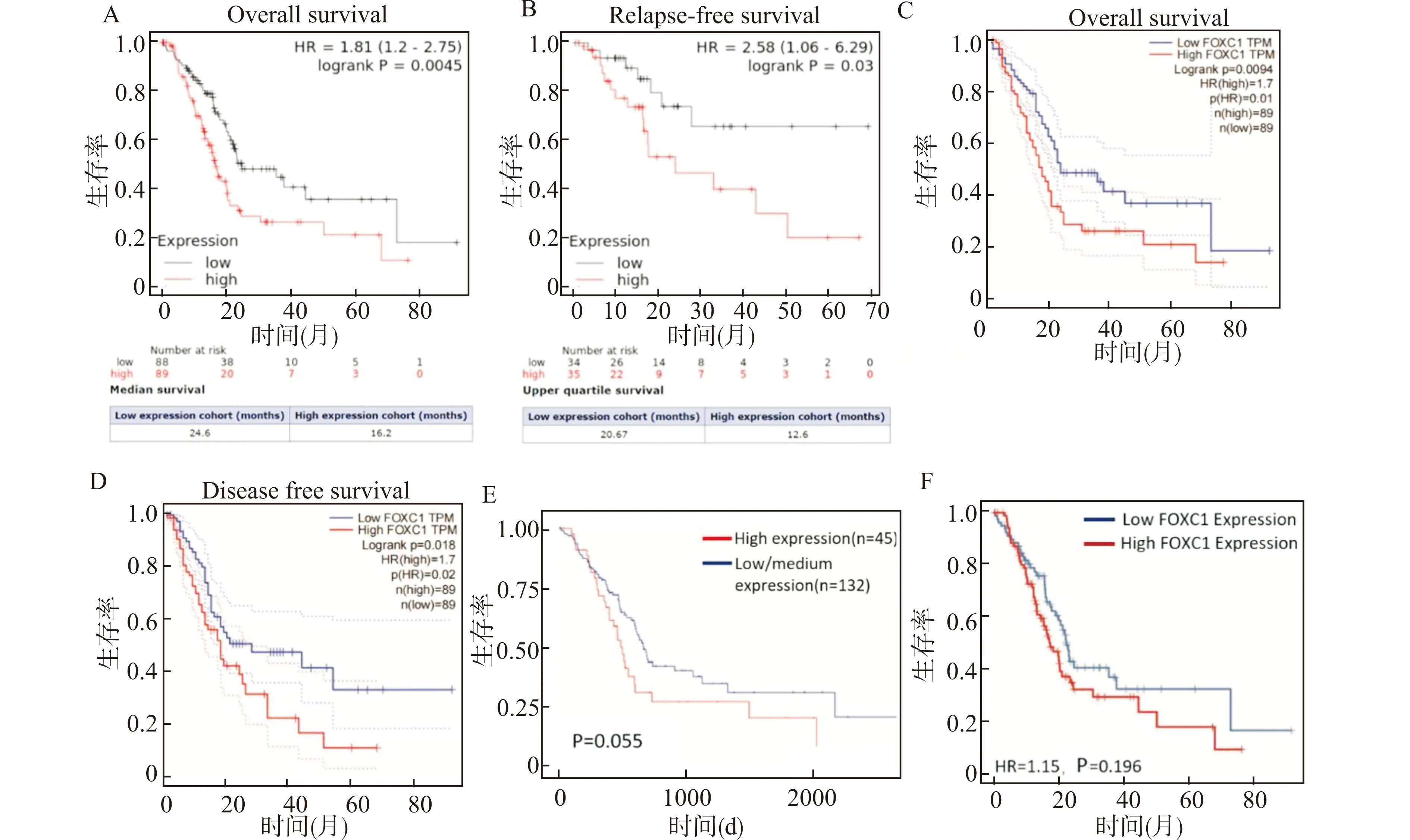
A、B:Kaplan-Meier在线数据生存曲线图显示高FOXC1表达是PDAC患者不良预后因素,其高表达与较低的总生存期(OS)和无复发生存期(RFS)显著相关(P值分别为0.0045和0.0300);C、D:GEPIA显示与Kaplan-Meier类似的结果(P值分别为0.0094和0.0180);E、F:OncoLnc和TIMER 2.0数据库的分析显示FOXC1的表达与PDAC患者OS无关(均P>0.05)图3 不同数据库分析FOXC1对PDAC患者预后的影响Fig.3 Effect of FOXC1 on prognosis of PDAC patients was analyzed by using different databases
2.3 FOXC1蛋白表达与胰腺导管腺癌临床病理特征及预后的关系
FOXC1蛋白在正常胰腺腺泡、导管上皮多呈阴性表达(图4A),少部分病例在腺泡细胞质和细胞核可见弱~中等度的阳性表达,在肿瘤细胞中的表达多定位于细胞核,但在细胞质中也可呈现强弱不等棕黄色颗粒状沉着(图4B、4C)。比较FOXC1蛋白在胰腺癌及癌旁组织的表达情况,结果显示FOXC1蛋白在癌旁组织的免疫组化染色评分显著低于在癌组织中的评分(P<0.01,图4D)。
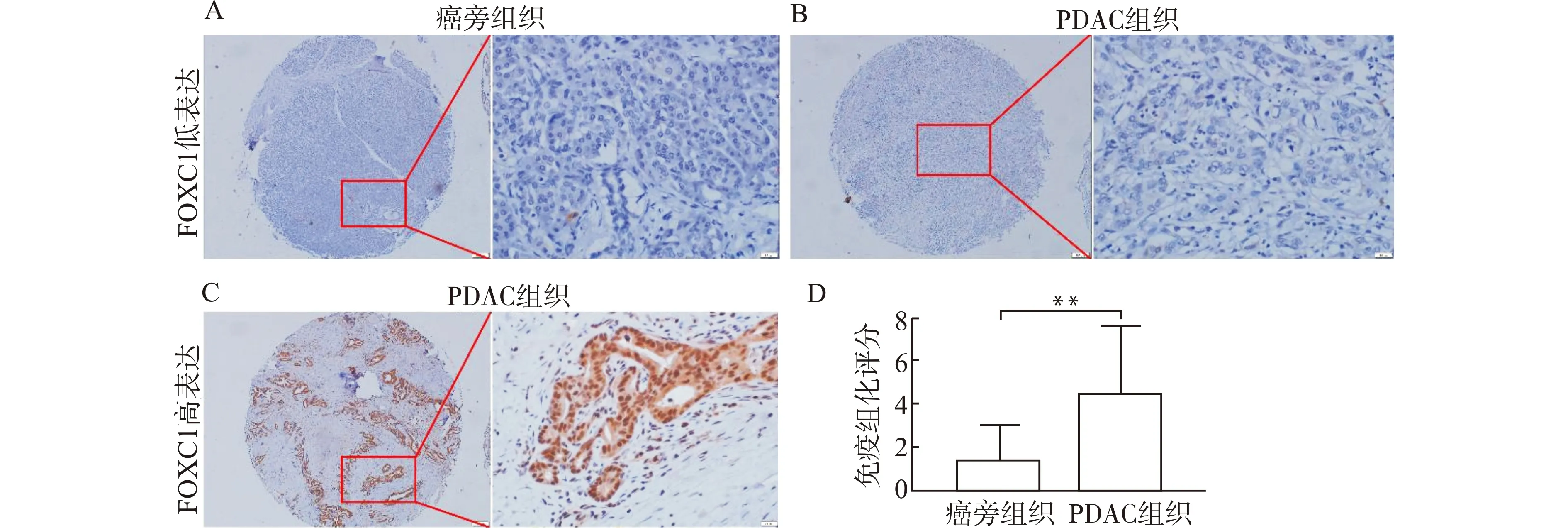
A:FOXC1在癌旁组织中的低/阴性表达;B:FOXC1在PDAC组织中的低/阴性表达;C:FOXC1在PDAC组织中的强表达;D:FOXC1在癌及癌旁组织中表达的统计学分析(n=164),**P<0.01图4 胰腺癌和癌旁正常组织中FOXC1蛋白的表达(Envision染色,×400)Fig.4 FOXC1 protein expression in pancreatic cancer tissues and adjacent normal tissues(Envision staining,×400)
在本研究纳入的164例患者中,FOXC1蛋白高表达患者92例,低表达患者72例,FOXC1高表达与患者更大的肿瘤直径显著相关(P=0.036),与是否有淋巴结转移存在相关性(P=0.057),而与患者年龄、性别、组织学分级和神经侵犯无关(均P>0.05)(表1)。
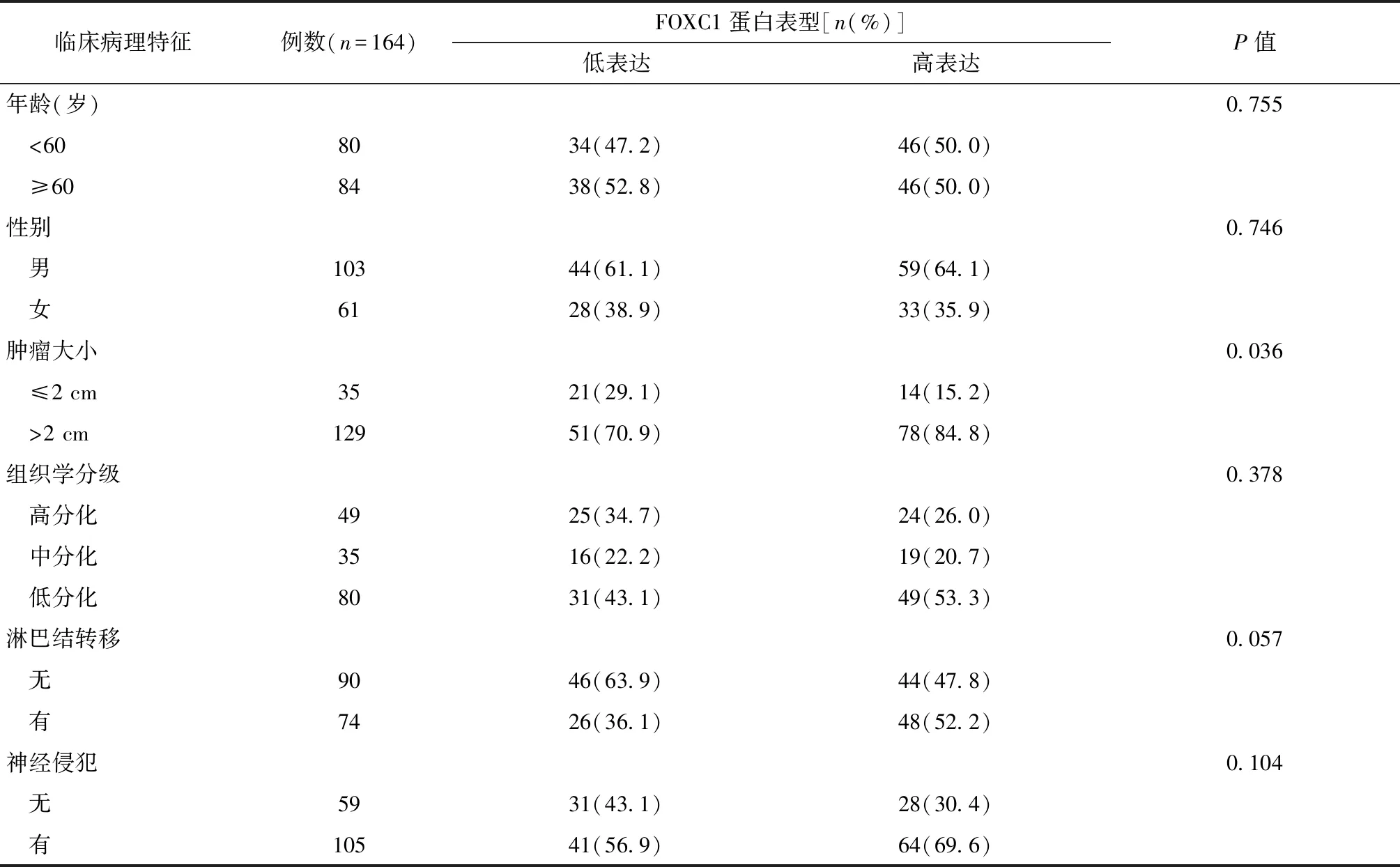
表1 FOXC1蛋白表达与胰腺导管腺癌临床病理特征的关系Table 1 Relationship between FOXC1 protein expression and clinicopathological features of pancreatic ductal adenocarcinoma
Kaplan-Meier法分析FOXC1蛋白表达与PDAC患者预后的关系,结果显示FOXC1的表达影响PDAC患者的总生存期(OS)和无疾病进展生存期(DFS),FOXC1高表达的患者OS(OS:Log-rank=7.620,P=0.006)、DFS(Log-rank=13.856,P<0.01)均明显短于FOXC1低表达的患者(图5)。对纳入的164例患者年龄、性别、肿瘤大小、组织学分级、淋巴结转移、神经侵犯和FOXC1表型进行多因素Cox回归分析,结果显示,FOXC1表型是PDAC患者DFS的独立预后因素(DFS:HR=1.778,95%CI=1.220~2.590,P=0.003),虽然单因素分析FOXC1与PDAC患者的OS有关,但是,多因素分析显示差异无统计学意义(OS:HR=1.418,95%CI=0.939~2.141,P=0.097)(表2)。
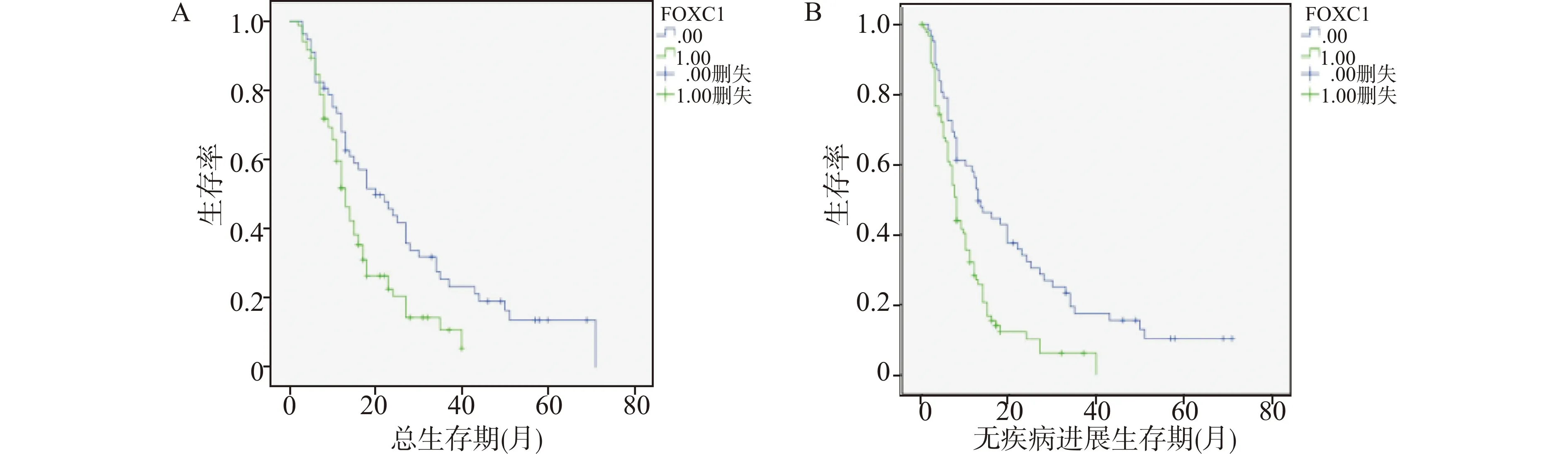
A:FOXC1表达与PDAC患者总生存期(OS)的关系;B:FOXC1表达与PDAC患者无疾病进展生存期(DFS)的关系图5 Kaplan-Meier法分析FOXC1蛋白表达与PDAC患者预后的关系Fig.5 Kaplan-Meier analysis of the relationship between FOXC1 protein expression and the prognosis of PDAC patients
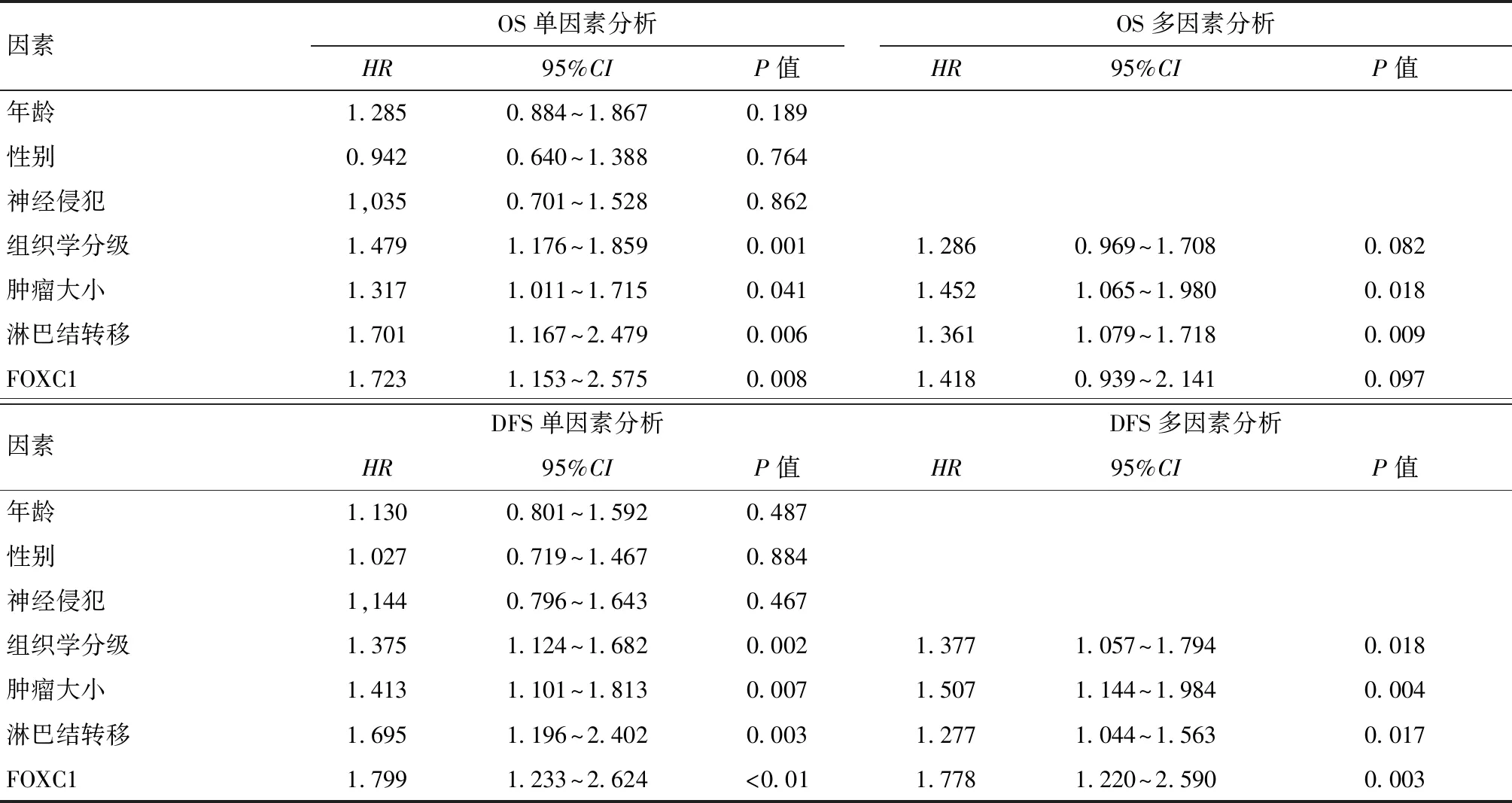
表2 胰腺导管腺癌患者OS和DFS的多因素及单因素Cox分析Table 2 Multivariate and univariate Cox analysis of OS and DFS in pancreatic ductal adenocarcinoma patients
2.4 FOXC1基因涉及的相关分子通路
与FOXC1显著相关的DEGs有193个,其中14个基因表达上调,179个基因表达下调,KEGG富集通路显示与FOXC1有关的DEGs主要富集在PI3K/AKT通路、蛋白多糖、人乳头瘤病毒感染、粘着斑、ECM-受体相互作用、雌激素信号通路、p53通路、癌症中的转录失调等通路的调控(图6A);GO富集分析表明,DEGs的生物学功能主要富集在皮肤发育和表皮发育等方面,对于细胞成分,主要与细胞局部粘附和细胞与细胞之间连接等相关,而分子功能主要体现在钙粘附蛋白调节等方面(图6B),GSEA结果显示DEGs高度富集于p53信号通路(P<0.01,FDR=0.018)和细胞紧密连接通路(P<0.01,FDR=0.015)(图4C),通过TIMER 2.0网站进一步验证,发现FOXC1基因表达与TP53基因(Rho=0.214,P=0.00399)和锌指蛋白转录因子1(Snail 1)(Rho=0.329,P=6.68E-6)和Snail 2(Rho=0.312,P=6.12E-17)的表达存在正相关关系。
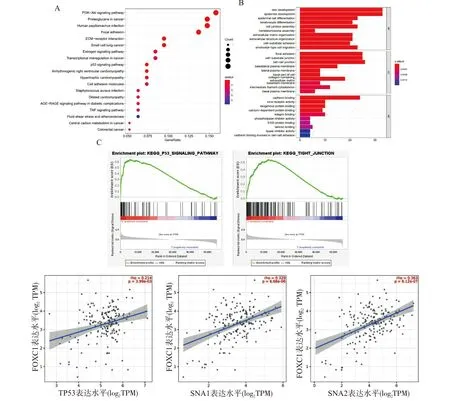
A:KEGG通路富集分析;B:基因本体(GO)分析;C:GSEA富集分析;D:利用TIMER 2.0进行FOXC1基因与TP53和Snail 1/2基因的相关性分析,TPM:每百万份样本图6 FOXC1涉及的相关分子通路分析Fig.6 Analysis of relevant molecular pathways involved in FOXC1
3 讨论
在多数的数据库(集)中,我们发现FOXC1 mRNA表达水平普遍高于癌旁正常胰腺组织,虽然有少数的数据集可能由于样本量的关系未能显示统计学差异。进一步通过临床样本验证,FOXC1蛋白在PDAC肿瘤组织中的表达量也显著高于正常组织,FOXC1的高表达与更大的肿瘤直径和淋巴结转移等预后差的临床病理特征相关,并且与患者更短的总生存期和无疾病进展生存期相关,多因素COX回归分析提示FOXC1是PDAC患者无疾病进展生存期的独立预后因素。
FOXCl在乳腺癌、肝细胞癌、胃癌、胰腺癌、非小细胞肺癌、宫颈癌及鼻咽癌等多种人类恶性肿瘤中表达升高,其表达程度与肿瘤组织分化程度、淋巴转移和预后相关[2-3]。在胰腺癌中,已有的小样本研究也表明,在癌组织中,FOXC1的基因和蛋白表达水平均显著高于正常组织,并且FOXC1高表达是PDAC预后不良的独立预测因子[4-5]。我们的研究结果与之相似,FOXC1高表达提示患者预后不良。但是在分析FOXC1的表达与胰腺癌患者总生存期的关系时,运用不同的分析软件在分析结果上存在一定的差异:来源于Kaplan-Meier和GEPIA数据库的结果显示FOXC1基因高表达的PDAC患者无论是总生存期还是无疾病进展生存期均短于低表达者,而OncoLnc和TIMER 2.0数据库的结果却显示FOXC1的表达与患者的总生存期无显著相关,这可能与不同的分析软件纳入的协变量因素有关。另外,我们的多因素COX结果也显示FOXC1不是PDAC患者总生存期的独立预后因素。Kandimalla等[6]对TCGA数据库的一组170个与免疫、基质和增殖相关的基因进行COX分析,其中有15个基因与PDAC患者不良OS显著相关,但未包括FOXC1。
Subramani等[7]在对胰腺癌细胞系的研究中发现,抑制FOXC1的表达能够显著抑制胰腺癌细胞的生长、侵袭和转移,同时PI3K/AKT和ERK通路上的分子蛋白表达水平也显著降低,恢复FOXC1的表达亦能恢复此通路相关蛋白的表达水平。我们通过与FOXC1相关的差异基因富集分析也发现,FOXC1除了参与表皮发育和细胞分化有关的信号通路,与肿瘤相关的分子通路也包含PI3K/AKT通路。PI3K/AKT信号传导通路是最常见的癌症失调信号通路之一,也是胰腺癌发生发展的核心通路之一[7]。FOXC1异常表达通过PI3K/AKT途径可能参与胰腺癌的不良生物学行为,但其精确的分子间及与下游级联分子间相互作用还需要进一步研究确定。另外,FOXC1蛋白主要定位于细胞核,推测可以作为异染色质开放和基因转录调控的先导因子[8],与其他TFs一样含有与DNA序列GTAAATAAA结合的结构域,通过与特定位点转录调控元件结合,直接或与其他转录因子联合参与基因转录的表达调控。在食道癌中FOXC1与前B白血病细胞同源盒-1(PBX1)结合促进E-盒结合锌子转录蛋白2(ZEB2)启动子活性促进食道癌侵袭转移,而FOXC1与ZEB2共表达是食道癌不良预后因子[9]。
GO分析发现,FOXC1相关的差异表达基因的生物学功能主要富集在皮肤发育和表皮发育等方面,在细胞成分方面,主要与细胞局部粘附和细胞与细胞之间连接有关,而分子功能主要体现在钙粘附蛋白调节等方面。已有的研究表明,FOXC1与细胞的粘附性密切相关,Norden等[10]通过对人淋巴管内皮细胞中的FOXC1基因敲低可增加粘着斑和肌动蛋白应力纤维。FOXC1最初在神经嵴细胞中表达上调,促进正常神经管形成所需的上皮间质转化(EMT)[11]。在肝癌细胞中,若出现FOXC1过表达则会导致包括E-钙粘蛋白和β-连环蛋白在内的基因表达下调,同时间充质标志物如波形蛋白和纤连蛋白表达上调,促进EMT程序激活;反之,在FOXC1高表达的细胞中敲除FOXC1对EMT产生相反的结果[8,12]。FOXC1与肿瘤细胞EMT的具体机制不太清楚,可能与FOXC1能直接与锌指蛋白转录因子(Snail)启动子结合而促进Snail的转录活性有关[13],TIMER 2.0数据库的结果也显示FOXC1与Snail之间存在正相关关系。Snail属于Snail蛋白超家族,是E-钙粘蛋白的转录抑制因子,除可通过局部组蛋白去乙酰化的染色质修饰抑制E-钙粘蛋白的表达,还可以通过募集多梳抑制复合物2(PRC2)到E-钙粘蛋白的启动区导致其启动区H3K27甲基化而进一步阻止该蛋白质的表达,从而参与EMT过程[14]。
我们的研究还发现FOXC1与p53通路有关,并且FOXC1基因与突变型p53(TP53)基因存在正相关关系。TP53基因突变在胰腺癌中是仅次于KRAS突变的常见的分子事件,约占胰腺癌的70%,其中最常见的是错义突变[15]。TP53基因错义突变导致p53蛋白稳定性增加,获得类似癌基因的功能,如促进细胞生存、自噬抑制、代谢重塑和促进肿瘤细胞转移等。在胰腺癌中,TP53突变的患者长期生存率显著短于野生型患者,在KPC工具鼠原位胰腺癌模型中,TP53基因错义突变的小鼠纤维化明显增加伴随CD8阳性T淋巴细胞浸润减少,呈现免疫抑制状态[15]。新近的研究发现,FOXC1可以介导非小细胞肺癌的免疫耐受微环境[16],但是在胰腺癌中的作用如何,是否与p53通路存在关联,还需要进一步实验证实。
总之,我们的研究表明,FOXC1在胰腺癌肿瘤组织中表达异常,FOXC1表达增高提示胰腺癌患者预后不佳,FOXC1不仅有望成为胰腺癌患者重要的预后指标,而且为进一步研究胰腺癌潜在的分子机制提供线索。

