TYR/BDNF基因慢病毒载体的构建及其在大鼠脑梗死模型中的应用*
刘 玉,刘 影,伍志发,鹿静雅
中国科学技术大学附属第一医院影像科,合肥 230001
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是干细胞家族成员之一,不仅具有分化为神经元样细胞的潜能,还可通过携带并表达外源治疗基因来促进受损神经功能的恢复,为脑梗死的治疗提供了一种新方法[1-2]。此外,BMSCs能够修复血管损伤,防止组织缺血,且能够分泌血管内皮生长因子,诱导缺血组织的血管再生和功能恢复[3-4]。许多动物实验[5-6]和临床研究[7]表明干细胞移植可促进脑缺血时神经功能的恢复。相关实验表明,其治疗效果可能与BMSCs的分泌功能有关,BMSCs会分泌不同类型的营养因子,导致神经发生和血管生成。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是重要的神经元保护因子和维持海马功能不可或缺的多肽物质,具有较强的刺激和促进神经细胞生长分化的作用,同时参与突触间神经递质的传递和突触重建。BDNF在脑缺血的发生发展中发挥重要作用,对脑卒中后活动能力改善具有重要意义[8-11]。酪氨酸酶基因(tyrosinase,TYR)作为MR报告基因已引起众多学者的关注,它是以内源性Fe3+为成像基础,成像过程中避免了外源性示踪剂会随着细胞的分裂分化信号逐渐丢失的缺点,也不需要分子探针作用于底物,因此是一种较为理想的MR成像基因。
BMSCs可以分泌内皮生长因子和BDNF,但分泌水平低。我们希望开发一种基于慢病毒载体技术的骨髓间充质干细胞BDNF过度表达和分泌系统,提高BMSCs的治疗效果,促进功能恢复。本实验构建携带报告基因TYR及治疗基因BDNF的重组慢病毒载体,且载体中含有荧光素酶(luciferase)报告基因。体外转染BMSCs,构建过表达TYR和BDNF的细胞株。建立大鼠中动脉梗塞模型,利用载体中含有的荧光蛋白进行光学显像,示踪干细胞脑内分布情况,为下一步以TYR为报告基因的MR分子成像及评价细胞与基因双重治疗脑梗死的疗效奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物和细胞株 7~8周龄SD大鼠24只,购自南京大学模式研究所,于SPF级动物房内饲养。BMSCs细胞株购自北纳生物公司。
1.1.2 主要试剂与仪器 质粒DNA提取试剂盒、T4 DNA连接酶、DNA凝胶回收试剂盒(TaKaRa,日本),EcoRⅠ和BamHⅠ限制性内切酶、MluⅠ和BsiWI限制性内切酶(Fermantas,中国),E.coliDH5a感受态细胞、293T细胞、含绿色荧光蛋白的慢病毒载体H7656由和元生物公司提供。ELISA试剂盒(Biosciences,中国),TTC(T8877,Sigma,美国)。凝胶成像分析仪(培清科技),PCR仪(Applied Biosystems,美国),Western blot及IP细胞裂解液(碧云天),Pierce BCA Protein Assay Kit(ThermoFisher,美国),荧光显微镜(DMI8,LEICA,中国),激光多普勒血流仪(Moor,美国),光学活体成像仪(IVIS Lumina Ⅱ,美国)。
1.2 重组慢病毒载体构建与鉴定
在GenBank中查询目的基因以及上下游的序列,用VectorNTI软件进行引物设计。设计包含酶切位点的TYR和BDNF扩增引物。PCR扩增获取目的基因。慢病毒载体H7656(PLENTI-CBH-3XFLAG-LUC2-TCMV-MNEONGREEN-F2A-PURO-WPRE)中包含荧光素酶报告基因luc2和绿色荧光蛋白基因mNeonGreen。利用限制性内切酶EcoRⅠ和BamHⅠ,MluⅠ和BsiWⅠ将PCR产物和慢病毒载体H7656进行双酶切,PCR酶切产物回收备用,通过凝胶回收法回收大片段载体,用T4 DNA连接酶进行连接。连接产物转化DH5α感受态细胞,挑取阳性克隆,提取质粒,测序鉴定。
1.3 慢病毒的包装及病毒滴度测定
取对数生长期的293T细胞,接种于细胞培养皿中,细胞密度达60%~70%时,将重组慢病毒共转染293T细胞,转染48 h后离心5 min收集含病毒颗粒的上清液,标定滴度。在倒置荧光显微镜下观察。
1.4 慢病毒载体感染BMSCs
BMSCs细胞培养液为RPMI-1640+10%FBS,在37℃,5%CO2中培养。将BMSCs细胞接种到24孔板,配成6×104个/mL的细胞悬液,铺板,12~20 h后感染病毒。每孔加2.5 μL 1 mg/mL polybrene,病毒载体H7656以感染复数MOI=10、20、40、80、100体外转染BMSCs,感染72 h后荧光显微镜下观察绿色荧光表达以判断转染是否成功,选取最佳MOI。
1.5 RT-PCR检测TYR及BDNF mRNA的表达
RT-PCR检测重组慢病毒H16189感染BMSCs后目的基因的表达,GAPDH为内参基因。引物序列见表1。采用RNA提取试剂盒提取细胞总RNA,经逆转录、扩增cDNA,PCR检测细胞中TYR和BDNF的表达情况。对照组为空细胞和H7656质粒转染的BMSCs。通过对样本Ct值的测算,用相对定量法检测目的基因mRNA的表达水平。
1.6 Western blot检测TYR蛋白表达
细胞加入预冷的PBS及IP细胞裂解液,冰上裂解细胞30 min,转移至含裂解细胞的离心管,置于预冷的高速离心机,4℃,12000 r/min离心5~10 min,提取细胞总蛋白,测定蛋白浓度。蛋白样品水浴变性后,10%聚丙烯酰胺凝胶电泳。蛋白转移至PVDF膜,加入一抗,4℃孵育过夜,洗膜3次,加入二抗,室温孵育1~2 h,用TBST在室温下脱色摇床上洗3次,每次10 min,进行化学反应。将发光液滴加在膜上,充分覆盖膜表面,然后放入成像仪中拍照。
1.7 ELISA法检测BDNF蛋白的表达
按照ELISA试剂盒操作说明,将抗原用包被稀释液稀释到适当浓度,每孔抗原加入100 μL;弃去孔中液体。5%小牛血清置37℃封闭40 min。封闭结束后。将稀释好的样品加入酶标反应孔中。每孔加入酶标试剂50 μL,温育并洗涤。每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37℃避光显色15 min。每孔加入终止液终止反应。以空白孔调零,450 nm波长依序测量各孔的吸光度(A)值。
1.8 制备大鼠大脑中动脉梗塞(middle cerebral artery occlusion,MCAO)模型
SD大鼠适应性饲养3 d后进行手术,手术过程中大鼠注射5%异氟醚后补注1%~1.5%异氟醚进行麻醉,术中直肠温度维持在(37.0±0.5)℃;将单纤维丝插入左侧颈内动脉并经颈总动脉引起局灶性脑缺血,并用激光多普勒血流仪监测MCA区脑血流;缺血处理60 min后,去除单纤维丝,缝合皮肤切口。MCAO为模型组,Sham组为假手术组。
1.9 脑组织TTC染色
在脑缺血手术完成72 h后处死大鼠,取新鲜脑组织,切成1 mm左右冠状面切片。使用2,3,5-三苯基氯化四氮唑(TTC)染色,在活组织中,TTC在脱氢酶的作用下还原为红色的甲氧嘧啶产物,而苍白的区域则对应于梗死区域。
1.10 神经功能学评分
神经功能缺损采用48分制评分。该评分系统由一般状态(自发活动、身体对称性、步态;0~12分)、简单运动缺陷(前肢不对称、旋转、后肢放置;0~14分)、复杂运动障碍(垂直爬屏、游梁;0~8分)和感觉缺陷(后肢、躯干、振动和面部触摸;0~14分)组成。总分为4个单项得分之和,0分代表无缺陷,48分代表最大缺陷。
1.11 纹状体细胞注射
将成年雄性大鼠24只随机分为4组,假手术组(Sham组)8只,模型组(组)16只,两组中大鼠再平均分为BMSCs-H7656组和BMSCs-H16189组。大鼠接受5%异氟醚注射和1%~1.5%异氟醚补充。用5 μL汉密尔顿注射器将含200万个细胞的5 μL生理盐水注射到内侧纹状体,持续10 min,然后取出注射器,缝合大鼠。Sham组注射右侧,MCAO组注射左侧。
1.12 小动物成像观察BMSCs脑内分布
MCAO组及Sham组分别注射H16189-BMSCs及H7656-BMSCs入纹状体,在72 h内收集脑组织,用PE IVIS Lumina系统检测干细胞分布和干细胞荧光强度。在BMSC-H16189组损伤区域及未损伤区域半球的纹状体上切取20 μm脑片,采用荧光显微镜观察,并拍照。
1.13 统计学方法
应用SPSS 5.0软件对数据进行分析,计量资料采用均数±标准差表示,组内比较采用总体均数的假设检验(t-test),多组间比较采用Anova方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒载体构建及鉴定
H7656质粒(PLENTI-CBH-3XFLAG-LUC2-TCMV-MNEONGREEN-F2A-PURO-WPRE)、H16188质粒(PLENTI-CBH-TYR-3XFLAG-P2A-LUC2-TCMV-MNEONGRE-F2A-PURO-WPRE)及H16189质粒(PLENTI-CBH-TYR-3XFLAG-P2A-LUC2-TCMV-BDNF-6XHIS-F2A-PURO-WPRE)图谱如图1所示。引物序列见表1。

图1 H7656、H16188及H16189载体图谱Fig.1 The vector maps of H7656,H16188 and H16189

表1 目的基因引物序列Table 1 The primer sequences of target genes
2.2 重组慢病毒的包装及病毒滴度测定
将慢病毒表达质粒和包装质粒共转染293T细胞,24 h后在荧光显微镜下观察到绿色荧光表达(图2),说明重组病毒包装成功。重组慢病毒载体转染293T细胞后,测定慢病毒滴度约为2.6×108TU/mL。
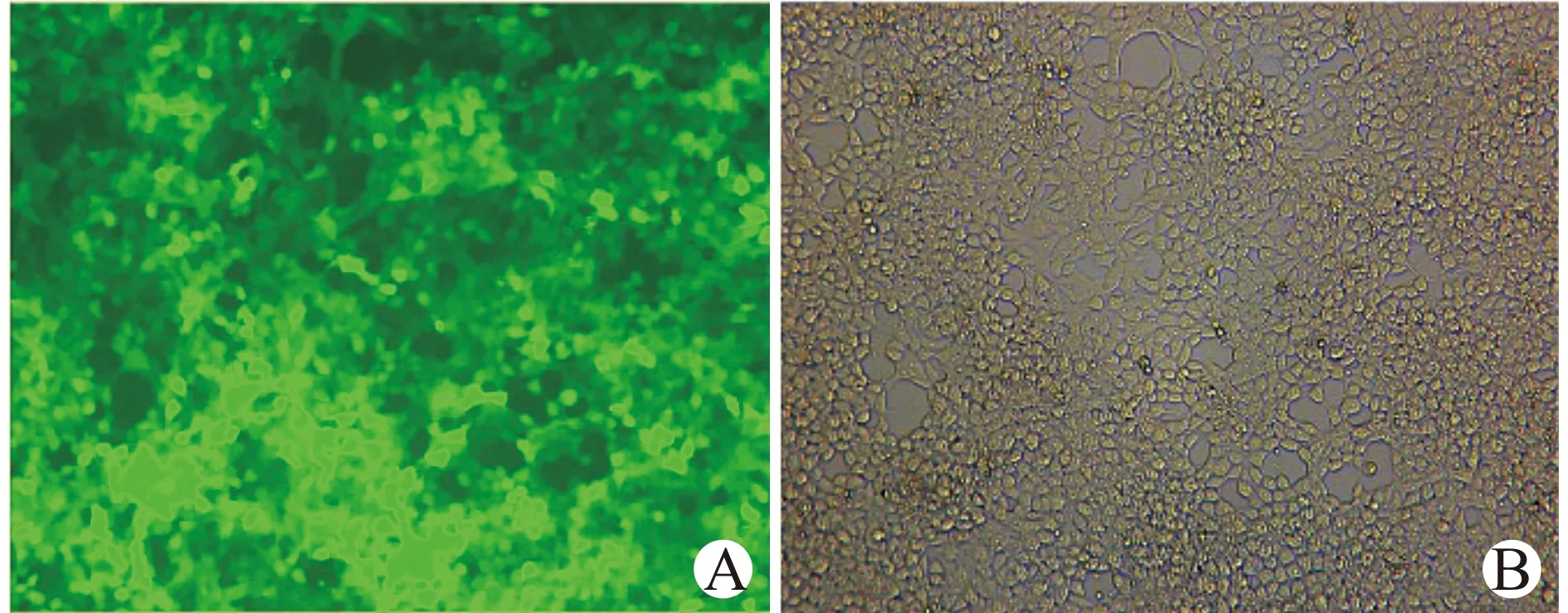
A:荧光视野;B:白光视野图2 慢病毒载体转染293T细胞24 h后荧光表达(×200)Fig.2 The fluorescence expression of 293T cells was observed 24 h after transfection with lentiviral vector(×200)
2.3 病毒载体MOI筛选
BMSCs细胞感染慢病毒H7656 72 h后,MOI为10时感染效率未达到80%,MOI为20、40、80、100时感染效率均达到80%(图3)。以感染效率高、MOI值低、对细胞毒性低为前提,实验结果提示最佳感染条件是MOI为20。

图3 不同MOI值慢病毒载体转染BMSCs(×100)Fig.3 BMSCs were transfected by lentiviral vectors with different MOI(×100)
2.4 重组慢病毒中TYR和BDNF mRNA及蛋白表达
慢病毒感染BMSCs后,以GAPDH为内参,BMSC-H16189组、BMSCs-H7656组及BMSCs组的TYR基因相对表达值分别为(134483.40±3904.50)、(1.03±0.29)、(0.37±0.23),BDNF的基因相对表达(756.60±8.02)、(1.00±0.03)、(1.41±0.05),显示BMSC-H16189组TYR和BDNF mRNA表达量明显高于BMSCs-H7656组及BMSCs组,差异有统计学意义(均P<0.05)。
以GAPDH为内参,Western blot检测细胞中TYR-3XFLAG-P2A蛋白质表达情况,发现在70~100 kD之间检测到蛋白条带,预测蛋白大小约为66 kD(图4)。Western blot未检测到BDNF蛋白的表达,利用ELISA实验检测到BDNF蛋白表达(表2)。

1:Marker;2:BMSCs;3:BMSCs-H7656;4:BMSCs-H16189图4 Western blot检测TYR蛋白的表达结果Fig.4 The expression level of TYR protein detected by Western blotting

表2 ELISA检测BDNF表达Table 2 The expression level of BDNF protein detected by ELISA
2.5 SD大鼠脑梗死模型的建立
SD大鼠MCAO模型构建成功,激光多普勒检测大脑中动脉区脑血流改变如图5A。72 h后,取新鲜脑组织TTC染色,如图5B所示,MCAO组右侧梗死区为苍白色,正常区域为红色。两组大鼠神经功能评分如图5C所示。Sham组神经功能无缺陷,MCAO组神经功能评分19~22分。

A:激光多普勒血流仪监测MCAO区脑血流;B:TTC染色显示MCAO组右侧梗死区为苍白色,正常区域为红色;C:MCAO模型神经功能学评分图5 大鼠脑梗死模型的建立Fig.5 Establishment of cerebral infarction model in rats
2.6 荧光成像
纹状体注射后,用PE IVIS Lumina系统检测显示,Sham组注射BMSC-H16189和BMSC-H7656后,BMSCs可扩散到对侧,但MCAO组注射BMSC-H16189、BMSC-H7656后主要集中在损伤一侧(图6),说明干细胞具有梗死区聚集现象,后续的脑切片纹状体荧光观察也证明了这一点。MCAO组BMSC-H16189脑片结果显示:3 d后脑损伤纹状体区域有大量绿色荧光标记的干细胞(图7)。

图像分别来源于4只BMSC-H7656大鼠和4只BMSC-H16189大鼠图6 荧光成像观察干细胞脑内分布Fig.6 Fluorescent imaging was used to observe the distribution of stem cells in the brain
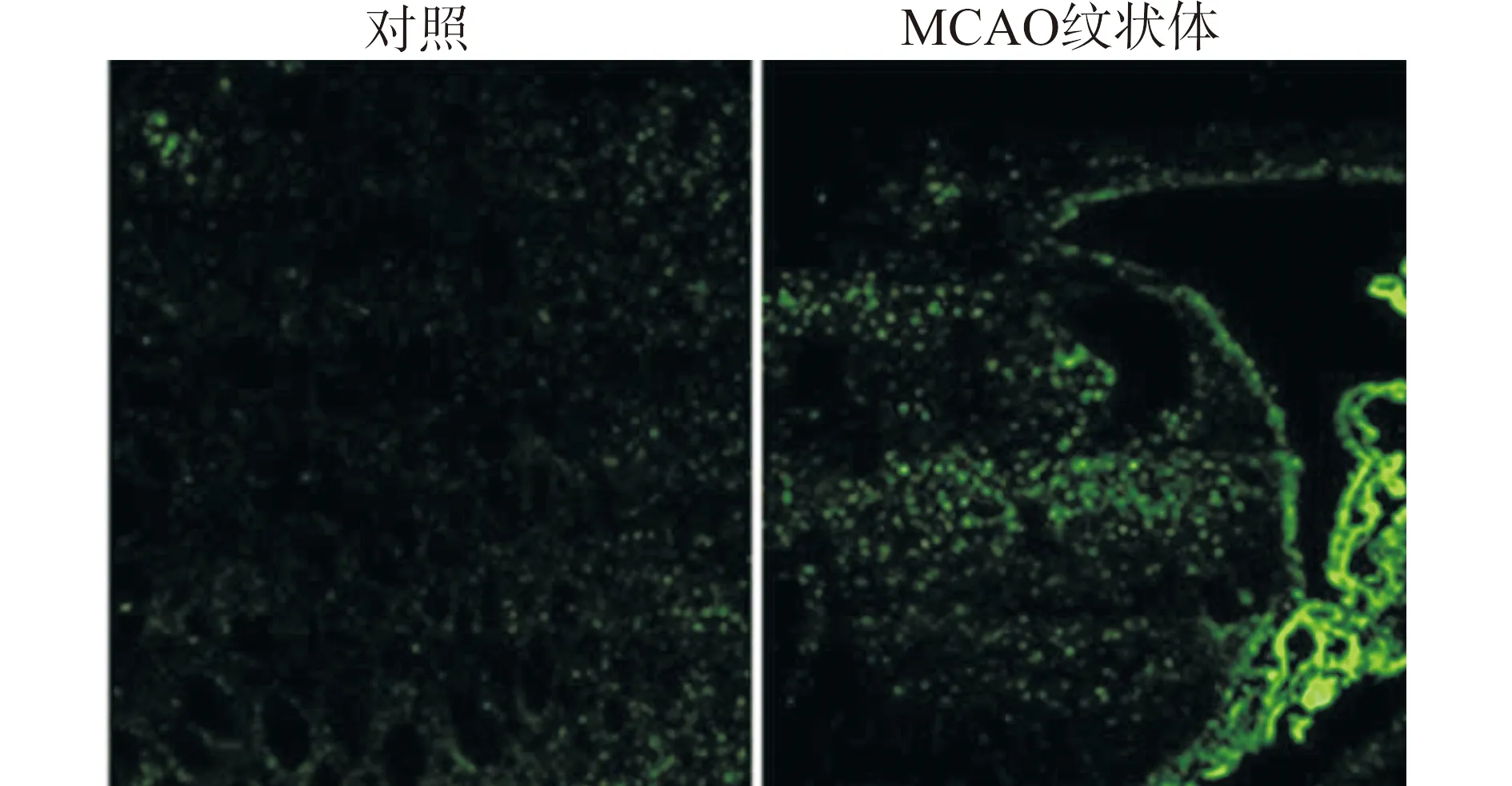
图7 MCAO组BMSC-H16189的脑切片荧光标记结果(×200)Fig.7 Brain section fluorescence results of MBSC-H16189 in MCAO group(×200)
3 讨论
脑梗死是临床上最常见的心脑血管疾病,发病率和死亡率高。目前,急性脑梗死最有效的治疗方法是在代谢半暗带恢复血流,静脉注射组织纤溶酶源激活剂。然而,其狭窄的治疗时间窗使得治疗对较少患者有效。基于细胞的治疗被认为是急性缺血性卒中的潜在治疗方法[12]。脑梗死可导致神经功能障碍,影响生活质量,因此在脑梗死早期提供一种强有力的促进血管生成的治疗方法非常必要,血管生成可以改善脑梗死区域的血流灌注,促进中枢神经再生。BMSCs能够在许多非造血组织中自我更新,并且具有分化为多种组织的多能性。BMSCs能分泌许多生长因子和细胞因子,可以促进各种中枢神经系统疾病的功能恢复[12]。越来越多研究表明,干细胞疗法有望修复各种原因引起的脑损伤[13-14]。BDNF是主要的神经营养因子,在中枢神经系统起着极其重要的作用[15]。采用活体示踪技术是干细胞移植治疗从基础走向临床需要解决的问题,报告基因只有在活细胞中表达后才能在影像上表现出来,故可以反映移植干细胞的运动、存活能力及功能等。我们希望通过基因重组技术,将细胞治疗和基因治疗相结合,将BDNF输送到脑梗死部位,使BDNF长期稳定表达和分泌,增强BMSCs治疗效果的同时,采用无创性成像技术在体内对干细胞进行实时检测。
慢病毒载体是一种高效、低毒且稳定的病毒载体系统,是目前基因治疗最有效的载体之一。本研究成功构建携带TYR和BDNF的重组慢病毒载体,转染293T细胞进行慢病毒包装,以最佳MOI为20的病毒颗粒转染BMSCs,可见细胞呈荧光阳性,RT-PCR和Western blot、ELISA检测结果表明,TYR和BDNF基因成功转染至BMSCs中,并可稳定表达TYR和BDNF蛋白。Western blot中没有检测到BDNF,采用ELISA能检测到蛋白的表达,分析可能的原因是BDNF为分泌蛋白,蛋白已分泌到细胞外,细胞内蛋白量少,运用Western blot法难以检测到。我们构建的慢病毒载体H16189,带有荧光素酶报告基因,为后续荧光成像奠定了实验基础。
大鼠脑MCAO可以通过颅内、动脉内和静脉内途径进行BMSCs移植治疗。静脉或动脉内注射途径在侵袭和安全性方面似乎优于颅内,但缺血区的细胞密度低,循环损失的体积大,注射所需的细胞量也较大。此外,静脉或动脉内注射的途径可能会因毛细血管微血管血栓形成而增加实验大鼠的死亡率[12]。因此,为了减少体内干细胞数量的循环损伤,我们采用了立体定向辅助注射到大脑的代谢半暗带,注射产生效果所需时间更短,需要的细胞数量更少。我们构建大鼠MCAO模型,脑组织TTC染色显示模型组大鼠大脑右侧可见白色梗死组织,且模型组神经功能缺损评分明显高于假手术组,表明模型构建成功。将携带目的基因的BMSCs原位移植,注入大脑纹状体内,通过PE IVIS Lumina系统检测显示Sham组注射BMSCs后,是可以扩散到对侧的,这一结果表明移植的BMSCs具有迁移能力;但MCAO组注射后干细胞主要集中在损伤一侧,说明移植的干细胞具有梗死区聚集现象,且可以在缺血区存活。
综上所述,我们的重组质粒同时具有荧光素酶和TYR两种报告基因,可以进行光学及MRI成像,在该研究中我们利用载体中含有的荧光蛋白进行光学显像,成功示踪BMSCs在脑内分布情况,同时表明BMSCs可以将重组质粒运输到缺血梗死区。荧光成像敏感度高,但分辨率低,MRI敏感度和分辨率都较高,我们下一步将进行MRI显像,对干细胞在梗死治疗效果方面进行可视化研究。利用TYR基因产生黑色素在MRI T1WI中呈高信号,动态观察干细胞的分布及存活情况,并评价治疗效果。

