锰氧化物的结构分析及其在能源与环境中的典型应用
徐思瑜,李 德,李佳璐,申 锋*,郑 鹏
(1 农业农村部环境保护科研监测所,天津 300191;2 华南农业大学 园艺学院,广州 510642)
锰是一种具有多种价态的过渡金属元素,其价态从+2到+7价不等。在自然界的矿石中,锰可以以不同的氧化价态存在,主要包括MnO,MnO2,Mn2O3和Mn3O4等。MnOX催化剂作为过渡金属催化剂,具有资源丰富、成本低、活性高等特性[1],受到广泛关注。此外,不同价态的锰氧化物可拥有不同的形貌结构,例如,球状、花状、棒状。而同一价态的锰氧化物也会因原材料、合成方法和制备条件的不同而呈现不同的晶型结构[2],例如,α-MnO2,β-MnO2,γ-MnO2。锰氧化物内部可存在大量的晶格缺陷,有利于有机物、金属离子和氧气的吸附,使其表现出优良的催化氧化活性[3-5]。MnOX在催化、吸附、能源储存等能源与环境领域得到广泛应用(图1)。本文系统总结了不同晶面工程和不同形貌结构的MnOX合成方法,分析了其结构特征与催化活性之间的构效关系,综述了MnOX在能源与环境领域的典型应用进展。
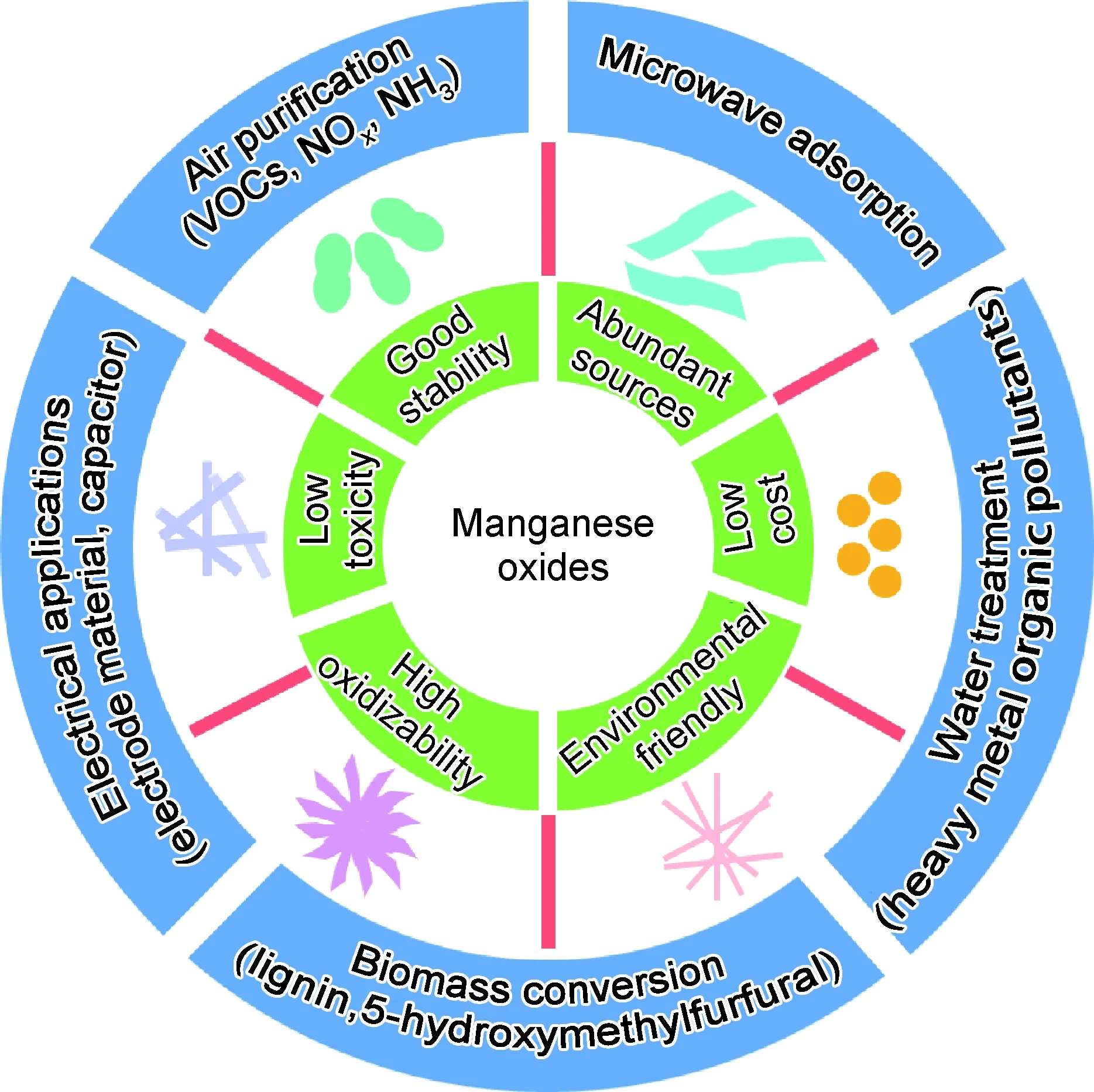
图1 MnOX的优点、典型形貌及应用领域
1 MnO2晶面工程
MnO2是最为常见的锰氧化物,但其晶格结构复杂,存在缺陷、空位,或空穴中含有其他阳离子(如K+),所以MnO2在自然界中以多种晶型存在[6-7]。MnO2按照其晶型分类,主要有α,β,γ,δ,λ等类型[8-9],表1[6,10]总结了不同晶型MnO2的结构、结构类型和结构间隙。可以看出,MnO2晶体结构可分为一维隧道结构(α型、β型、γ型)、二维层状结构(δ型)和三维网状结构(λ型)[11]。

表1 MnO2的晶型分类[6,10]
晶体材料的暴露晶面是影响其理化性质的重要因素之一,因为它们的暴露晶面具有不同的暴露原子、电子结构以及活性位点[12-13]。因此,通过设计调节高能量和高反应性暴露晶面的晶面工程,以改善MnO2材料的催化活性,是目前的研究热点。
1.1 α-MnO2
α-MnO2具有由[MnO6]八面体构成的一维隧道结构。在晶体内部存在较多的空穴或隧道,这些结构不仅有利于缓解体积变化带来的应变[14],而且便于H+,Na+,K+,NH4+,Li+,Ca2+等在α-MnO2中的扩散。当晶体中含有上述阳离子时,α-MnO2中就会存在低价态的锰离子。α-MnO2可以通过溶胶-凝胶法或水热法合成[15-18]。Hashem等[15]将高锰酸钾和抗坏血酸以3∶1的摩尔比混合在一起,并把该混合物转移到装有300 mL蒸馏水的烧杯中,搅拌3 h后,将沉淀物洗净干燥,最后通过焙烧制得α-MnO2。Balakumar等[16]以高锰酸钾为原料,浓盐酸为助剂,通过水热法合成了纳米棒状的α-MnO2。α-MnO2的典型XRD图谱在2θ为37°左右出现明显的特征峰,该峰属于(211)晶面。在10°~30°之间有4个特征峰,分别属于(110)晶面、(200)晶面、(310)晶面和(201)晶面[19]。Li等[17]为了合成具有不同暴露晶面的α-MnO2纳米线,采用了两种不同的水热反应工艺,将暴露晶面为(110)和(210)的α-MnO2分别命名为α-MnO2-110和α-MnO2-210,并考察了它们的锂存储性能。结果显示,α-MnO2-210的锂储存性能明显优于α-MnO2-110。这可能是因为当(210)晶面为暴露面时,(2×2)隧道对电解质的直接暴露率为4/5,高于(110)暴露晶面。(2×2)隧道在电解质中暴露得越多,Li+进入α-MnO2晶格的机会就越大。Luo等[18]也使用水热法合成了α-MnO2纳米纤维,并比较了α-MnO2的(100)晶面和(110)晶面对金属砷(As)的吸附性能。结果显示,As(Ⅲ)和As(Ⅴ)可以和(100),(110)两种晶面都形成络合物,但(100)晶面上的络合物更稳定。密度泛函理论计算表明,这可能是因为(100)晶面和As(Ⅲ,Ⅴ)结合所需的表面能更低。
1.2 β-MnO2
金红石型β-MnO2,属软锰矿,由锰氧八面体单元组成,具有孔道最窄的(1×1)隧道结构[20]。这种结构因空隙孔径狭小而不易发生离子扩散,因此,β-MnO2在热力学上MnO2多晶型中稳定性最强的。β-MnO2的制备方法主要为水热合成法[21-23]。如将60 mmol的MnCl2·4H2O溶解在120 mL蒸馏水中,然后在连续搅拌下将30 mmol KClO3加入溶液中,直到混合的溶液在室温下是半透明的。接着,将该溶液转移到衬有特氟龙的不锈钢高压釜中,并在180 ℃下保持10 h。反应结束后,经过滤、洗涤、干燥后,可获得β-MnO2[21]。Selim等[22]通过水热法合成γ-MnOOH纳米棒,这些纳米棒在400 ℃下进行4 h的煅烧,得到β-MnO2纳米棒。β-MnO2的典型XRD图谱有3个较强的特征峰,它们分别属于(110)晶面、(101)晶面和(211)晶面。而(200)晶面、(210)晶面和(310)晶面所对应的特征峰明显弱于其他峰[21]。Su等[23]通过水热法合成了具有裸露隧道结构的β-MnO2纳米棒。研究表明,其暴露的(111)晶面上有高密度的(1×1)隧道,它不仅可以为Na+的插入和提取提供便捷的运输,而且可以容纳Na+,这使得β-MnO2用作钠离子电池的正极材料时,表现出良好的电化学性能,并且具有350 mAh·g-1的高初始Na+存储容量。具有不同表面原子构型和物理/化学性质的不同晶面会极大地影响表面/近表面反应,从而影响电化学性能。Chen等[24]通过第一性原理计算表明,β-MnO2的(110)晶面是最稳定的,而(001)晶面不稳定。因此,在β-MnO2晶体生长过程中,(110)晶面将占据最大面积,而(001)面将占据最小面积。但研究发现,(001)晶面的吸附赝电容最高,为1.61 mF·cm-2,几乎是(110)表面的两倍。同时,沿(001)方向的H+扩散能垒大大低于沿(110)方向的H+扩散能垒。通过加入F-,利用F和Mn之间的强相互作用,降低了(001)晶面的表面能,同时抑制了(110)晶面的生长。
1.3 γ-MnO2
γ-MnO2的结构为软锰矿(1×1)隧道和斜方锰矿(1×2)隧道交替生长而成的一种密排六方结构,这种无序交替生长的结构导致晶体中含有大量的缺陷、空位等[25],使得γ-MnO2表现出独特的物理化学特性。因此,γ-MnO2常被用作吸附剂,以去除环境中的污染物[26-27]。γ-MnO2可通过水热法、氧化还原法或者Mn2O3氧化法合成[28-31]。如Zhao等[28]通过简单地改变反应物,来调控γ-MnO2的形貌。分别将NH4HCO3和NaCO3滴加到MnSO4溶液中,使用水热处理和连续热分解的方法,成功地制备了多孔γ-MnO2空心球和γ-MnO2立方体。而Fu等[29]以MnSO4和KMnO4为原料,发现两者的摩尔比可以显著影响γ-MnO2的微观结构和形貌。当MnSO4/KMnO4摩尔比等于或大于2.3时,可以形成具有中空结构的γ-MnO2。Zeng等[30]利用模板法合成了具有介孔结构的Mn2O3前驱体,然后利用稀HNO3溶液处理该前驱体,制得γ-MnO2。在此过程中,有序介孔结构得到了很好的保留。该材料与无孔的γ-MnO2相比,具有高比表面积和丰富的表面氧空位(主要存在于(131)晶面),可以大大提高其表面活性位点的数量和表面氧的反应性。Chen等[31]采用水热合成法制备了3种不同结构的γ-MnO2。用MnSO4·H2O提供Mn2+,分别加入NH4HCO3,(NH4)2S2O8,NaBrO3,通过改变反应物的量、反应温度和反应时间成功制得了空心球状(γ-MnO2-HS)、海胆状(γ-MnO2-SU)和花状(γ-MnO2-F)的γ-MnO2。γ-MnO2-SU有5个较明显的γ-MnO2特征峰,分别属于(120)晶面、(131)晶面、(300)晶面、(160)晶面和(421)晶面。γ-MnO2广泛应用在电极材料领域[32-33]。如Xie等[34]以MnSO4,(NH4)2S2O8为锰前驱体,苯胺为碳前驱体,采用水热法合成了γ-MnO2/聚苯胺复合物。以该复合材料为电极,在50 mV·s-1扫描速率和0.5 A·g-1的电流强度下,比电容可达到493 F·g-1。此外,孙梦婷等[35]利用水热法制备了3种不同形貌的MnO2催化剂,分别为α-MnO2纳米棒、γ-MnO2纳米片和δ-MnO2纳米球,并对催化剂的低温NH3-SCR催化性能进行了研究。结果表明,在50~250 ℃的温度范围内,γ-MnO2纳米片表现出最优的NH3-SCR催化性能。通过表征发现,γ-MnO2纳米片表面暴露的(131)晶面上不仅存在着大量的配位不饱和Mn离子,从而形成了较多的强酸性位点,而且还存在着较多的活性氧物种。这些活性位点可以使得NH3和NOX的活化过程在较低温度下进行。
1.4 δ-MnO2


图2 δ-MnO2在pH=6时含/不含Cd(Ⅱ)的XRD图[42] (a)吸附后;(b)共沉淀后
1.5 λ-MnO2


图3 LiMn2O4 和λ-MnO2的XRD图[45]
2 MnOX形貌结构
虽然MnOX的种类繁多,但其一级结构单元基本相同,即锰氧八面体[MnO6],不同形态结构MnOX中的[MnO6]八面体通过共棱或共角的方式连接[48]。因此,无论是相同价态还是不同价态的MnOX,都有可能具有不同的形貌。MnOX的形貌调控可以改变它的孔径、比表面积、氧空位浓度、活性位点,进而影响它的催化氧化活性、吸附性能、比电容等[49-51]。根据不同的目的,对MnOX的形貌进行调控,具有十分重要的意义。
2.1 纳米棒
纳米棒作为一种最常见的形貌结构,其合成方法最为简单,并显示出比相应的纳米颗粒更高的活性。MnOX纳米棒的合成方法主要是水热法[52-54],通过改变反应物的量、反应温度、反应时间等条件,可以成功合成不同结构的MnOX纳米棒[55-57]。如Li等[58]通过调整MnSO4·H2O和(NH4)2S2O8的比例,成功制备了3种不同形貌的MnO2(纳米棒、中空海胆状、光滑球)。通过测试3种材料的电化学性能发现,MnO2纳米棒显示出最高的比电容。其原因可能是纳米棒的粒径为纳米级,可以大大缩短离子扩散路径,有效提高电解质的传输性能。Guo等[56]以KMnO4和Mn(CH3COO)2·4H2O为原料,通过固定反应温度,调控反应时间来改变α-MnO2的形貌。结果显示,当时间为0.1~5 h时,制备出来的MnO2是片状的,并且随着时间的增加,片层厚度逐渐增加,当时间超过5 h时,则变成棒状。通过改变反应温度则可以生成无定形MnO2,α-MnO2纳米棒和δ-MnO2纳米棒[57]。水热法虽然操作简便,产物颗粒分布均匀,但存在能耗大、产率低等问题。有研究表明,使用沉淀法或改变前驱体的煅烧温度也可以制备MnOX纳米棒[59-60]。如Said和Harbrecht[60]通过改变γ-MnOOH前驱体煅烧的温度,成功合成了β-MnO2纳米棒和Mn5O8纳米棒。作者发现锰矿在较低的温度下或在较高含量氧气下,会转变为β-MnO2纳米棒,但在较高温度(350~520 ℃)且存在极少量氧气的情况下会转变为Mn5O8纳米棒,对β-MnO2或Mn5O8进行热处理都会生成Mn2O3纳米棒。
2.2 纳米片
纳米片状的MnOX通常具有较大的比表面积,能够提供便利的离子传输通道和更多的催化氧化活性位点。水热法和氧化还原法是合成MnOX纳米片结构最常用的两种方法[38,61-63]。Xia等[38]以Mn(NO3)2,NaOH和H2O2为原料,通过水热法成功合成了δ-MnO2(图4)。结果表明,温度对所制备材料的形貌和比表面积有很大影响。在110 ℃下合成的材料呈短棒状,130~170 ℃之间合成的δ-MnO2呈纳米片状,进一步将温度升高到190 ℃时,材料的形态再次显示为棒状。在110 ℃和190 ℃下获得的材料显示出与其他材料不同的形貌,这可能与其存在杂质有关。Zhang等[61]通过MnSO4与K2S2O8的快速水热反应,且无需使用任何模板和表面活性剂,合成了由超薄水钠锰矿型MnO2纳米片组成的分层多孔纳米结构。作者研究该MnO2纳米材料作为超级电容器电极材料的电化学性能,发现在0.3 A·g-1的电流密度下,该材料的比电容高达269 F·g-1,高于MnO2纳米线和MnO2纳米球。这可归因于MnO2纳米片具有大孔容、高表面积、中孔结构和超薄纳米片,这有助于电极中的离子嵌入/提取和电子传输。Mahamallik等[62]提出了一种以KMnO4为氧化剂、MnCl2·4H2O为还原剂,制备高度多孔的非晶型MnO2纳米片的方法。该材料具有301 m2/g的表面积和0.364 nm的孔径,可用作吸附剂、催化剂或催化剂载体。将其用于氧化降解四环素盐酸盐(TCH),在pH为3.48,温度为(301±2) K,MnO2剂量为0.5 g/L,TCH初始浓度为50 mg/L的条件下,搅拌70 min后,TCH的降解率可达84%。
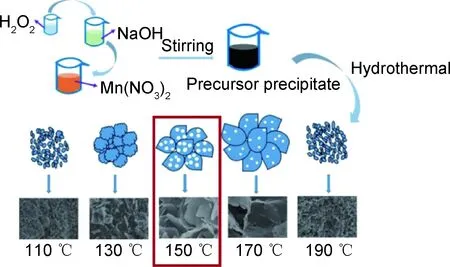
图4 水热法合成多孔δ-MnO2纳米片的示意图[38]
2.3 纳米花
据文献报道,大部分MnOX纳米花是由纳米片堆积而成[64-65]。制备花状MnOX的方法有很多,通常包括沉淀法、水热法和氧化还原法等[66-70]。Swetha等[68]使用KMnO4(0.1 mol·L-1和0.3 mol·L-1),CTAB(0.05 mol·L-1)和CH4N2O,在150 ℃和170 ℃温度下通过简单的水热法合成MnO纳米花(图5)。当反应温度为150 ℃时,在0.1 mol·L-1KMnO4和0.3 mol·L-1KMnO4的不同反应条件下,分别生成分层纳米花结构和团聚纳米花结构;当反应温度为170 ℃时,在0.1 mol·L-1KMnO4的条件下生成纳米线和团聚纳米花结构,而在0.3 mol·L-1KMnO4的条件下,生成的纳米花结构表面带有纳米纤维。Wang等[69]以KMnO4和尿素为原料,分别通过微波辅助水热法和常规水热法制备了纳米花状的δ-MnO2和α-MnO2,作为超级电容器的电极材料。结果显示,δ-MnO2的电化学性能要优于α-MnO2。这可能是因为,δ-MnO2纳米花的花瓣结构有利于电解质离子在花瓣之间的快速转移,花瓣的厚度较小使得电解质离子在纳米材料表面下的扩散距离最小化。Gu等[70]以MnCO3微球为模板,利用KMnO4与MnCO3的氧化还原反应,生成了多孔的纳米花状MnO2。然后,通过HCl刻蚀去除内部模板,以获得花状的MnO2中空微球。该材料具有比表面积大、氧空位丰富、Mn4+含量高、酸性位点多和酸性强等特性,因此,在氧化甲苯的过程中,表现出优异的低温催化活性。
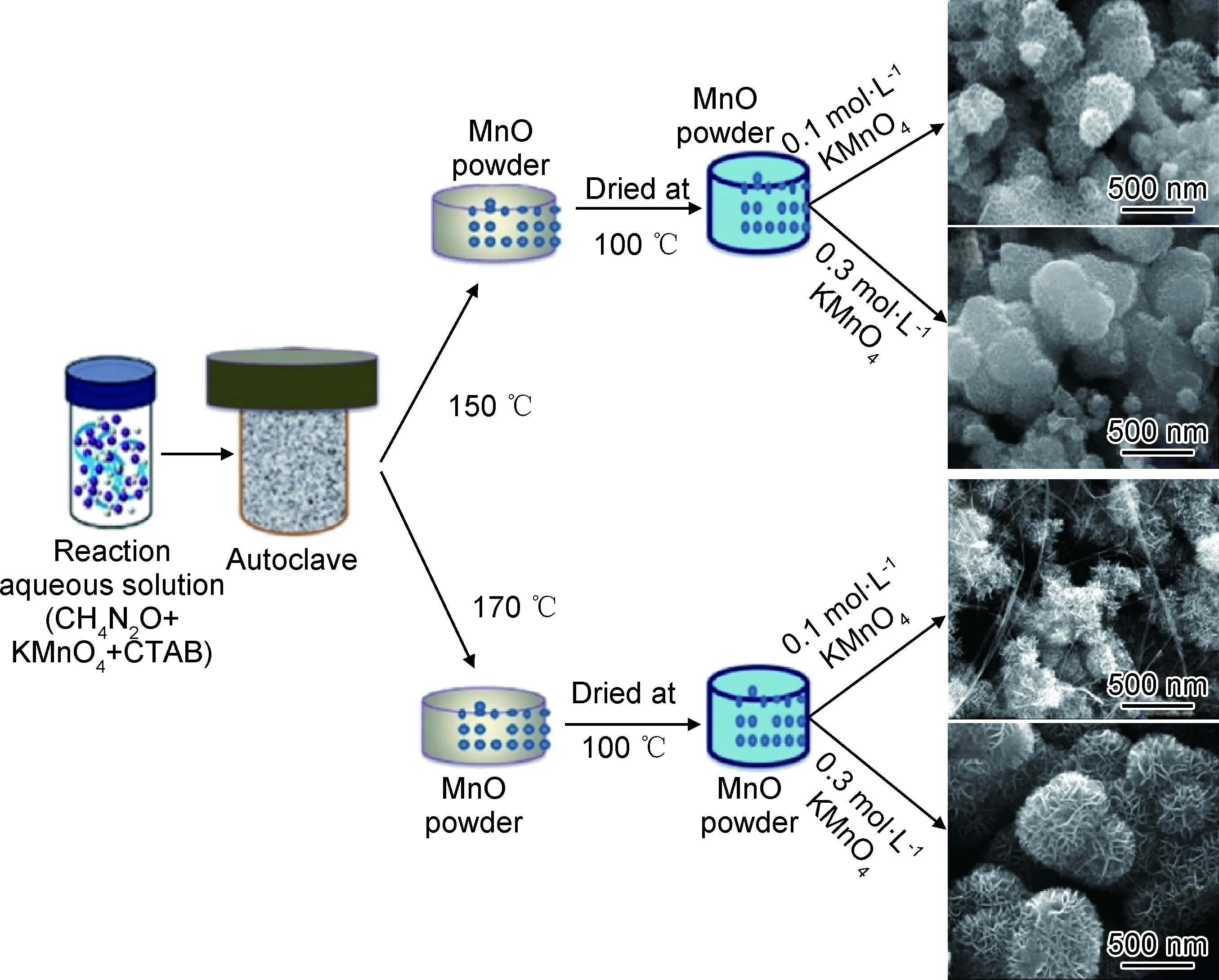
图5 MnO纳米花形成过程示意图[68]
2.4 纳米球
纳米球结构具有比表面积大、孔容大等特点,特别是介孔纳米球、多孔纳米球、中空纳米球等结构[71-72],这些纳米结构拓展了MnOX纳米材料的应用空间。目前,有很多研究通过水热法、模板法、氧化还原法、沉淀法等来制备MnOX纳米球[73-76]。Wu等[74]利用KMnO4和碳纳米球制备了MnO2纳米球,并通过在还原气氛中加热产物来引入表面氧空位。实验表明,随着温度的升高,纳米颗粒变大,锰的价态降低。Raj等[75]以MnCl2·4H2O为锰源、NaOH溶液为溶剂,鲸蜡基四甲基溴化铵为表面活性剂,在室温下成功合成了球形Mn3O4,并研究其电化学性能。结果显示,在0.5 mA·cm-2的电流密度下,Mn3O4表现出322 F·g-1的高比电容。Mn3O4电极中的电荷存储机制可能类似于MnO2电极,在较小的扫描速率下,电解质中的Na+几乎可以占据Mn3O4电极材料表面和内部的所有可用位置,因为这些离子有足够的时间扩散到电极的所有位置进行氧化还原反应,从而该电极具有高比电容。Wu等[76]开发了一种用于制备仅由Mn4+组成的多孔α-MnO2的氧化还原沉淀法,即在过量的KMnO4溶液中加入Mn(NO3)2,并通过滴加KOH溶液,使混合液pH始终保持在8.0。该方法合成的α-MnO2在400 ℃下煅烧后,大多数纳米片消失,将纳米花转变成多孔纳米球。该材料的开孔分层结构具有较高的比表面积,可以提供更多的活性位点,有利于反应物分子的吸附和扩散。此外,以Mn(NO3)2·6H2O为前驱体、Li2O2为模板,采用溶液沉淀法合成δ-MnO2,然后通过空气中高温煅烧处理,可以得到具有中空结构的λ-MnO2纳米球[46]。
图6[16,43,56,58]以KMnO4为典型前驱体,总结归纳了不同合成条件对MnOX形貌的影响比较。可以看出,MnOX的合成方法多种多样,而MnOX的形貌会随着反应条件的改变而发生相应的改变。为了得到期望的形貌,这就要求在制备过程中优化实验条件,如原料、反应时间、反应物浓度等。
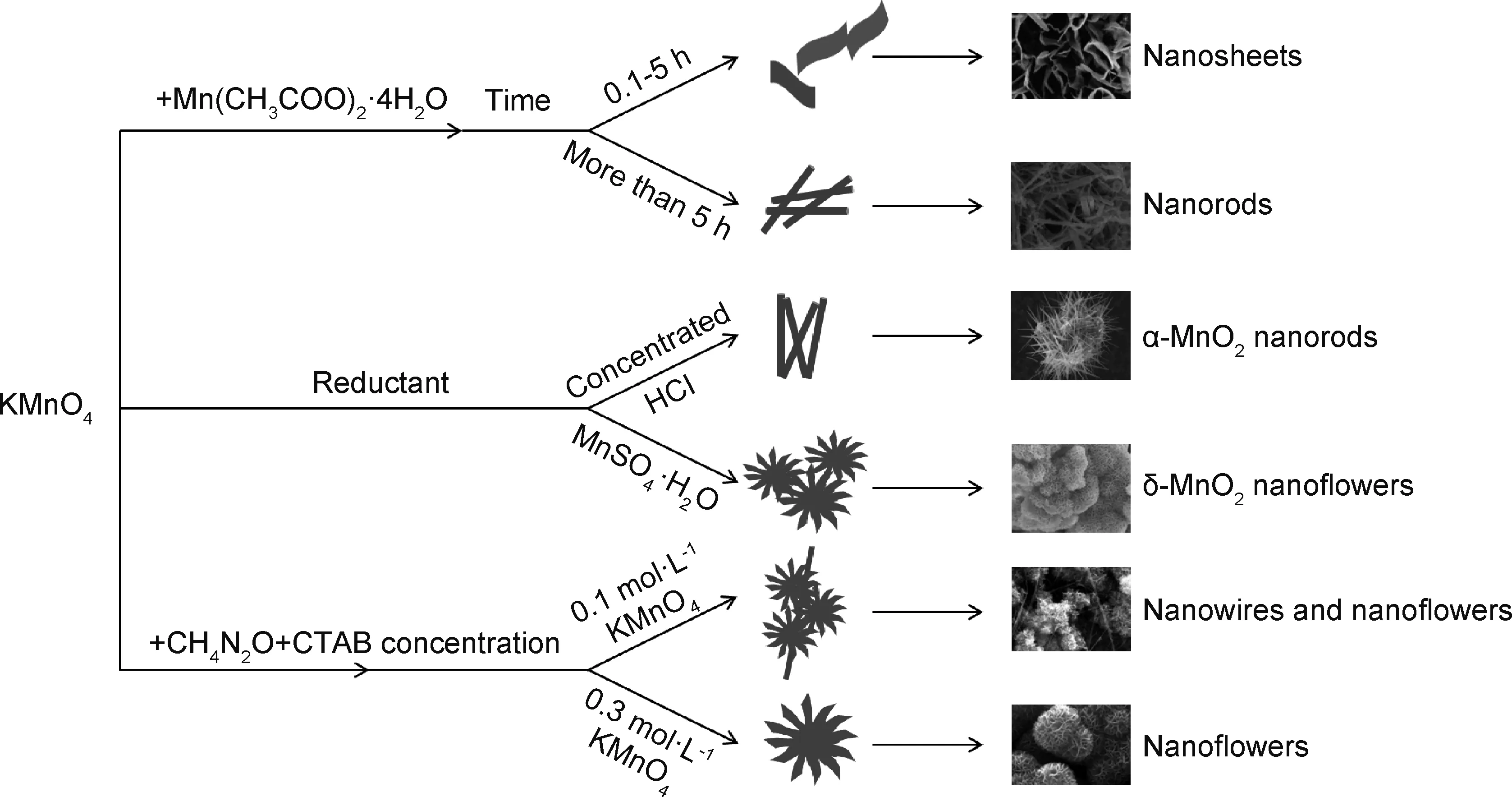
图6 不同条件下MnOX的制备过程示意图(以KMnO4为氧化剂)[16,43,56,68]
3 MnOX在能源与环境中的应用
迄今为止,已经制备了一系列贵金属、过渡金属及其氧化物作为催化剂、吸附剂和电极材料,如Pt[77],V2O5[78],TiO2[79],RuO2[80]等,但高成本、稀缺性、有毒性限制了它们的广泛应用。因此,为了降低生产成本并进一步增加工业化的可能性,这些稀有昂贵的金属催化剂应该被廉价的、丰富的过渡金属所取代。近年来,不同形貌和晶体结构的MnOX材料的可控制备成为研究者关注的重点问题之一,由于该纳米材料具有独特的物理化学性质,因而被广泛应用于催化、氧化、吸附和电化学等能源与环境的领域[81]。
3.1 MnOX在能源中的应用
3.1.1 生物质催化转化
与贵金属催化剂相比,MnOX的价格相对较低且具有较好的催化氧化活性,在生物质能源催化领域有较大的应用潜力。木质素是储量仅次于纤维素的生物质资源,其富含芳烃结构,是平台化合物的潜在来源[82-83]。由于其结构稳定难以降解,大部分氧化和降解生物质中木质素的过程都需要在常规加热条件下进行,但Dai等[84]研究了一种有前景的光催化氧化木质素的非均相系统,该系统使用了易获得且可回收的MnO2。并考察了4种不同晶体结构的MnO2,发现δ-MnO2的催化效率远高于α-MnO2,β-MnO2和γ-MnO2,这可能是因为δ-MnO2具有分层结构。Long等[85]使用Ni/MgO催化剂从可再生木质素衍生的酚类中选择性生产环己醇,该催化剂在氢化反应中显示出优异的催化活性。在160 ℃和3 MPa H2条件下,只需使用20%(摩尔分数)Ni/MgO催化剂,反应3 h后,愈创木酚转化率可达到97.74%以上,环己醇选择性为100%。Giannakoudakis等[86]利用MnCl2和KMnO4溶液合成了MnO2纳米棒,发现在MnO2和紫外线存在的条件下,反应温度为39 ℃时,5-羟甲基糠醛(HMF)转化率、2,5-二甲酰呋喃(DFF)选择性和碳平衡几乎达到100%。该反应的机制如图7所示,光和热促进了纳米棒中晶格氧的活化,并增加了纳米棒外表面的温度,这有利于羟基去质子化。此外,在HMF氧化生成2,5-呋喃二甲酸(FDCA)的研究中可以看出,MnO2比其他几种锰氧化物表现出更优良的催化活性[87],但Bao等[88]得出不同的结论。通过控制煅烧温度来改变锰氧化物的形貌和催化性能。结果显示,当煅烧温度为400 ℃时,生成了多孔的2D Mn2O3纳米片(M400)。由于引入了丰富的表面孔隙,所制得的M400在HMF选择性氧化制备FDCA过程中,表现出明显优于商用Mn2O3和活化MnO2的催化活性。在反应溶液中,添加一定量的NaHCO3溶液、O2和M400催化剂,HMF转化率和FDCA产率可高达99%以上。
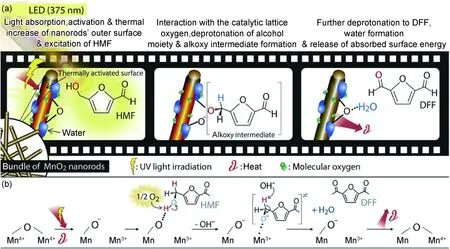
图7 HMF在MnO2上的光效应(a)和相关氧化机制(b)的示意图[86]
表2[84,86,88-91]总结了不同MnOX对生物质(木质素、葡萄糖、HMF)转化率、产物及产率的影响。结果显示,相同底物在不同的催化体系下,可能得到不同的产物。如MnO2纳米棒和β-MnO2纳米球在HMF的催化反应中,表现出不同的催化性能,得到不同的产物。而Mn3O4纳米颗粒与MnO2纳米棒的氧化产物一致,它们都可以将HMF氧化为DFF。这可能与锰氧化物的形貌、活性位点以及Mn3+/Mn4+含量等有关。

表2 MnOX对生物质的催化氧化
3.1.2 电化学领域的应用
MnOX具有资源丰富、价态多变、高比电容、相对环保无毒等特点,其高孔隙度、较大的比表面积以及良好的电导性,有助于增强其电化学性能。因此,MnOX在电化学领域也有很好的应用前景。Li等[92]通过煅烧Mn(NO3)2制得β-MnO2,并研究了氧空位浓度对β-MnO2的晶相、电子结构和催化性能的影响,结果发现适当浓度的氧空位可以减少带隙,增加MnOOH的费米能级,并拉长了吸附氧的O—O键,这些变化均有利于增加MnO2的导电性和催化活性。从Bai等[93]的研究可以看出,多孔的Mn2O3具有高容量、良好的循环稳定性和倍率性能等优点,是一种极具发展潜力的电极材料,这与Su等[94]的研究结果一致。
超级电容器由于具有高功率、长循环稳定性、高效、实用等特点而成为电化学存储系统之一,而MnOX被认为是作为超级电容器电极材料的最佳选择之一。Li等[95]实验表明,多孔Mn2O3纳米立方在电流密度为100 mA·g-1时显示出191.1 F·g-1的比电容。更重要的是,该电极即使在电流密度增加50倍时仍有58.6%的比电容保持率,并且具有卓越的长期循环稳定性。此外,还制备了基于所合成的多孔Mn2O3纳米立方的简单对称超级电容器,该电容器显示出良好的电化学性能。Meher和Rao[96]利用常规回流和微波辅助的方法分别合成不规则花状结构的MnO2(MnO2-ref)和多孔花状结构的MnO2(MnO2-mw)。结果显示,MnO2-ref和MnO2-mw电极表现出比传统电容器和普通超级电容器相对更高的能量密度,其功率密度远高于传统电池和燃料电池。与MnO2-ref相比,MnO2-mw表现出更高的能量密度和功率密度,这归因于MnO2-mw具有高比表面积、良好的结晶度、合适的孔隙度,致使电解质更易渗透、离子扩散阻力降低、活性吸附位点浓度更高等。
在某些情况下,同一种催化剂也会因形貌、比表面积等差异,而表现出不同的电化学性能。如表3[73,93-94,97-99]所示,多孔Mn2O3的比表面积比Mn2O3空心球大,但容量却低于Mn2O3空心球。通过以上研究表明,不同形貌的锰氧化物纳米材料会导致比表面积、孔容等的差异,最终影响到MnOX的容量、比电容和使用寿命等电化学性能。
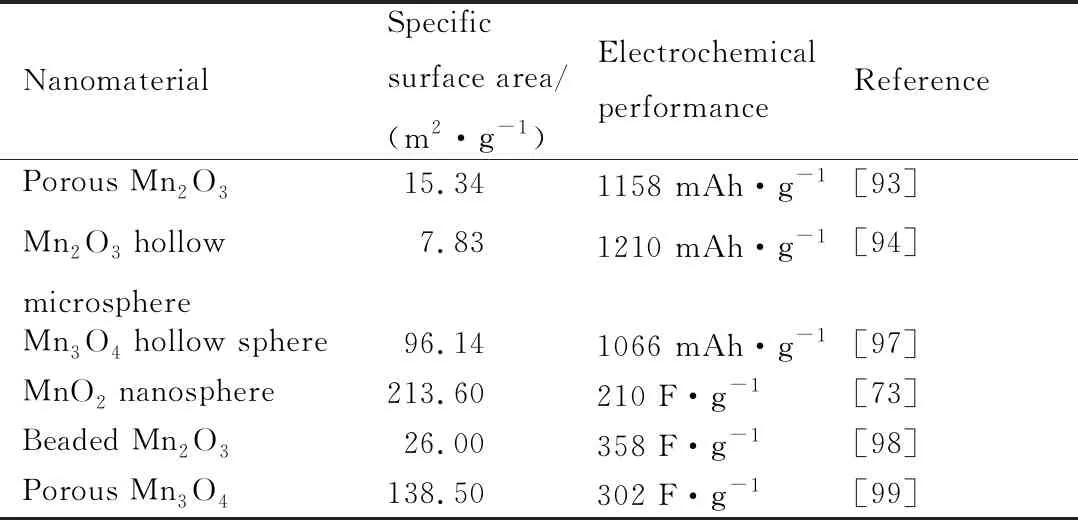
表3 不同形貌锰氧化物作为电极材料的性能
3.2 MnOX在环境中的应用
3.2.1 空气污染物去除与降解
MnOX由于具有良好的氧化还原活性和热稳定性等性能,所以经常被应用于去除空气中的污染物,如VOCs(挥发性有机污染物),CO,NO等。Piumetti等[100]采用溶液燃烧法制备了3种介孔锰氧化物催化剂(Mn2O3,Mn3O4和MnxOy),并测试了它们对乙烯、丙烯、甲苯及其混合物的催化氧化活性。作者发现Mn3O4对乙烯、丙烯和甲苯及其混合物都具有良好的催化活性,这可能是因为Mn3O4表面存在大量的Brønsted酸性位点和Mnn+Lewis酸性位点。Liu等[101]以KMnO4与甲醇为原料,在低温和大气压条件下,通过氧化还原反应来制备水钠锰矿型MnO2纳米棒,然后在室温下用HNO3溶液对其进行进一步处理。研究表明,用0.2 mol·L-1的HNO3溶液在30 ℃下处理6 h的样品具有最佳的催化性能和优异的耐水性,并且当空速(催化剂单位质量与时间接触到的空气体积)为120 L·g-1·h-1,空气中的含水量为1.5%(即水在空气中所占的体积分数为1.5%),反应温度为250 ℃时,浓度为3.18×10-4苯的去除率约为94%。与原始MnO2相比,酸处理的样品不仅具有更多的氧空位,而且具有更高的氧空位活性,高活性晶格氧和表面吸附氧会与活化的苯反应(图8)。Zhang等[102]对不同煅烧温度下的多孔Mn2O3立方体进行研究,结果发现,随着煅烧温度的升高,各种Mn2O3样品对CO的催化氧化的能力强弱顺序为Mn2O3-700>Mn2O3-650>Mn2O3-550>Mn2O3-800。

图8 H-MnO2上苯氧化的示意图[101]

表4 MnOX对甲苯的催化氧化
3.2.2 重金属吸附
MnOX因其自身存在较多的结构缺陷,容易产生大量氧空位,使其对某些重金属具有强烈的吸收和富集作用。Gheju等[106]研究了MnO2吸附Cr(Ⅵ)的影响因素,结果显示,MnO2对Cr(Ⅵ)的吸附能力受到溶液的pH值、温度、Cr(Ⅵ)的初始浓度等因素的影响。随着酸度的增加,吸附能力增强,但温度和Cr(Ⅵ)初始浓度升高,则起到抑制作用。Xu等[107]也以MnO2为例,通过水热法合成了带状的α-MnO2、棒状的β-MnO2和纺锤状的γ-MnO2。作者发现不同晶体结构的MnO2对单质汞的吸附能力是有差异的,同等条件下的吸附能力按照以下顺序递增:β-MnO2<γ-MnO2<α-MnO2。α-MnO2的高比表面积和氧化性提高了其作为Hg0捕获材料的潜力。此外,MnO2对废水中具有放射性的重金属也有较好的吸附作用。Liu等[108]通过水热法合成了具有不同形貌的α-MnO2,β-MnO2,γ-MnO2和δ-MnO2,并考察了它们对U(Ⅵ)的吸附性能。研究发现,最大吸附量(pH=6,298 K)依次为δ-MnO2(304.92 mg·g-1)>α-MnO2(289.42 mg·g-1)>γ-MnO2(277.09 mg·g-1)>β-MnO2(257.84 mg·g-1)。这可能是因为δ-MnO2具有层状结构,结晶度差,比表面积和孔容最大,有利于U(Ⅵ)在层间扩散,有效利用吸附位点,从而提高对U(Ⅵ)的吸附。从图9可以看出,MnO2对U(Ⅵ)的吸附主要归因于各种含氧官能团的表面络合。
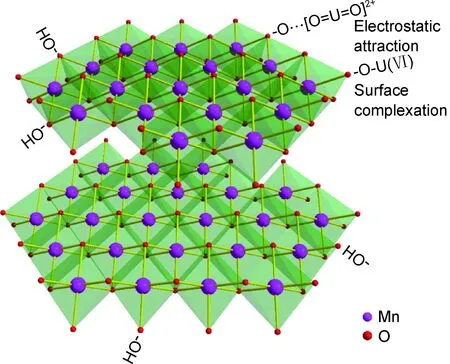
图9 U(Ⅵ)在δ-MnO2上的吸附机制图[108]
实验表明,不同的制备方法会影响锰氧化物的晶型、形貌和比表面积,从而导致MnOX的性能发生改变(表5[18,109-113])。因此,研究各种MnOX的吸附能力及影响性能的因素,对水中重金属污染物的去除有重要的理论和实践意义。

表5 不同形貌MnOX对重金属的吸附应用
3.2.3 水中有机污染物去除
有机染料会影响水中生物的光合作用,破坏水生生态系统[114-115]。因此,有必要去除水中的染料,以防止其对人类和环境造成危害。在各种可用的吸附剂中,MnOX由于生产成本低、比表面积大、结构独特,因而在水处理中具有发展前景[116]。从Liu等[117]的实验可以得出,各种锰氧化物对甲基橙的吸附能力在很大程度上取决于晶体结构和形貌,并依次为A-MnO2(无定形的MnO2)>Mn2O3>Mn3O4>α-MnO2纳米线>β-MnO2>γ-MnO2>α-MnO2纳米管>δ-MnO2(图10),这说明增加比表面积和增强孔性能可以很大程度地提高锰氧化物的吸附性能。Jiang等[118]通过简单的水浴法合成了棕褐色δ-MnO2纳米片,其对亚甲基蓝的最大吸附量达到267.6 mg·g-1。为了进一步提高δ-MnO2的吸附能力,作者又合成了由δ-MnO2和氧化石墨烯(GO)组成的混合物,吸附量高达1432.0 mg·g-1。这种超高的吸附能力源自δ-MnO2与GO复合后的物质孔径增大,显著增强了颗粒内扩散。Qi等[119]先以CO2气体为唯一碳酸盐源的改良炭化法制备了MnCO3,再通过MnCO3热分解合成了具有球形形态和中孔特征的单分散Mn2O3粉末。所制备的Mn2O3对水溶液中的刚果红染料具有135.5 mg·g-1的高吸附容量,这主要归因于Mn2O3微球的带正电荷表面和单分散性。此外,吸附染料后,Mn2O3吸附剂可以通过简单的煅烧再生,并显示出良好的回收利用性。
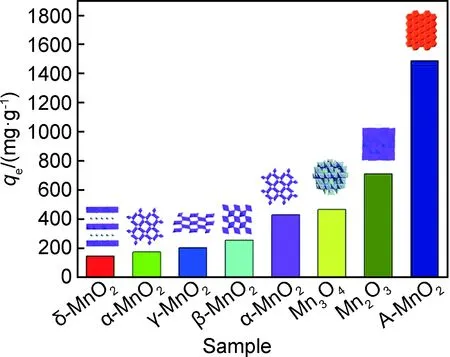
图10 锰氧化物的结构与甲基橙吸附能力的关系图[117]
近几十年来,造纸、染料、纺织、皮革和塑料等行业的废水中出现各种合成染料,对环境造成了严重影响。为了环境保护,必须去除废水中的染料。通过研究表明,MnOX作为吸附剂,可以有效地吸附刚果红、甲基蓝、亚甲基蓝等有机染料(表6[120-125])。同一吸附剂可以吸附不同的染料,不同吸附剂对同一染料的吸附性能不相同,这可能与其形貌和比表面积等有关。MnOX的研究与应用,对开发经济实惠、环境友好、易于获得和高性能的水处理吸附剂奠定了坚实的基础。

表6 不同MnOX对水中有机污染物的吸附应用
4 结束语
锰氧化物由于其特有的晶型和形貌可变、氧化还原能力强、可循环利用等优势,现已成为一种重要的功能材料。α-MnO2,β-MnO2和γ-MnO2具有一维隧道结构,δ-MnO2和λ-MnO2分别具有二维层状结构和三维网状结构。根据合成条件的不同,MnOX可以表现出不同的形态,如棒状、花状、球状等。氧空位在金属氧化物中很常见,可以作为非均相催化反应的吸附和活性位点。氧空位的存在有利于氧分子活化成活性氧物种。因此,氧空位的数量越多,吸附性能、催化性能越好。虽然MnOX材料的性能很大程度上取决于其表面的结构和活性位点,但结构和活性位点又进一步取决于其晶型和形貌。因此,晶型和形貌控制是提高纳米材料质量和性能的重要技术。
本文综述了不同晶型、不同形貌的MnOX纳米材料在生物质催化转化、电化学、气体污染物分解、重金属吸附、有机污染物降解等方面的典型应用。尽管,国内外学者关于MnOX的研究开展了许多有价值的工作,但对MnOX作用机理的研究仍有待深入。例如,反应物在MnOX催化剂表面的转化过程,催化剂活性位点具体结构及其与反应物的反应机制。到目前为止,实现高性能MnOX仍然是一项具有挑战性的工作,在进一步发展之前,需要解决一些关键性问题:(1)MnOX作用机理复杂,往往涉及多种机制,因此迫切需要精确的理论计算来获得催化氧化机制、吸附转化机制、电荷存储机制等详细信息。(2)在MnOX的合成过程中,MnO,MnO2,Mn2O3,Mn3O4等多种稳定的氧化物往往同时存在,而且MnOX的结晶形式多种多样,不同的结晶形式具有不同的隧道结构,这就导致了性能的不同。因此,需要根据实际应用的目的选择适合的制备方法。(3)MnOX稳定性较差,在高温、高湿度、SO2气体等条件下容易引起结构变化,造成性能降低,这也是MnOX在燃煤电厂NOx还原降解应用中的主要问题之一。MnOX外部构筑一层保护壳有望能提升其稳定性。(4)单独的MnOX应用范围还有限,掺杂其他金属可调节其化学键强度、晶体结构、电子结构、氧空位等,从而提高活性氧移动性,增强催化性能。目前已有一些金属阳离子的掺杂报道(如Co,Cu,Ce等),然而对于阴离子的掺杂报道还较少,N,B等元素对MnOX性能的影响还有待研究。(5)纳米MnOX容易团聚,使得规模化生产具有较大的难度。另外,其容易悬浮在水体中,难以回收利用。虽然磁改性一定程度是解决该问题,但实际应用还是会遇到较大问题。
尽管锰氧化物还存在以上问题需要继续研究,但毫无疑问,其作为一种重要的金属氧化物,未来在环境、能源等领域具有十分广阔的应用前景。为进一步提升锰氧化物的性能和拓宽应用范围,可将MnOX与其他新型材料如共价有机骨架材料(COF),氢键有机骨架材料(HOF),MXene材料等进行耦合。水蒸气中毒是限制锰氧化物在燃煤烟气净化领域工业化应用的一个主要原因,未来可重点研究锰氧化物的抗水性能,如对其进行氟硅改性,提高疏水性能。此外,由于其较好的氧化性能,锰氧化物有望替代传统高毒钒基催化剂,应用在生物质催化氧化生产有机酸领域。

