一株淡紫紫孢菌的分离、鉴定及生物学特性研究
柯心如,刘登艳,谭建彬,苏 琦,李 亚
(广东海洋大学滨海农业学院,广东 湛江 524088)
【研究意义】植物寄生线虫是植物侵染性病害的主要病原物之一,每年给世界各地的主要经济作物造成高达1 570 亿美元损失,其中根结线虫(Meloidogynespp.)是为害最严重的植物寄生线虫,由于其分布广泛、寄主众多,已成为威胁农业生产的重要病原[1]。目前对根结线虫的防治主要以化学药剂防治为主,但该防治方法生产成本较高,对环境造成污染,同时也对人畜健康存在潜在威胁[2]。而生防制剂作为一种环境友好的化学药剂替代品逐渐引起人们的重视,可通过充分利用线虫天敌的生防手段来防治植物线虫。而淡紫紫孢菌(Purpureocillium lilacinum)能有效防治根结线虫,是一种极具推广潜力的习居菌和功能菌[3-4]。研究表明,淡紫紫孢菌可用于防治马铃薯、番茄、小麦及香蕉等几十种经济作物的线虫病,且防效与进口的化学杀线虫药相当或接近,成本较低,不污染农产品和环境[5-8]。因此,探究不同培养条件对淡紫紫孢菌生长特性的影响,对充分挖掘该菌的生防潜能具有重要意义。【前人研究进展】淡紫紫孢菌原名为淡紫拟青霉(Paecilomyces lilacinus),最初由Jatala 于1979 年在南方根结线虫卵中分离获得[9-10]。该菌能通过分泌菌丝寄生根结线虫的虫卵或通过分泌几丁质酶和丝氨酸蛋白酶降解线虫表皮的几丁质和蛋白质成分,从而入侵并破坏细胞成分,对根结线虫幼虫具有毒杀作用[11]。然而,国内外对拟青霉属真菌研究较少,对抗线虫的防治主要集中在侵染机制等方面。杨凡等[12]测定了淡紫紫孢菌pt361 对黄瓜根结线虫卵的寄生率、幼虫致死率,结果发现pt361 菌株对线虫虫卵的寄生率为72.6%,其菌株混合发酵液对幼虫的致死率达95.2%。Gine 等[6]研究抗性番茄与淡紫紫孢菌PI251 菌株组合对抗南方根结线虫的有效性,结果表明该菌在体外条件下可寄生94.5%根结线虫的虫卵。同时,也有部分学者对该菌的生长特性等进行研究,例如,范瑞琦等[13]从为害海南省茄子根结线虫雌虫体内分离的淡紫紫孢菌最适培养基为PDA,最佳生长温度和产孢温度均为28℃,最适pH 为7.0,完全黑暗条件更有利于菌株生长、产孢及孢子萌发。【本研究切入点】目前,大多数研究主要集中于淡紫紫孢菌与根结线虫的互作机制及该菌生长特性等方面,但针对不同环境对淡紫紫孢菌发酵所产蛋白酶、几丁质酶的相关研究报道极少。【拟解决的关键问题】确定适合淡紫紫孢菌生长、产蛋白酶和几丁质酶的最适温度和pH 值,以及常见氮源和碳源物质,帮助菌株建立最佳生长和收获条件,以达到最大生防活性,为该菌大量繁殖作为生物防治剂的后续研究及应用提供理论基础。
1 材料与方法
1.1 试验材料
供试材料为具有柑橘粉虱座壳孢子座的红江橙树叶片,于2017 年12 月份采集自广东廉江红江农场的橙树果园。
供试培养基:(1)PDA 培养基:马铃薯200 g、琼脂粉20 g、葡萄糖20 g、蒸馏水1 000 mL;(2)PDA 液体培养基以不加琼脂配置。上述培养基均于121℃高压灭菌20 min 后备用。
主要试剂:细菌基因组DNA 快速抽提试剂盒、扩增引物由生工生物工程(上海)股份有限公司合成,其他化学试剂均为国产分析纯。
1.2 菌株分离纯化
将柑橘粉虱座壳孢子座用无菌水冲洗后,经75%乙醇浸泡30 s,转入0.1%升汞溶液中浸泡30 s,然后用无菌水清洗3~5 次。把表面消毒好的子座研磨后放入1.5 mL 离心管中,加入1 mL无菌水制成孢子悬浮液,取100 μL 接种于含有利福平的PDA 培养基中,28℃培养。待长出菌丝或菌落后,挑取具有典型菌落特征的单菌落进行纯化,获得编号为ZJPL1812 的菌株,将纯化后的菌株接种于试管斜面,保存备用。
1.3 菌株鉴定
1.3.1 形态鉴定 从纯化ZJPL1812 菌株的单菌落中取直径0.5 cm 的菌饼接于PDA 平板中央,培养7 d 后观察菌落外观特征,并通过光学显微镜观察菌丝、分生孢子梗以及分生孢子的形态特征,参照《真菌鉴定手册》[14]进行形态学鉴定。
1.3.2 分子鉴定 参照White 等[15]设计的通用引物ITS1(5′-TCCGTAGGT-GAACCTGCGG-3′)和ITS4(5′-TCCTCCGCT-TATTGATATGC-3′)进行真菌的rDNA-ITS 序列扩增。PCR 反应体系共50 μL,反应条件为:96℃预变性5 min;95℃变性45 s、55℃复性30 s、72℃延伸60 s,35 个循环;72℃延伸7 min。PCR 完成后取5 μL 产物经1.0%琼脂糖凝胶电泳检测,电压120 V,电泳25 min,通过凝胶成像系统观察目的条带。将目的条带的PCR 产物送至英潍捷基(上海)贸易有限公司测序。利用NCBI Blast 进行序列比对,并采用MEGA11 通过Neighbor-Joining 算法构建系统发育树。
1.4 菌株生物学特性研究
1.4.1 不同培养条件对菌株生长的影响 供试菌株在PDA 平板上培养7 d 后,加入10 mL 无菌水,刮取孢子丝和孢子制成菌悬液,用双层纱布过滤制成孢子悬浮液,将孢子悬浮液浓度调整至1×109个/mL 备用。
(1)温度:将1 mL 孢子悬浮液加入100 mL PDA 液体培养基中,分别在10、15、20、25、30、35℃条件下避光振荡(180 r/min)培养,每个处理3 次重复。
(2)pH 值:用0.1 mol/L HCl 和NaOH 溶液将100 mL PDA液体培养基pH值调至3.0、5.0、7.0、9.0、11.0,随后分别加入孢子悬浮液1 mL,30℃下避光振荡(180 r/min)培养,每个处理3 次重复。
(3)氮源:以PDA 液体培养基为基础培养基,分别添加5 g/L 的硝酸铵、硝酸钠、精氨酸和磷酸二氢铵,配制成不同氮源的培养基。随后在各类型氮源培养基中分别加入孢子悬浮液1 mL,30℃下避光振荡(180 r/min)培养,每个处理3 次重复。
(4)碳源:以PDA 液体培养基为基础培养基,分别以20 g/L 的蔗糖、麦芽糖、山梨醇和可溶性淀粉代替基础培养基中的葡萄糖,配制不同碳源的培养基。随后在各类型碳源培养基中分别加入孢子悬浮液1 mL,30℃下避光振荡(180 r/min)培养,每个处理3 次重复。
待测菌株在不同类 型培养基中培养5 d 后,将培养液于8 000 r/min 下离心20 min,过滤收集菌丝体,于60℃下干燥至恒重,并称重。
1.4.2 不同培养条件对菌株蛋白酶活性的影响 待测菌株在1.4.1 不同类型培养基中培养5 d后,将培养液于8 000 r/min 下离心20 min,除去菌体取上清,其中的蛋白酶用(NH4)2SO4沉淀后再经透析袋透析获得粗酶液[16]。
标准曲线参照张龙翔等[17]的方法制作,蛋白酶活性的测定采用Folin-酚法[18]。测得的吸光值(OD)通过标准曲线计算出相应的酪氨酸浓度,根据公式计算出酶活。以每毫升样品在40℃下每分钟催化分解酪蛋白生成1 μg 酪氨酸的酶量为一个酶活力单位(U)。
蛋白酶活力(U/mL)=K1×△A680×N×4/10
式中,K1 为根据标准曲线求得光密度为1 时对应的酪氨酸浓度;△A680 为OD680样品-OD680对照;N 为酶液稀释倍数;4 表示2 mL 反应液中取0.5 mL 进行显色反应;10 表示反应时间为10 min。
1.4.3 不同培养条件对菌株几丁质酶活性的影响 待测菌株在1.4.1 不同类型培养基中培养5 d 后,将培养液于8 000 r/min 下离心20 min,除去菌体取上清,经0.45 μm 的混合纤维素膜过滤后制成粗酶液。
标准曲线参照邓彩萍等[19]的方法制作,几丁质酶活性的测定采用DNS(3,5-二硝基水扬酸)法[20]。测得的OD 值通过标准曲线计算出相应的NAG(N-乙酰氨基葡萄糖)浓度,根据公式计算出酶活。以每毫升发酵液每分钟水解脱乙酰胶体几丁质产生1 μg NAG 的酶量为一个酶活力单位(U)。
几丁质酶活力(U/mL)=K2×△A530×N×2/60
式中,K2 为根据标准曲线求得光密度为1 时对应的NAG 浓度;△A530 为OD530样品-OD530对照;N 为酶液稀释倍数;2 表示1 mL 反应液中取0.5 mL 进行显色反应;60 表示反应时间为60 min。
1.5 数据处理与分析
试验数据采用SPSS 26.0 软件中的方差分析(ANOVA)和Duncan’s新复极差法分析差异显著性,运用GraphPad Prism 9.0 进行数据处理和图片绘制。
2 结果与分析
2.1 菌株ZJPL1812 的分离和纯化
从广东廉江红江农场采集的柑橘粉虱座壳孢子座如图1 所示,肉质子座多位于柑橘叶片背面,成熟的子座中间为橙黄色,边缘呈黄色,与叶片连接处可见白色菌丝,子座中间乳突状隆起,其中有多个不规则孔口,可分泌蜜汁或胶质,从该子座中分离纯化得到ZJPL1812 菌株。

图1 柑橘粉虱座壳孢子座和纯化的ZJPL1812 菌落形态Fig.1 Stroma of Aschersonia aleyrodis and colonies morphology of purified ZJPL1812
2.2 菌株ZJPL1812 的鉴定结果
2.2.1 形态学特征 菌株ZJPL1812 在PDA 固体培养基上,初期菌丝白色、致密,表面无分泌物,菌落形态有同心轮纹状(图2A),也有呈分散状态的绒毛状(图2B),随着培养时间的延长,菌落中心由淡紫色逐渐变为灰黑色(图2C)。
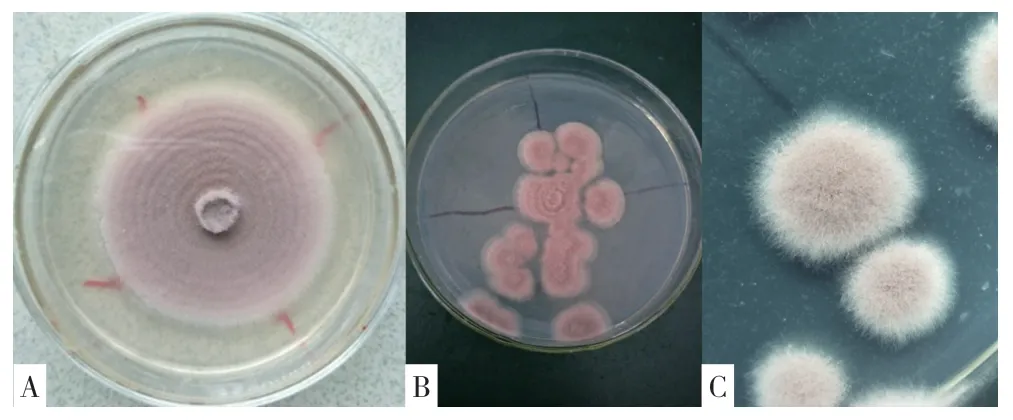
图2 菌株ZJPL1812 的菌落形态特征Fig.2 Morphological characteristics of colonies of strain ZJPL1812
该菌株菌丝狭长、无色、具分隔,产孢方式为内壁芽生瓶梗式(图3A),瓶梗基部有明显膨大,顶端逐渐变细(图3B、图3C),分生孢子梗顶端多次轮生烧瓶状产孢瓶梗,顶生分生孢子,分生孢子透明、串生,单个孢子椭圆形或近圆形、大小为2.5~3.2 μm×2.0~2.2 μm(图3D)。

图3 菌株ZJPL1812 的形态特征Fig.3 Morphological characteristics of strain ZJPL1812
2.2.2 分子鉴定 利用通用引物ITS1 和ITS4 对分离得到的ZJPL1812 菌株DNA 进行扩增,经电泳分析获得1 条约500 bp 的条带(图4)。经序列测定,片段大小为376 bp。将ZJPL1812菌株的ITS 序列在NCBI 中进行Blast 比对分析,结果显示该菌株与GenBank 中多个淡紫紫孢菌菌株(Purpureocillium lilacinum,登录号:MH483735.1、MH483859.1、MH483660.1)的 同源性为99%~100%。通过MEGA11 软件进行相关分析并构建系 统发育树,结果表明ZJPL1812菌株与多个淡紫紫孢菌(P.lilacinum)聚在一支(图5),结合形态学特征,将ZJPL1812 菌株鉴定为淡紫紫孢菌(P.lilacinum)。
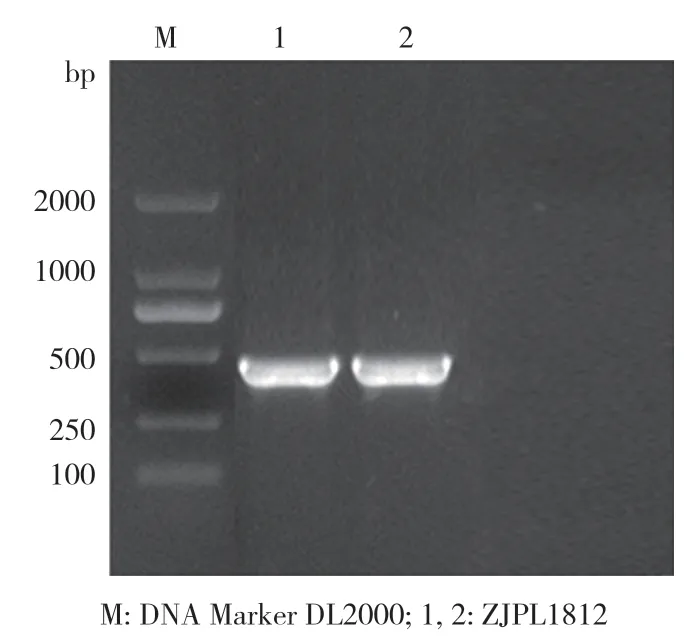
图4 菌株ZJPL1812 ITS 区PCR 扩增产物电泳结果Fig.4 Electrophoretogram of PCR amplification results in ITS region of strain ZJPL1812

图5 基于rDNA-ITS 序列构建的菌株ZJPL1812 系统发育树Fig.5 Phylogenetic tree of strain ZJPL1812 constructed based on rDNA-ITS sequence
2.3 不同培养条件对菌株ZJPL1812 生物量的影响
温度对菌株ZJPL1812 的生物量积累具有显著影响,不同温度处理间差异显著(图6A),当温度为10℃时菌丝几乎不生长,15~35℃范围内菌丝均能生长,但在15、35℃条件下菌丝生长受到明显抑制,30℃时菌丝干质量最大、达到3.4 g/L。可见,该菌株最适培养温度为30℃,该温度下的菌株生长情况与其他培养温度相比均达到显著差异。不同pH 值对该菌株生长的影响结果(图6B)表明,该菌株能耐受较广的酸碱度范围,在pH 5.0~9.0 范围内均生长良好,各处理间菌丝体干质量无显著差异,在pH 3.0 和pH 11.0 条件下生长相对较差、生物量积累较少。该菌株在供试的7 种不同氮源培养基上生长状态不同(图6C),对不同氮源培养基培养5 d 后的菌丝体干质量测定结果显示,以硫酸铵、磷酸二氢铵为氮源的培养基菌丝体干质量最大,分别可达1.585、1.667 g/L,但二者之间无显著差异;随后依次为蛋白胨、精氨酸和硝酸胺,菌丝体干质量分别为0.965、0.697、0.667 g/L;以硝酸钠为氮源和无氮源条件下菌丝生长较弱,表明以硫酸铵、磷酸二氢铵为氮源比较适合该菌株生长。不同碳源培养基对该菌株的生物量积累差异显著(图6D),其中在以麦芽糖为碳源的培养基上长势最好,菌丝体干质量最大达3.013 g/L,且与其他供试碳源之间差异显著;可溶性淀粉和山梨醇次之,菌丝体干质量分别为1.673、1.540 g/L;而以蔗糖、葡萄糖为碳源时长势最差,菌丝体干质量低。
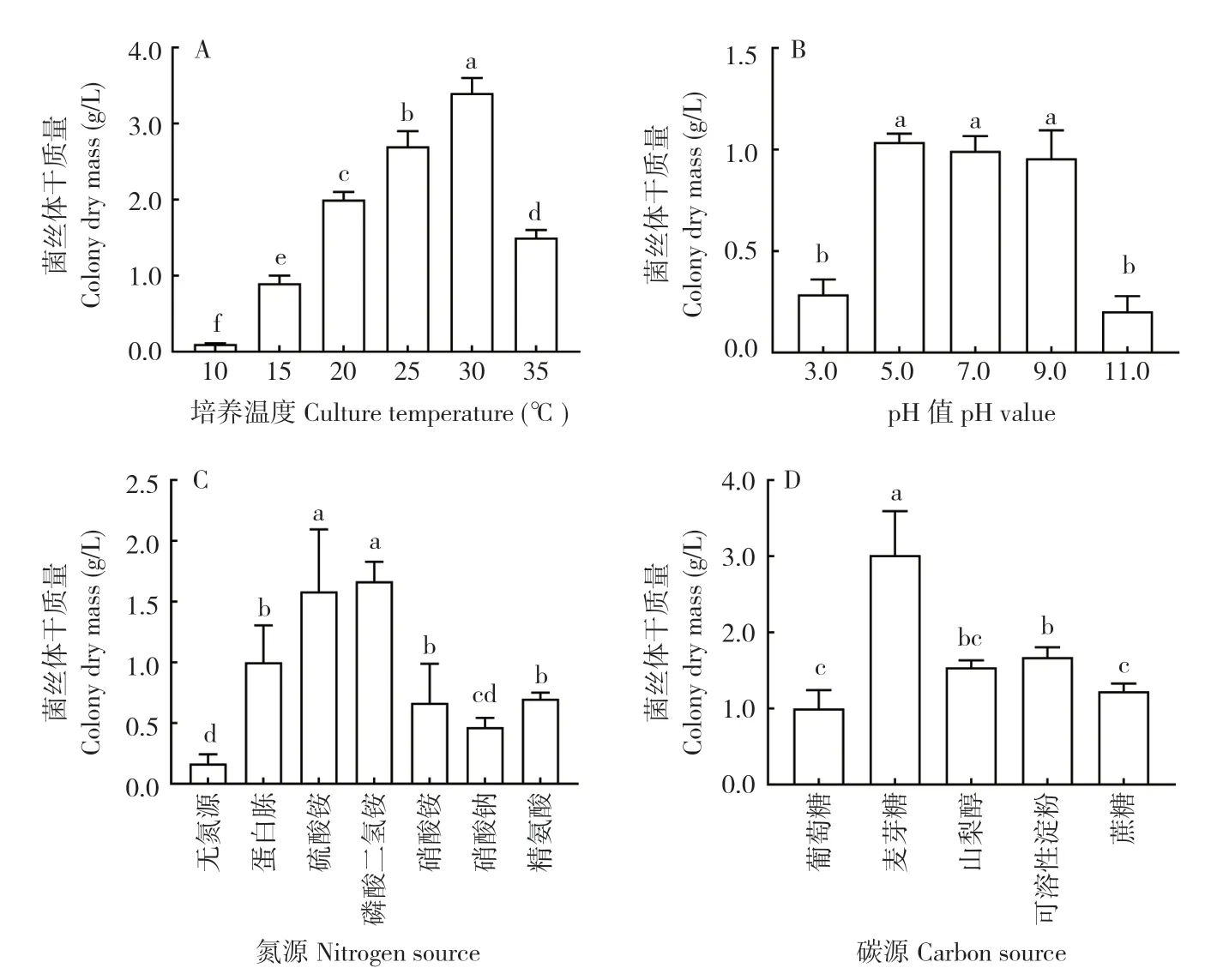
图6 不同培养条件对菌株ZJPL1812 生物量的影响Fig.6 Effects of different culture conditions on the biomass of strain ZJPL1812
2.4 不同培养条件对菌株ZJPL1812 蛋白酶活性的影响
由菌株ZJPL1812 产生的蛋白酶在10~35℃均有活性,最适反应温度为25~30℃,酶活性分别可达0.47、0.63 U/mL,但差异不显著;当温度在10~30℃时,蛋白酶活性随温度升高而上升、超过30℃迅速下降(图7A)。在pH 值3.0~11.0 范围内,pH 为5.0、7.0 和9.0 时蛋白酶活性最高,分别为3.556、3.133、2.545 U/mL,三者之间差异不显著;当培养基pH 过高或过低(pH 为11.0或3.0)时,蛋白酶活性最低,分别为0.467、0.256 U/mL(图7B)。可见,该菌株在中性、弱酸和弱碱环境条件下所产生的蛋白酶活性较高。菌株ZJPL1812 产生的蛋白酶在不同氮源培养基上活性不同,以蛋白胨为氮源时酶活性最高,其次为硫酸铵、精氨酸、硝酸钠、硝酸铵,但在以磷酸二氢铵为氮源时蛋白酶活性极低,与不含氮源的培养基无显著差异(图7C)。不同碳 源对ZJPL1812 蛋白酶活性影响结果表明,以蔗糖为碳源时蛋白酶活性最高,麦芽糖、可溶性淀粉、山梨醇次之,而以葡萄糖作为碳源时长势最差、酶活性最低(图7D)。

图7 不同培养条件对菌株ZJPL1812 蛋白酶活性的影响Fig.7 Effects of different culture conditions on the protease activity of strain ZJPL1812
2.5 不同培养条件对菌株ZJPL1812 几丁质酶活性的影响
在温度10~30℃范围内,该菌所产几丁质酶活性随温度上升逐渐提高,至30℃时达到最大值0.910 U/mL,是10℃时几丁质酶活性的20 倍;随着温度上升几丁质酶活性开始下降,35℃时几丁质酶活性仅有30℃时的6 8%(图8A)。可见,环境温度小于10℃或高于35℃均会使该菌所产生的几丁质酶活性降低。菌株ZJPL1812 在供试的5 种pH 条件下均有活性(图8B),pH 5.0~7.0时酶活性较高,在pH 3.0 或pH 9.0~11.0 条件下酶活性较低,与前者具有显著差异。氮源对ZJPL1812 发酵产几丁质酶的结果表明,以硝酸铵为氮源时产几丁质酶活性最高(0.230 U/mL),其次是磷酸二氢铵,在蛋白胨、硝酸钠、精氨酸、硫酸铵为氮源的培养基中酶活性均较低,其中以硫酸铵效果最差(图8C),与无氮源培养基无显著差异。菌株ZJPL1812 在不同碳源培养基上的几丁质酶活性不同(图8D),在以可溶性淀粉、葡萄糖为碳源的培养基上酶活性最高,且均显著高于其他碳源处理,在麦芽糖、山梨醇、蔗糖上酶活性较低,三者之间无显著差异。
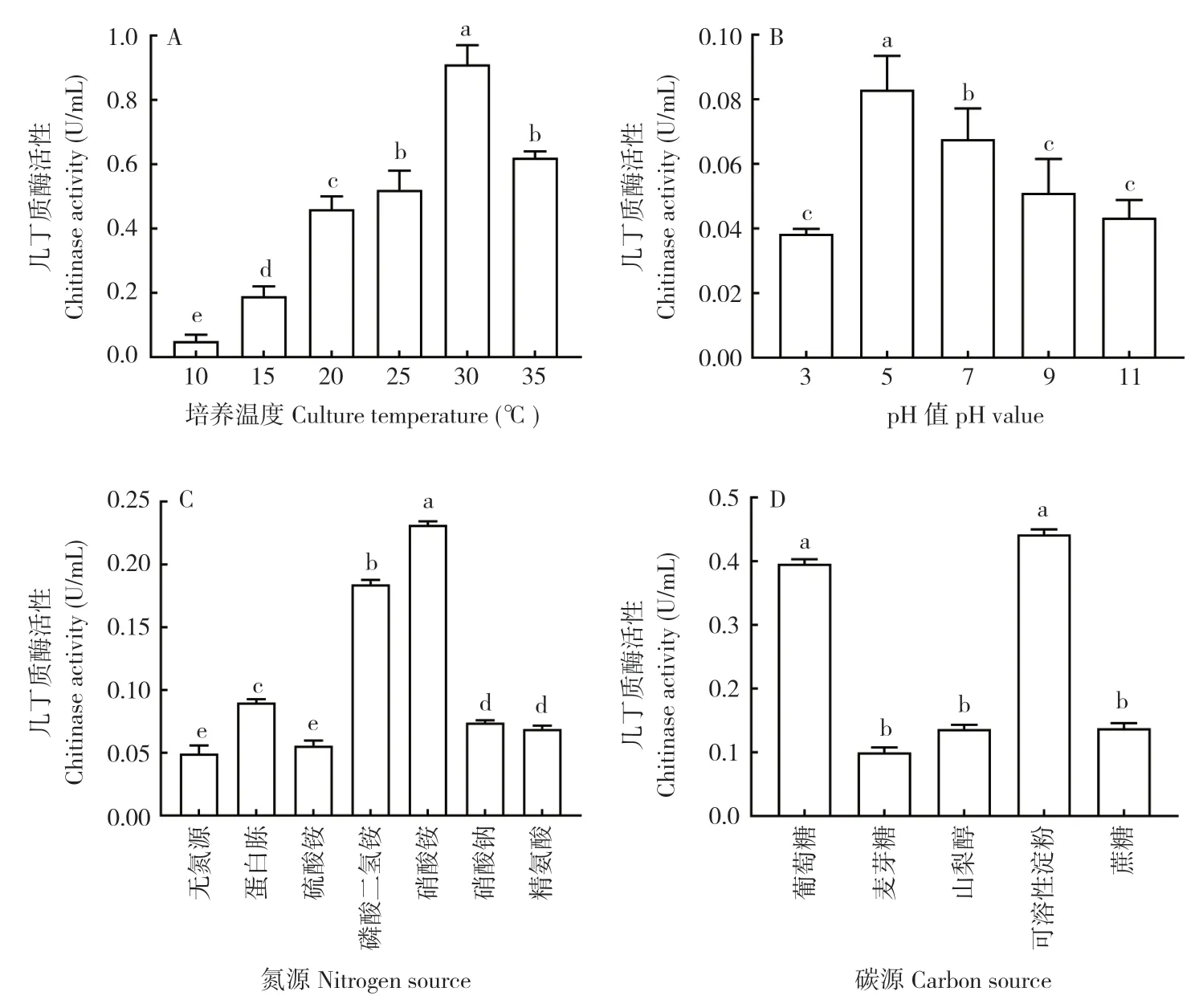
图8 不同培养条件对菌株ZJPL1812 几丁质酶活性的影响Fig.8 Effects of different culture conditions on the chitinase activity of strain ZJPL1812
3 讨论
柑橘粉虱座壳孢子座是由柑橘粉虱座壳孢菌(Aschersoni a aleyrodis)侵染柑橘粉虱各龄幼虫之后形成的。本研究从该子座中除分离到柑橘粉虱座壳孢菌外,还成功分离到菌株ZJPL1812,经形态学和分子鉴定确认为淡紫紫孢菌,表明在雷州半岛除粉虱座壳孢菌外,淡紫紫孢菌也可能对柑橘粉虱的种群控制有着重要贡献。有研究表明,淡紫紫孢菌孢子可以侵染柑橘木虱成虫[21],此外,该菌还广泛应用于防治棉花蚜虫(Aphis gossypiiGlover)[22]、萝卜蚜(Lipalus erysimi)[23]、切叶蚁(Acromyrmex)[24]和甘薯粉虱(Bemisia tabaci)[25]等。因此,研究淡紫紫孢菌的适宜生长环境和营养条件,实现菌株最优培养,并大量生产淡紫紫孢菌,对该菌后续作为生物防治剂的应用具有重要意义。
本研究通过对菌株ZJPL1812 生物学特性的初步研究发现,该菌在15~35℃条件下均可生长,其中30℃最适合,这与Girardi 等[26]、邓嘉茹等[27]研究结果基本一致。同时,发酵温度对产酶(蛋白酶、几丁质酶)影响结果表明,该菌具有较广的产酶温度范围(10~35℃),以30℃为最适温度。已报道的淡紫紫孢菌最适产几丁质酶温度也多在30℃左右[28-29],少数菌株需要更高的发酵温度(60℃)[30]。综合前人及本研究结果可知,该菌所需的生长、产酶温度范围较广,但最佳生长温度、产酶温度较窄,因此在实际应用中应确定适当施用时机,不宜在长时间较高温或较低温的季节施用,以保证菌株活性及防治效果。
本研究显示菌株ZJPL1812 在pH 5.0~9.0 条件下均可生长,表明该菌能适应弱酸性或弱碱性的生长环境。而根结线虫适宜的土壤pH 值为4.0~8.0、生长发育温度为20~28℃,与该菌适宜生长环境条件相吻合。这有利于该菌的田间应用,可在一定程度上缓解根结线虫病害。
微生物所产蛋白酶、几丁质酶根据所适应的pH 值不同可以分为酸性、中性和碱性,而真菌产蛋白酶、几丁质酶多为酸性蛋白,其蛋白酶反应的最适pH 范围为3.8~5.6,几丁质酶最适pH 范围为4.0~7.0[31-32]。本试验中ZJPL1812 发酵产蛋白酶、几丁质酶均在pH 值为5.0~9.0 内保持稳定,且在pH 值5.0 时保持较高活性,属于酸性蛋白酶和酸性几丁质酶,表明该菌所产酶的pH 值稳定范围较宽、酸碱耐受性很强,适于工业生产。
此外,有研究表明淡紫拟青霉(即淡紫紫孢菌)能利用多种碳源(单糖、寡糖、多糖)和多种氮源(有机、无机、硝态氮和氨态氮),简单无机物质(迅速利用型,如氨态氮)易于被菌体吸收利用[33]。本试验在研究培养基碳源、氮源对淡紫紫孢菌生长的影响等方面与已报道的淡紫拟青霉有相似之处,该菌在无机氮源上产生的菌丝干质量显著高于有机氮培养基,但在碳源中对麦芽糖的利用率最佳,这与肖顺“选用结构较为复杂的可溶性淀粉为最适碳源,最利于菌株的液体培养”[34]的研究结果不同。这可能是由于淡紫紫孢菌为土壤寄生真菌,其生物学特性与土壤环境中的多种因素有关,不同地区、不同物种所分离得到的菌株生物学特性存在差异。
除温度、pH 值条件外,营养成分条件也是影响淡紫紫孢菌发酵产酶的重要因素之一。不同菌株对氮源的利用和产蛋白酶情况相同,本试验结果表明蛋白胨是提高产蛋白酶的有效氮源,这与赵培静等“蛋白胨对于淡紫拟青霉的蛋白酶高产有促进效果”[35]的结论相同,表明高分子有机氮对蛋白酶具有诱导作用。但不同菌株对氮源的利用和产几丁质酶情况并不相同,张馨月等[29]采用固体发酵淡紫紫孢菌产几丁质酶以蛋白胨作氮源时活性达到最高,而本研究所产的几丁质酶以硝酸铵为最佳氮源、以蛋白胨为氮源时活性较低,表明无机氮比有机氮诱导产酶效果更佳。已有报道表明,在淡紫拟青霉产几丁质酶时以壳聚糖作为诱导底物并添加葡萄糖,可使几丁质酶产量维持在较稳定水平,但整体产酶量不高,可能是产生了葡萄糖效应。本研究中以葡萄糖为碳源时的淡紫紫孢菌产酶能力在所供试碳源中最佳。
以上研究结果表明,菌株ZJPL1812 具有较强的环境适应能力和较广泛的酸碱适应能力,同时还可以利用多种氮源和碳源。但自然筛选菌株所产蛋白酶、几丁质酶的能力较低,为进一步提高酶活性、促进淡紫紫孢菌作为生物防治剂商业化发展,还需要通过复合诱变技术筛选高产菌株,或者通过基因重组技术进行蛋白酶、几丁质酶基因的序列分析、克隆表达和生产。
4 结论
本研究通过对红江橙叶片粉虱座壳孢上的菌株进行分离纯化及鉴定,确定菌株ZJPL1812 为淡紫紫孢菌(Purpureocillium lilacinum)。对其生物学特性研究发现,该菌最佳培养温度为30℃、适宜pH 值为5.0~9.0;可利用多种不同碳源、氮源,以磷酸二氢铵为氮源、麦芽糖为碳源时最有利于菌丝生长,以蛋白胨为氮源、蔗糖为碳源时产蛋白酶活性最高,以硝酸铵为氮源、可溶性淀粉为碳源时几丁质酶活性最高。该菌株所产蛋白酶和几丁质酶活性较高,具有一定的生物防治潜力。

