关于酶活性的两个疑问
欧阳一鸣
(湖北省荆州中学 湖北荆州 434000)
1 溶酶体酶泄露后活性升高还是降低
在高中生物学教学中,师生一般认为溶酶体酶泄露后活性降低,这一点在翟中和主编的《细胞生物学》中也有体现:少量的溶酶体酶泄露到细胞质基质中,并不会引起细胞损伤,其主要原因是细胞质基质中的pH约为7.0。在这种环境中,溶酶体酶的活性大大降低。但是,该教材中关于溶酶体发现历程的描述,对泄露后的溶酶体酶活性却有截然相反的说法:1949年,德迪夫利用大鼠肝组织匀浆离心得到了线粒体组分,在测定组分中酸性磷酸酶活性时出现了一些反常现象,如蒸馏水提取物中的活性比在蔗糖渗透平衡抽提物中酶的活性高。放置一段时间的抽提物比新鲜制品中的酶活性高,且酶活性与沉淀物线粒体无关,从而推测出线粒体中还存在一种新的细胞器。1955年,通过电子显微镜确定了溶酶体的存在。这部分内容似乎认为溶酶体破损后释放的酶活性会升高,因为用蒸馏水处理显然会导致溶酶体吸水破裂释放溶酶体酶,而放置一段时间应该有类似效果。
为了进一步证实推测,笔者查阅了贴近原始实验的数据:
新鲜的细胞匀浆及各离心组分在冰箱放置一段时间后,酸性磷酸酶(可以使磷酸化合物水解产生磷酸盐)活性大幅上升(表1)。德迪夫据表推测组分放置冰箱后,由于冻存而损伤膜结构,导致这种膜结构含有的酶释放而增加酶活性,据此认为酸性磷酸酶也是一种膜包被的酶。可知这里酶活性的上升指的应该是酶量的增加。
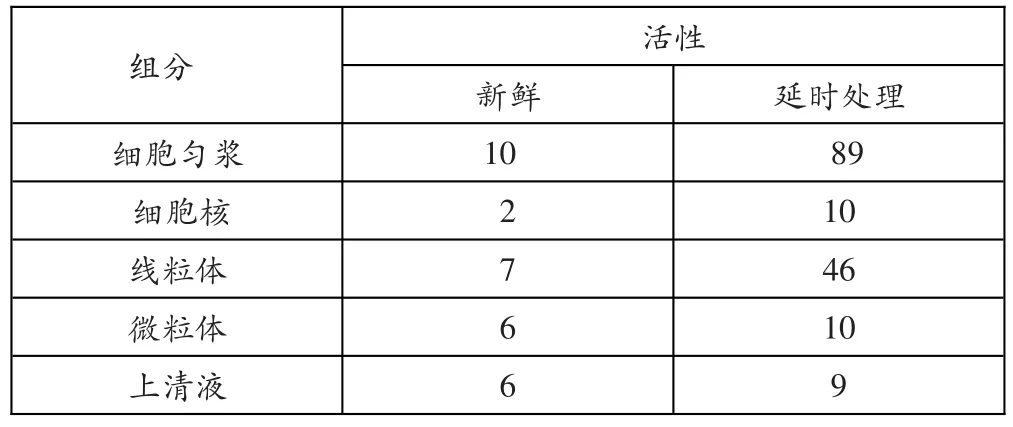
表1 酸性磷酸酶在新鲜组分与延时处理组分中的活性
在王镜岩主编的《生物化学教程》中有这样一段陈述:酶试样或酶制品或多或少都杂有其他蛋白质,因而酶的量不能直接用质量或物质量表示,需要用它的生物活性即催化能力表示,即酶活性代表酶量。
综上,两段说法的主要矛盾在于对酶活性概念的解读。高中教学中讨论的通常是单位酶在不同设定条件(如温度、pH等)下的构象变化导致对反应催化能力不同。而大学生物化学教材中讨论的是同一(适宜)条件下因酶制品中酶量的不同导致对反应的催化能力不同。所以细胞生物学前文提到的活性升高,比较的是冻存等处理前后膜外酶量变化;后文提到的活性降低,比较的是泄露的溶酶体酶与膜内酶的构象差异。
2 酶的最适温度与最适pH是否变化
在教辅资料及教师的课件中经常可见到图1。
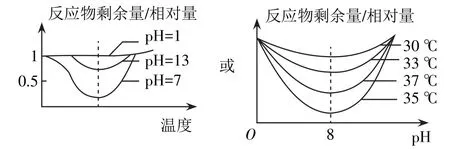
图1 温度和pH对反应物剩余量/相对量的关系
对图1的解释通常是,反应溶液的pH(或温度)不影响酶作用的最适温度(或pH)。部分教师会进一步追问:酶作用的最适pH和最适温度是不受外界因素影响的。这种说法成立吗?
以蛋白质类酶为例,首先要明确其催化机制。酶分子上存在多种可解离的催化基团,如Ser羟基、Cys巯基和His咪唑基等。这些基团要么是具有未共享电子对的,可以提供电子;要么是缺电子的,可以接受电子。缺电子的原子或基团倾向于从底物的多电子基团接纳电子,该过程即为亲电催化;具有未共享电子对的基团倾向于向底物的缺电子的核提供电子,该过程即为亲核催化。当酶分子通过上述方式和底物结合后,可使反应物具有更大反应性,即反应所需活化能更低,更容易发生反应。
因此,酶分子催化基团或底物的解离状态可以影响到酶促反应速率。而酶活性通常由酶促反应速率衡量。pH变化意味着水溶液中缺电子的H浓度变化,很显然,除极端pH条件造成酶空间结构破坏致使活性完全丧失外,pH可以通过影响酶分子或者底物的解离状态影响酶活性;而温度可通过给分子赋能的方式影响其活跃程度,同样可以导致分子相关基团的解离状态变化。
综上,pH和温度可通过相同的机制影响酶促反应,因此反应溶液的pH(或温度)会影响到酶作用的最适温度(或pH)。

