miRNA-34b抑制剂通过调控TIA-1-SG通路缓解肾脏纤维化的机制探讨
华红艳 李建听 夏剑民
511400 广州市番禺区何贤纪念医院肾病科,广东广州
肾脏纤维化是慢性肾脏疾病发展的重要病理过程,在临床上治疗慢性肾脏疾病中控制肾脏纤维化难度较大[1]。因此,抗肾脏纤维化药物成为研究的热点。在诸多研究中发现miRNA-34b 与多种肾脏疾病的发生有关,同时细胞毒颗粒关联RNA 结合蛋白1 应激颗粒(TIA-1-SG)通路在此过程中也发挥了重要作用[2-3]。抑制miRNA-34b 表达或许能够缓解肾脏纤维化的发展,可为临床上控制肾脏纤维化患者的病情提供新的治疗方案,但是目前关于其中的机制研究较为少见。鉴于此,本研究对miRNA-34b 抑制治疗肾脏纤维化的新机制进行分析。
资料与方法
实验动物、细胞:雄性CD1 小鼠共20 只,均为8 周龄,平均体重为(19.57±1.88)g。人肾小管上皮细胞(HK2)、巨噬细胞(RAW)均购于美国模式菌种收集中心。
方法:(1)实验方法。①动物实验:给予CD1 小鼠250 mg/kg 叶酸诱导肾间质纤维化,给予其miRNA-34b 抑制剂(以下简称“抑制剂”)皮下注射,持续4周,注射2次/周。②体外细胞实验:对HK2分别进行miRNA-34b 的过表达处理与沉默处理,均使用RAW 上清液进行培养,共24 h。(2)细胞培养。HK2 复苏后接种于F12 培养液中,其中含有10%胎牛血清、100 U/mL 青霉素及100 μg/mL 链霉素,在浓度为5%的CO2培养箱中培养,温度恒定37℃;在细胞生长至80%融合时,传代比例为1∶4,随后将细胞接种至培养皿中,接种密度为1.0×105个/mL,在细胞贴壁后进行相应处理24 h。RAW 复苏后接种于DMEM 培养液中,相关物质含量、培养条件、传代比例以及接种密度均同上,培养48 h 收集上清液后进行过滤处理。(3)HK2miRNA-34b 的过表达处理。在进行瞬时转染前,进行正常的细胞培养,在细胞生长至融合适度时,提前1 h 更换新鲜培养。①将7.5 μL 的Lipo3000 与250 μL 的无血清培养基进行混合稀释;②将上一步骤的稀释液1∶1与正常对照稀释液进行混合稀释。③在室温条件下进行孵育,共10 min。④在培养皿中加入250 μL的转染液,并在常规CO2培养箱中培养,共48 h。(4)mRNA 检测。将培养基弃除,使用磷酸盐缓冲溶液(PBS)进行1 次洗涤;将PBS 弃除,加入1 000 μL 的Trizol,并进行多次冲洗;将Trizol 置入加有1.5 mL 的无核酸酶纯水离心管,然后在该离心管中加入300 μL 的氯仿,将其均匀混合。(5)蛋白检测。将培养基弃除,使用PBS 进行3 次洗涤;将PBS 弃除,将培养皿冻存于-80℃环境下。加入100 μL 的裂解液以及蛋白抑制剂混合液,将培养皿上的细胞刮除到离心管,运用超声裂解仪进行裂解,频率设置为3 Hz,共进行3 次,10 s/次。采用ECL 化学发光显示试剂,Western 印迹成像获得图像。
观察指标:①动物实验:对比小鼠在注射miRNA-34b 抑制剂前后的纤维化指标,包括转化因子生长β1蛋白(TGFβ1)、纤维连接蛋白与Ⅳ型胶原蛋白。②体外细胞实验:对比HK2 miRNA-34b 过表达处理与沉默处理的纤维化相关指标、肾小管损伤指标、miRNA-34b 与TIA-1-SG。纤维化指标包括TGFβ1、纤维连接蛋白与Ⅳ型胶原蛋白,肾小管损伤指标包括溶酶体酶(尿NAG)、尿视黄醇结合蛋白。
统计学方法:数据均用SPSS 23.0 统计学软件予以处理;计量资料以表示,比较采用t检验;P<0.05为差异有统计学意义。
结 果
小鼠指标比较:与小鼠注射miRNA-34b 抑制剂前情况比较,注射后纤维化指标TGFβ1、纤维连接蛋白与Ⅳ型胶原蛋白均降低,差异具有统计学意义(P<0.05)。见表1。
表1 小鼠指标比较(±s)
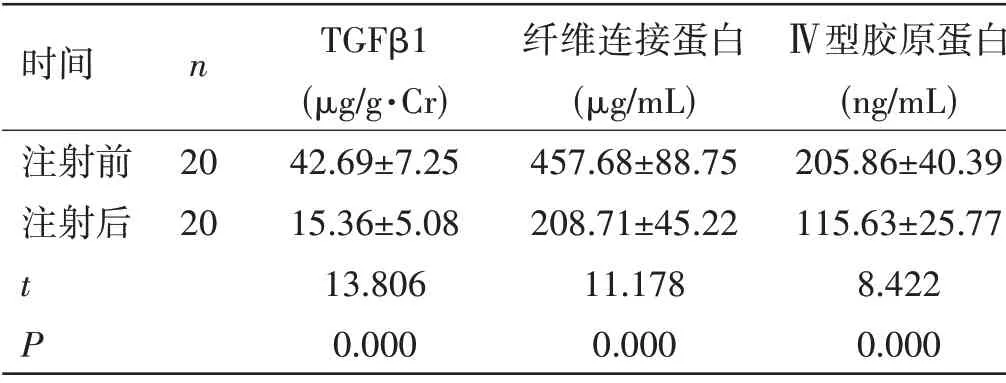
表1 小鼠指标比较(±s)
时间 n TGFβ1 纤维连接蛋白 Ⅳ型胶原蛋白(μg/g·Cr) (μg/mL) (ng/mL)注射前 20 42.69±7.25 457.68±88.75 205.86±40.39注射后 20 15.36±5.08 208.71±45.22 115.63±25.77 t 13.806 11.178 8.422 P 0.000 0.000 0.000
体外细胞指标比较:过表达处理后HK2 肾小管损伤指标、纤维化相关指标与miRNA-34b 表达率高于沉默处理后HK2,过表达处理后的HK2 细胞的TIA-1-SG 表达率低于沉默处理后HK2,差异具有统计学意义(P<0.05)。见表2。
表2 体外细胞指标比较(±s)
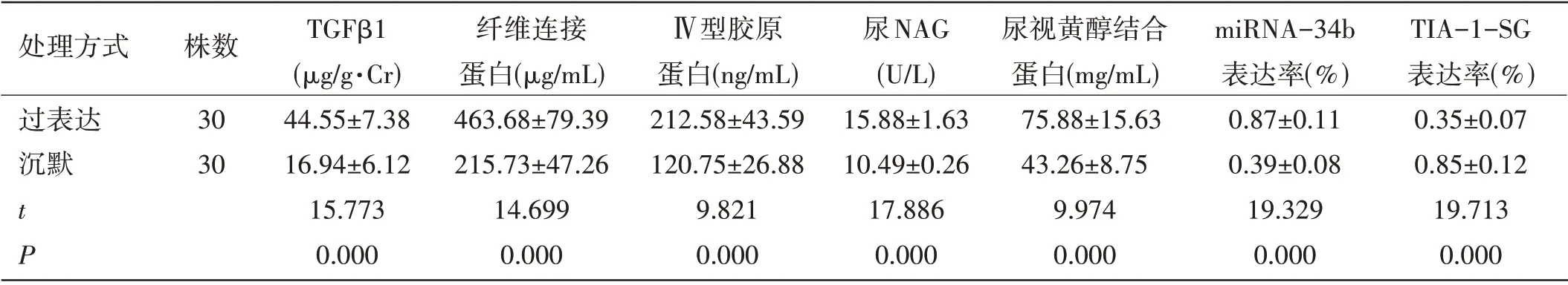
表2 体外细胞指标比较(±s)
处理方式 株数 TGFβ1 纤维连接 Ⅳ型胶原 尿NAG 尿视黄醇结合 miRNA-34b TIA-1-SG(μg/g·Cr) 蛋白(μg/mL) 蛋白(ng/mL) (U/L) 蛋白(mg/mL) 表达率(%) 表达率(%)过表达 30 44.55±7.38 463.68±79.39 212.58±43.59 15.88±1.63 75.88±15.63 0.87±0.11 0.35±0.07沉默 30 16.94±6.12 215.73±47.26 120.75±26.88 10.49±0.26 43.26±8.75 0.39±0.08 0.85±0.12 t 15.773 14.699 9.821 17.886 9.974 19.329 19.713 P 0.000 0.000 0.000 0.000 0.000 0.000 0.000
讨 论
调节细胞质的微小RNA 功能是对细胞基因表达的关键,细胞质微小RNA 功能受阻,将会影响细胞功能。应激颗粒(SG)由RNA和蛋白质聚集形成,控制RNA 的代谢、信号传导与应激下的细胞存活。miRNA-34b是微小RNA中的一种,与众多微小RNA一样,能够对具有生物学功能的蛋白翻译产生干预作用,不仅参与细胞调控中的增殖、凋亡及分化等生理过程,还可以调控病毒在宿主细胞内的复制[4]。TIA-1-SG 作为靶蛋白,其表达水平直接受到miRNA-34b 的影响,miRNA-34b 将其下调后促进纤维化蛋白的合成,进而促进肾脏纤维化。在既往的研究中发现miRNA-34b 与肾小管损伤指标、纤维化相关指标呈正相关关系,与TIA-1-SG 的表达呈负相关关系[5-6]。为了研究miRNA-34b 抑制剂治疗肾脏纤维化的新机制,将这些指标作为此次研究的观察重点。
在本次的研究结果中,与小鼠注射miRNA-34b抑制剂前情况比较,注射后的纤维化指标TGFβ1、纤维连接蛋白及Ⅳ型胶原蛋白均降低。该项结果证实了miRNA-34b 抑制剂在抑制肾脏纤维化方面具有显著作用。而在进一步的体外细胞实验中发现,过表达处理后HK2 的肾小管损伤指标、纤维化相关指标与miRNA-34b 表达率高于沉默处理后的HK2,过表达处理后HK2 细胞的TIA-1-SG 表达率低于沉默处理后的HK2。说明miRNA-34b 表达情况的变化会影响肾脏是否发生纤维化,当miRNA-34b 呈过表达状态时会引起肾脏纤维化的发生。肾脏纤维化通常为肾小管间质纤维化,主要特征为出现肾间质细胞与胶原成分聚集增加、肾小管变形及周围毛细血管减少等。由于肾脏纤维化可造成肾小管损伤,故而肾小管损伤指标的变化可间接反映肾脏纤维化的发生或者缓解。尿NAG、尿视黄醇结合蛋白是反映人体肾小管损伤的有效指标[7-8],由于miRNA-34b过表达引起肾脏纤维化发生,进而对肾小管造成损伤,因此,经过miRNA-34b 过表达处理的HK2 在肾小管损伤相关指标尿NAG、尿视黄醇结合蛋白水平出现显著升高的变化。另外,miRNA-34b 表达率与TIA-1-SG 表达率呈相反的变化,表明两者之间存在关联。HK2 在应用miRNA-34b 抑制剂处理后,过表达处理后HK2的miRNA-34b 表达率降低,TIA-1-SG 表达率升高。其原因是miRNA-34b 参与了肾脏疾病的发生,而TIA-1-SG 作为一种SG,为保护肾脏细胞适应miRNA-34b 引起的细胞功能损伤而形成,因此在miRNA-34b 促进肾纤维化发展的过程中,对TIA-1-SG 产生抑制作用,使其表达水平下调。miRNA-34b 抑制剂通过抑制miRNA-34b 的表达,进而抑制其对靶蛋白TIA-1-SG 的下调作用,使TIA-1-SG 表达率升高,纤维化蛋白的合成随之受到抑制,最终实现了对肾脏纤维化的抑制,以控制肾脏疾病的病情发展。JAK-STAT 通路是肾纤维化的关键,TGFβ1 是促进JAK-STAT 通路的重要因子,本次研究结果也可表明,注射miRNA-34b 抑制剂后的小鼠TGFβ1 水平明显降低[9]。进一步证实了miRNA-34b抑制剂对肾纤维化的抑制作用。
综上所述,TIA-1-SG 对缓解肾脏纤维化具有重要作用,miRNA-34b 抑制剂能够抑制miRNA-34b 表达,进而对其下调TIA-1-SG 的过程产生抑制作用,促进TIA-1-SG 表达,进而降低肾损伤指标、炎性指标及纤维化指标。

