基于16S rDNA基因测序探讨咳嗽变异性哮喘与肠道菌群的关系
沈灵,曾琳琳,骆巧媚,范依霖,贺倩,段小云
(1.西南交通大学生命科学与工程学院,四川成都 610031;2.四川省骨科医院,四川成都 610041)
咳嗽变异性哮喘(cough variant asthma,CVA)是一种以气道炎症、气道高反应性、气道重塑为主要特征的呼吸系统疾病[1]。其临床主要症状为慢性咳嗽,而无明显气促,喘息等症状,发病前期易被忽略,最终部分患者发展为典型哮喘,严重影响生活质量[2]。根据CVA 的发病特点,将其归于中医“风咳”,“顽咳”等范畴,病位主肺[3]。中医理论记载有“肺与大肠相表里”,认为肺和大肠在气机、经络、微生态三个层面相互作用,相辅相成,渐发展为现代医学的“肺-肠轴”。研究显示,肠道菌群紊乱与哮喘、气道炎症、慢性阻塞性肺炎、肺功能损伤等肺部疾病密切相关[4-5]。故本研究基于“肺与大肠相表里”中医理论,探讨肠道菌群与CVA 的相关性,以期从肠道微生物角度深入了解CVA 发病机制,为CVA 临床治疗提供实验依据,进一步表征中医内涵。
1 材料与方法
1.1 实验动物
SPF 级BALB∕c 小鼠20 只,体质量18~22 g,6~8周龄,雌性。由成都达硕实验动物有限公司供应,动物许可证号:SCXK(川)2020-030。饲养于温度(20~25)℃,相对湿度30%~70%,光照时间12 h 的西南交通大学实验动物中心,饮食饮水自由。所有程序均按照卫生部颁布的《医学实验动物管理实施细则》(1988 年)进行。所有动物实验均经西南交通大学动物实验伦理委员会批准。
1.2 实验仪器与试剂
十二水硫酸铝钾(明矾,批号:2018010101,成都市科隆化学品有限公司),卵清蛋白(OVA,货号:A5503,Sigma公司),DNA Microprep Kit(批号:D4301,ZYMO RESEARCH 公司),Hiseq Rapid SBS Kit v2(批号:FC-402-4023,Illumina 公司),高通量测序仪(型号:HiSeq 2500 型,Illumina 公司),PCR扩增仪(型号:9700型,Applied Biosystems公司),超声雾化器(型号:402AI,江苏鱼跃医疗设备股份有限公司)。
1.3 CVA小鼠模型的复制
20只BALB∕c雌性小鼠按随机原则分为对照组和模型组,每组10 只,适应性喂养1 周后,开始造模。对照组0、7、14 d 腹腔注射0.2 mL 明矾溶液(1 mg 明矾溶于PBS),模型组给予等量OVA 混悬液(50µg OVA+1 mg 明矾溶于PBS);21 d 起将小鼠放入密闭透明雾化箱,对照组每天用生理盐水,模型组用1%OVA,雾化30 min,持续3 周。在此期间观察小鼠一般体征并定时记录体质量。
1.4 咳嗽反应测试
造模最后1 天,将对照组和模型组小鼠依次放入透明密封箱内,雾化吸入氨水1 min,关闭雾化器后,让小鼠于密封箱内停留1 min 后开始记录小鼠在4 min内的咳嗽次数及咳嗽潜伏期。
1.5 小鼠粪便收集
末次造模24 h 后,收集小鼠粪便3~4 颗于灭菌冻存管内,后转置于液氮中保存,全部收集完成后迅速转移至-80 ℃存储。
1.6 16S rDNA高通量测序分析
采用琼脂糖电泳法提取总DNA,用PicoGreen染料法进行样本DNA 浓度检测,使用特异引物515F 和806R 对样本的16S 核糖体DNA(16S ribosomal DNA,16S rDNA)V4 区域进行聚合酶链反应(PCR)扩增,2%琼脂糖凝胶进行目的片段电泳检测,将合格的目的片段回收后纯化、定量,使用NEBNext Ultra ⅡDNA Library Prep Kit for Illumina建库,在HiSeq 2500 平台上进行高通量测序。基于Usearch 软件,在97%的一致性水平上对代表性序列进行分类操作单元(OUT)聚类,进行Alpha 多样性、Beta多样性、菌群组成及菌群差异分析。
1.7 小鼠肺组织病理染色
收集完粪便后,立即处死小鼠,取出其肺组织固定于40 g∕L 多聚甲醛中、脱水、包埋、切片、HE 染色、显微镜观察肺组织病理情况。
1.8 相关性分析与统计学处理
使用Spearman 系数分析CVA 小鼠的咳嗽次数、咳嗽潜伏期、体质量与肠道菌群的相关性。应用SPSS 23.0 软件进行分析,均数±标准差()或中位数M(P25~P75)表示实验结果。如果各组数据之间都呈正态分布且方差齐性用t检验,如果不满足方差齐性,采用校正t检验或秩和检验。检验水准α=0.05。P<0.05表示差异具有统计学意义。
2 结果
2.1 CVA小鼠一般体征及体质量变化
造模前,对照组与模型组小鼠精神状态佳,毛发光亮顺滑,饮食及排便正常,活动度高,反应敏捷,体质量无明显差异;在OVA 致敏阶段,两组小鼠表现正常,体质量无明显差异;在OVA 雾化激发阶段,CVA 模型小鼠出现腹式呼吸,搔抓面部,咳嗽,烦躁不安,排便次数明显增加、毛发枯黄,掉毛,活动减少,喜扎堆等现象,整体状态较对照组差,体质量增长减慢,随着造模时间延长体质量明显下降(P<0.01;表1)。
表1 造模期间各组小鼠体质量变化Table 1 Changes of body weight during modeling in each group(,n=10)
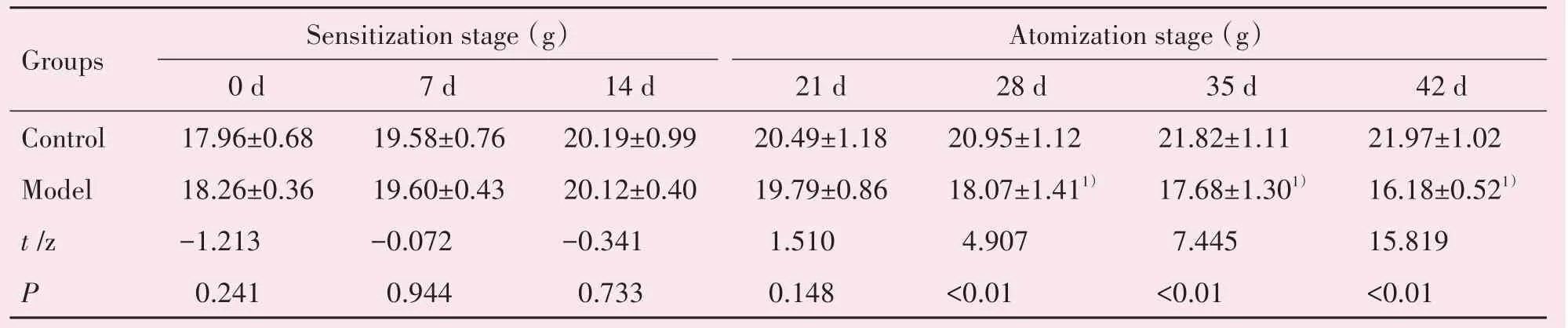
表1 造模期间各组小鼠体质量变化Table 1 Changes of body weight during modeling in each group(,n=10)
P values were compared by T test or Mann-Whitney U test(14 d)as appropriate.1)compared with control,P <0.01.
2.2 CVA小鼠咳嗽反应测试
与对照组相比,CVA 模型组小鼠4 min 内咳嗽次数显著增加,咳嗽潜伏期显著缩短,差异均有统计学意义(P<0.01;表2)。
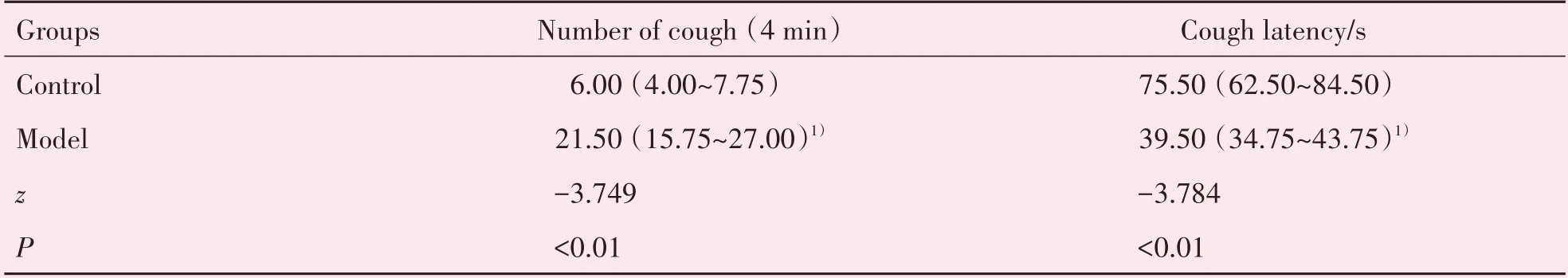
表2 各组小鼠咳嗽次数及咳嗽潜伏期Table 2 Number of cough and cough latency of mice in each group [M(P25~P75),n=10]
2.3 CVA小鼠肺组织病理检查
小鼠肺组织HE 染色结果如图1 所示。对照组:支气管结构完整,上皮细胞形态正常,无脱落、坏死,未见明显炎性细胞浸润;模型组:肺组织结构紊乱,以中性粒细胞和淋巴细胞为主的炎性浸润明显,气道平滑肌增厚,肺泡壁破坏,偶见上皮细胞坏死。
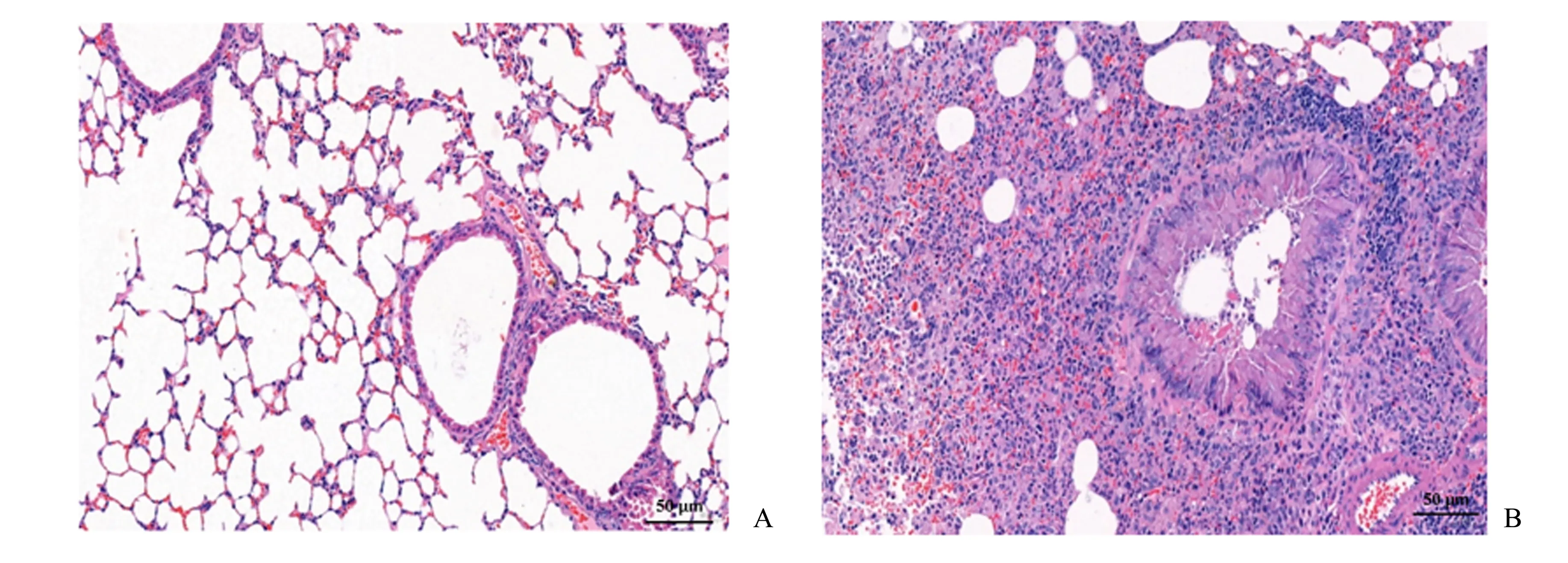
图1 小鼠肺组织病理检查Fig.1 Pathological examination of lung tissue in mice
2.4 CVA小鼠肠道菌群的变化
2.4.1 OUT分析 末次造模24 h后,每组随机选取6 只小鼠进行16S rDNA 测序分析。12 个样本通过高通量测序共得254 856 条Raw tags,过滤低质量、短长度、嵌合体后,得到242 833 条有效序列。在97%的相似性水平下对有效序列进行OTU(Operational Taxonomic Units)聚类,结果显示,模型组和对照组共有OTU 数目为1 371 个,特有OTU 是1 909 个和1 870 个,CVA 模型小鼠菌群OUT 相较于对照组发生显著变化(图2)。

图2 基于OUT分布的Veen图Fig.2 Veen graph based on OUT distribution(n=6)
2.4.2 Alpha 多样性分析 Alpha 多样性指数是反映样本微生物群落复杂程度的重要依据,包括群落的丰富度及多样性。群落丰富度可以用Chao 1 指数表示,其值越高,表明OTU 数目越多,群落物种总数越多;群落多样性可以用Simpson指数表示,其值越大,群落多样性越大。与对照组相比,模型组小鼠的Chao1 指数增高,差异不具有统计学意义;Simpson指数显著升高(P<0.01),表明CVA模型小鼠肠道菌群丰富度有增加趋势且物种多样性高于对照组(表3)。
表3 Alpha多样性分析结果Table 3 Alpha diversity analysis results(,n=6)
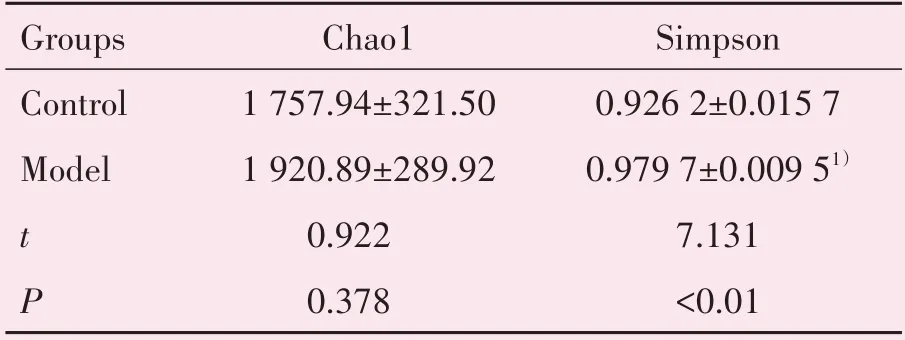
表3 Alpha多样性分析结果Table 3 Alpha diversity analysis results(,n=6)
P values were compared by T test as appropriate.1)compared with control,P <0.01.
2.4.3 Beta 多样性分析 Beta 多样性分析能反映多个样本间是否有显著微生物群落差异,为了将样本间的差异整体反映在二维坐标上,选用最常用的Weighted Unifrac 距离计算方式进行非度量多维尺度分析(Non-metric Multi-Dimensional Scaling,NMDS)。如图3 所示,结果的应力值(Stress)小于0.2,表明NMDS 分析结果可靠。图中不同的点代表不同样本,点之间距离越大,样本组成差异越大。模型组与对照组组内样本距离接近,菌群组成无显著差异,组间样本点完全分开,表明CVA 模型小鼠相较于对照组小鼠肠道菌群组成发生明显变化。

图3 NMDS分析结果Fig.3 NMDS analysis results
2.4.4 物种组成分析 为了进一步研究CVA 小鼠中肠道菌群组成的变化,对门和属水平微生物相对丰度分析。门水平上,各组小鼠肠道菌群分属26个菌门,对相对丰度前十的主要菌门分析发现,模型组和对照组小鼠中的优势菌门为Firmicutes、Bacteroidetes、Euryarchaeota、Proteobacteria、Spirochaetes和Actinobacteria,总占比分别为98.96%和99.07%。与对照组相比,模型组Firmicutes相对丰度下降,Bacteroidetes、Euryarchaeota、Proteobacteria相对丰度增加。其余优势菌和非优势菌在模型组和对照组间组成差异结果(图4)。
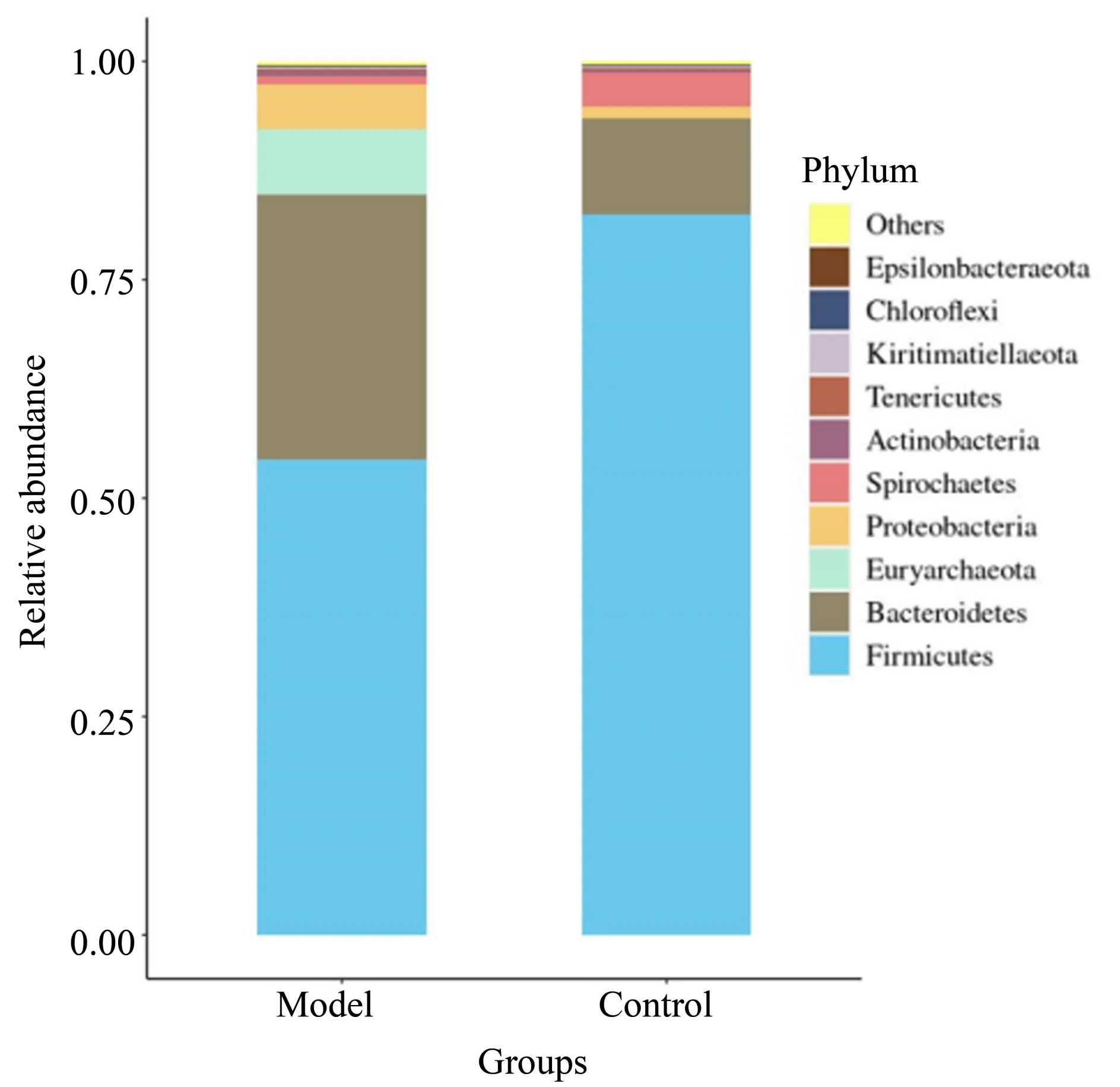
图4 门水平物种丰度累积柱状图Fig.4 Barplot of relative abundance at the phylum level
在属水平上共检测到376 个菌属,对相对丰度前十的菌属进行分析。其中Lactobacillus、Lachnospiraceae NK4A136 group、Ruminococcaceae UCG-014为模型组和对照组共有优势菌属。与对照组相比,CVA 模型小鼠Lactobacillus、Ruminococcaceae UCG-014、Treponema 2相对丰度下降;Lachnospiraceae NK4A136 group、Methanobrevibacter的相对丰度增加。剩余五种菌属的相对丰度在模型组样本中增加(图5)。

图5 属水平物种丰度累积柱状图Fig.5 Barplot of relative abundance at the genus level
2.4.5 差异物种分析 为确定模型组与对照组间重要差异菌群,利用线性判别分析(Linear discriminant analysis Effect Size,LEfSe)进行比较。由图6可知,对照组在Bacteria、Firmicutes、Bacilli、Lactobacillus、Lactobacillaceae、Lactobacillales丰度较高,模型组在Archaea、Bacteroidetes、Euryarchaeota、Clostridia、Bacteroidia、Methanobacteria、Bacteroidales、Clostridiales、Methanobacteriales、Ruminococcaceae、Methanobacteriaceae、Prevotellaceae、Rikenellaceae、Methanobrevibacter、Prevotellaceae UCG-003丰度较高。

图6 差异物种分析Fig.6 Difference of species analysis
2.5 相关性分析
为进一步研究CVA 与肠道菌群的关系,利用Spearman 系数对CVA 特征(咳嗽次数、咳嗽潜伏期、体质量)与肠道菌群进行相关性分析。如表4所示,Methanobrevibacter、Ruminiclostridium 9、Bacte-roides、Escherichia-Shigella、RikenellaceaeRC9gut group、Catenibacterium、PrevotellaceaeUCG-003与CVA小鼠咳嗽次数呈负相关,与咳嗽潜伏期及体质量(42 d)呈正相关(P<0.01 或P<0.05)。RuminococcaceaeNK4A214 group、Alloprevotella、Ruminococcaceae UCG-013、Ruminococcus 1、coprostanoligenes group与咳嗽潜伏期呈正相关(P<0.01 或P<0.05);Lactobacillus和Treponema 2与咳嗽潜伏期呈负相关(P<0.01 或P<0.05)。Prevotellaceae NK3B31 group与小鼠体质量呈正相关(P<0.01);Lactobacillus与体质量呈负相关(P<0.01)。Lachnospiraceae NK4A136 group与咳嗽次数呈负相关(P<0.05);Lactobacillus与咳嗽次数呈正相关(P<0.01)。上述结果表明小鼠肠道菌群的组成与CVA特征显著相关。
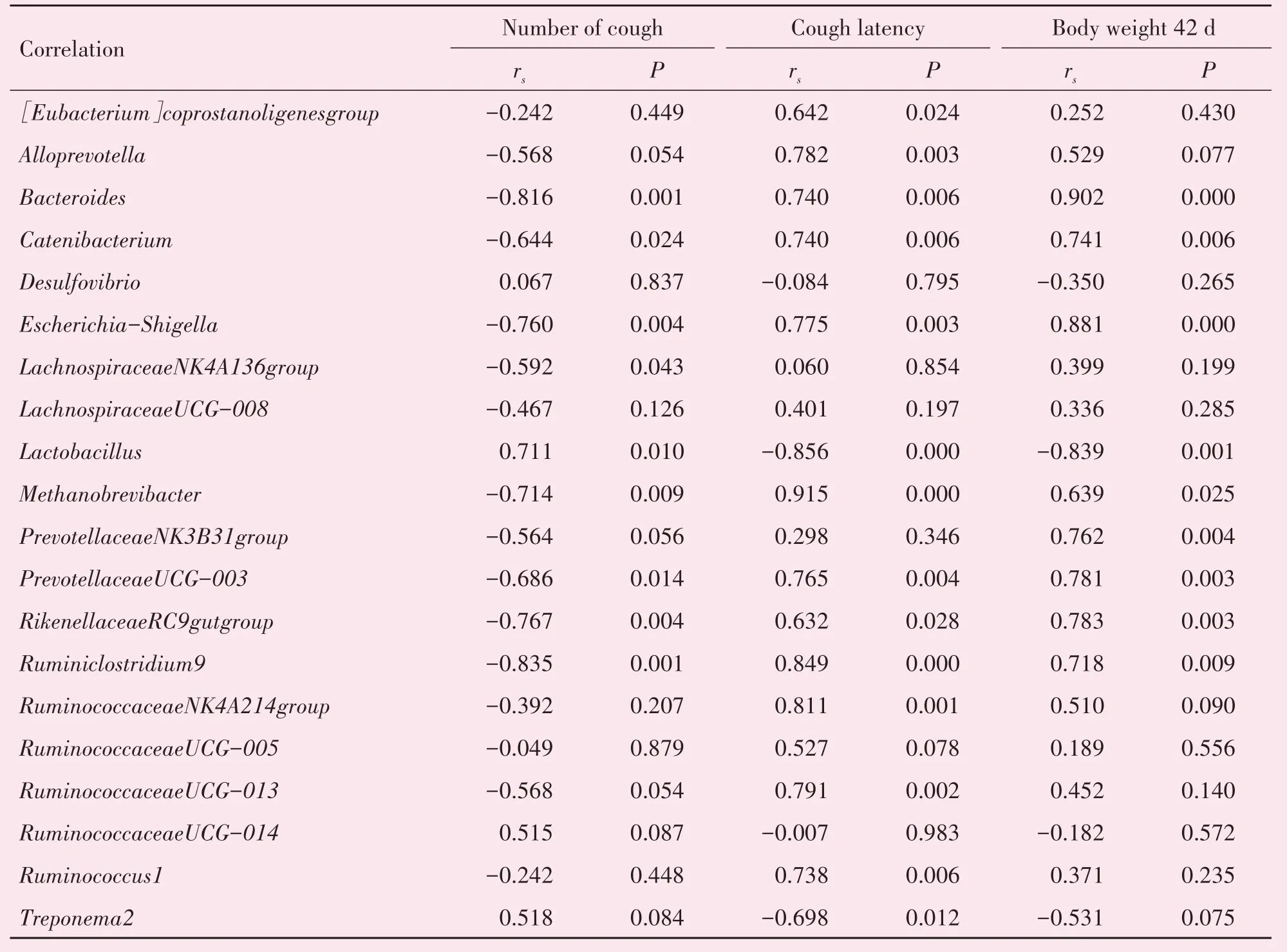
表4 CVA特征与小鼠肠道菌群Spearman相关性分析Table 4 Spearman's rank correlation analysis between CVA characteristics and intestinal microflora of mice(n=6)
3 讨论
3.1 CVA小鼠模型的验证
CVA 是一种以顽固性慢性咳嗽为临床唯一或主要症状的慢性炎症性疾病,参考文献[6],选择常用的OVA 致敏并雾化激发复制小鼠CVA 模型。该研究可见模型组小鼠在雾化激发阶段体质量减轻,排便增加,腹式呼吸,烦躁、咳嗽等典型症状;咳嗽反应提示模型组小鼠咳嗽次数显著增加,咳嗽潜伏期缩短;肺组织HE 染色显示CVA 模型小鼠肺部炎性浸润明显,支气管结构紊乱,气道壁增厚等病理表现;上述症状与文献记载CVA 小鼠症状相符[7-8],提示OVA诱导的CVA小鼠模型复制成功。
3.2 结果分析及同类研究比较
临床上,呼吸道疾病往往伴随着胃肠道病变,如流感病人常常伴随有恶心、腹泻、腹痛等胃肠道相关疾病症状,此种现象在幼年患者身上尤为突出[9]。
“肺与大肠相表里”始载于《黄帝内经》,认为肺和大肠通过经络、气机构成表里关系,在生理和病理上相互调节。随着对微生物的深入研究,发现定植于两个器官中的呼吸道菌群和肠道菌群双向相关、互相影响,成为连接肺和大肠的枢纽[10]。既往研究证实支气管哮喘、慢性阻塞性肺炎等肺部疾病往往伴随肠道菌群紊乱,且肺与大肠胚胎早期具有同源性,即前肠经过发展变化而形成了肺和器官,并且从功能成像角度进行了证实,研究结果为从组织胚胎学方面解释肺肠相关提供了科学论据[11],也为“肺与大肠相表里”的菌群变化规律性提供了依据。吴佳佳实验研究结果表明,“从肠治肺”防治过敏性哮喘机制可能与调节肠道微生态平衡、促使肠道Treg 细胞、抑制Th17 细胞的分化,进而缓解肺部炎症有关[12]。
本实验发现,模型组小鼠肠道菌群OTU 数目、Chao1 指数和Simpson 指数高于对照组,该实验结果与王永安等[13]研究结果一致,其研究表明哮喘小鼠肠道大肠杆菌及肠球菌等致病菌增加,乳酸菌减少;崔芳等[14]实验结果同样发现哮喘模型小鼠物种丰富度高于对照组;Kho 等[15]研究表明,患病人群肠道益生菌数量和种类显著减少,而致病菌增多;NMDS 分析结果也提示相较于对照组,模型组小鼠肠道菌群组成发生了一定变化。因此,我们初步推测模型组小鼠物种丰富度和多样性高可能是因为其处于应激状态,肠道环境变化,肠道屏障能力下降,无法给益生菌提供适合的生长环境,从而使有害菌有机会大量繁殖[16-17]。
结合肠道菌群在门和属水平的物种组成及差异物种分析发现,在门水平上,模型组的厚壁菌门(Firmicutes)丰度显著下降,拟杆菌门(Bacteroidetes)和广古菌门(Euryarchaeota)数量明显增加。研究发现呼吸道病毒感染小鼠肠道拟杆菌门(Bacteroidetes)数量增加[18];厚壁菌门(Firmicutes)能维持机体免疫系统稳定,其丰度下降与炎症反应相关[15];Zhang 等[19]研究认为广古菌门(Euryarchaeota)可能与肺癌的发生发展相关。在属水平上,结合LEfSe 分析及Spearman 系数分析发现,乳酸杆菌属(Lactobacillus)、甲烷短杆菌属(Methanobrevibacter)和普雷沃氏菌科UCG-003 属(Prevotellaceae UCG-003)与CVA 关系最为密切。模型组乳酸杆菌属(Lactobacillus)丰度下降,甲烷短杆菌属(Methanobrevibacter)和普雷沃氏菌科UCG-003 属(Prevotellaceae UCG-003)相对丰度显著增加,其中乳杆菌属为肠道有益菌,增强肠道屏障功能,维持肠道内环境稳定[20],普雷沃氏菌属在宿主内比例上升易引起胃肠道不良反应,造成肠道环境紊乱;非小细胞肺癌患者粪便样本中富含甲烷短杆菌属[21]。上述结果表明,CVA 小鼠存在肠道菌群紊乱,肠道菌群物种丰富度和多样性增加,可能与致病菌(如甲烷短杆菌属和普雷沃氏菌科UCG-003 属)的增多和益生菌(如乳酸杆菌属)的显著减少密切相关,提示小鼠CVA 的发病可能有肠道菌群的参与。这与临床上CVA 患者肠杆菌、酵母菌的数量多于健康人,而双歧杆菌、乳杆菌数量少于健康人结果一致[22]。
鉴于此,我们在CVA 小鼠模型复制成功的基础上,进一步对CVA 小鼠的肠道菌群进行高通量测序分析。实验结果发现模型组小鼠肠道菌群OTU 数目、Alpha 多样性、Beta 多样性、不同水平上的群落组成、差异物种组成等与对照组小鼠均有较大差异,表明CVA 小鼠伴有肠道菌群紊乱现象,因此,肠道菌群的调节可能在CVA 的治疗中发挥不可替代的作用。
3.3 研究意义与不足
本文以“肺与大肠相表里”中医理论为切入点,来探究肠道菌群与CVA 的关系,研究表明肠道菌群与CVA 的发病密切相关,为从肠道菌群治疗CVA 提供实验基础。临床上治疗哮喘常选用氨茶碱、β1 受体阻断剂、糖皮质激素类等药物,长期使用会对机体产生一定的副作用。补充乳酸杆菌、降低有害菌(肠杆菌、肠球菌)数量,调节肠道微生态平衡可为临床治疗CVA 提供一条新的思路。但基于肠道菌群组成结构复杂及功能多样的特点,有关肠道菌群对CVA 的具体作用机制仍需进一步深入研究。

