卡瑞利珠单抗联合化疗方案对中晚期食管癌患者血清miR-21、可溶性E-钙黏蛋白表达的影响
胡加海,薛松,陈荃
食管癌早期发病隐匿,无典型症状[1-2]。当患者因不适就医时,多已处于中晚期,失去了手术治疗的最佳时机[3-4]。针对中晚期食管癌,临床治疗多采用化疗方案,但单纯化疗不良反应较多,治疗效果及患者预后较差[5-6]。免疫治疗是临床恶性肿瘤治疗的主要有效手段之一。研究显示,免疫治疗与化疗联合治疗方案有助于延长患者生存期[7]。卡瑞利珠单抗是一种人源化抗程序性死亡受体1(PD-1)抗体,其通过与PD-1 的靶向结合,解除机体免疫抑制作用,从而发挥抗肿瘤效应[8-9]。目前,从分子水平研究抗肿瘤药物的机制已成为热点。miR-21 可通过PTEN/PI3K/AKT信号通路参与肿瘤细胞的增殖和迁移过程[10]。可溶性E-钙黏蛋白(sE-Cad)是调控肿瘤细胞生长的重要蛋白[11]。目前已有利用卡瑞利珠单抗联合化疗方案治疗食管癌的报道[12],但从分子水平研究联合治疗方案对中晚期食管癌治疗效果的研究较少。本研究主要分析卡瑞利珠单抗联合化疗方案对中晚期食管癌患者血清miR-21、sE-Cad表达的影响,旨在明确免疫治疗联合化疗对中晚期食管癌的近期疗效及安全性。
1 对象与方法
1.1 研究对象 回顾性选取2019 年6 月—2021 年6 月于安徽医科大学附属滁州医院(滁州市第一人民医院)就诊且均经病理检查确诊为鳞癌的中晚期食管癌患者110例。纳入标准:年龄≥18岁;首次接受治疗,体能状态(performance status,PS)评分0~1 分,预计生存时间≥6 个月;无化疗禁忌证;可测量病灶数量≥1个。排除标准:合并其他恶性肿瘤、免疫系统疾病、感染性疾病及血液系统疾病;有精神类疾病;存在重要脏器功能障碍。依据治疗方案的不同分为联合组(紫杉醇+顺铂化疗方案联合卡瑞利珠单抗治疗,57例)和化疗组(紫杉醇+顺铂化疗方案治疗,53 例),2 组患者的性别、年龄、体质量指数(BMI)、基础疾病、吸烟史(患者自本次入院治疗前10年内有规律吸烟,且吸烟数量累计≥100支)、食管癌家族史构成差异均无统计学意义(P>0.05),有可比性,见表1。本研究经本院伦理委员会批准,患者均签署知情同意书。
1.2 治疗方案 化疗组患者接受紫杉醇+顺铂化疗方案治疗。具体用法:第1天静脉滴注白蛋白结合型紫杉醇(国药准字:H20183378,江苏恒瑞医药股份有限公司;260 mg/m2,滴注时间为30 min)+顺铂(诺欣,国药准字:H20040813,江苏豪森药业集团有限公司;30 mg/m2,滴注时间为60 min以上并适当水化利尿),第2、3天静脉滴注顺铂(30 mg/m2,滴注时间为60 min以上并适当水化利尿),21 d为1个周期,连续治疗4~6个周期。联合组患者在化疗的基础上,同时给予卡瑞利珠单抗(艾瑞卡,国药准字:S20190027,江苏恒瑞医药股份有限公司)静脉滴注治疗(200 mg/次,1 次/2 周),连续治疗4~6 个周期。
1.3 观察指标
1.3.1 总体疗效 参考《实体肿瘤的疗效评价标准(RECIST)1.1版》[13]对患者的总体疗效进行评估,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),计算客观有效率(ORR)和疾病控制率(DCR),ORR=(CR+PR)/总例数×100%,DCR=(CR+PR+SD)/总例数×100%。
1.3.2 酶联免疫吸附试验(ELISA)法检测血清肿瘤标志物、sE-Cad水平 分别于治疗前后取患者空腹静脉血5 mL,3 000 r/min 离心10 min 分离上清液,-80 ℃保存待测。参照ELISA 检测试剂盒说明书,检测糖类抗原125(CA125)、癌胚抗原(CEA)、鳞状细胞癌相关性抗原(SCC)和血清sE-Cad的表达水平。相关试剂盒均购自奥地利GMBII公司。
1.3.3 实时荧光定量聚合酶链反应(qPCR)法检测血清miR-21 水平 取患者血清样本,应用miRNeasy Mini Kit 试剂盒(德国QIAGEN公司)提取血清总RNA,采用紫外分光光度计(DU800型,美国贝克曼库尔特有限公司)测定RNA浓度及纯度,以稀释RNA 的无酶水为空白对照。总RNA 经凝胶电泳分离、纯化,采用反转录试剂盒(德国QIAGEN 公司)将总RNA 反转录为cDNA,获得cDNA 后于-20 ℃保存备用。以cDNA 为模板采用miRcute miRNA 荧光定量检测试剂盒(天根生化科技有限公司)进行qPCR 扩增,总反应体系20 μL:2×miRcute miRNA Premix 10 μL、10 μmol/L 的上下游引物各0.4 μL、2 μL miRNA 第1 链cDNA、1.6 μL ROX 参比染料(×50)、5.6 μL ddH2O。miR-21引物序列:上 游5′-CCTTCACTTTCAGGGTCGAG-3′,下 游 3′-CAGTTTGGGACCCCTTTACA-5′;内参选用β-actin 基因,引物上游5′-CCCATCTATGAGGGTTACGC-3′,下 游 3′-TTTAATGTCACGCACGATTTC-5′。反应条件:94 ℃预变性10 min;95 ℃15 s,60 ℃1 min,45 个循环。miR-21 相对表达量采用2-ΔΔCt法计算,每个样本检测3次,取平均值为最终结果。
1.3.4 不良反应 记录2 组患者治疗期间的不良反应发生情况,参考《美国国立癌症研究所通用毒性标准(NCI-CTC)5.0》[14]对不良反应进行分级。
1.4 统计学方法 采用SPSS 20.0软件进行数据分析。符合正态分布的计量资料以±s表示,2 组间比较行独立样本t检验,同组治疗前后比较行配对t检验。计数资料以例或例(%)表示,组间比较用χ2检验;等级资料行秩和检验。P<0.05为差异有统计学意义。

Tab.1 Comparison of baseline data between the 2 groups表1 2组患者基线资料比较
2 结果
2.1 2 组患者一般资料比较 2 组肿瘤TNM 分期、病变部位和肿瘤体积比较差异无统计学意义(P>0.05),见表2。
2.2 2 组患者总体疗效比较 联合组患者的ORR、DCR均高于化疗组(P<0.05),见表3。
2.3 2 组患者治疗前后血清肿瘤标志物水平比较 治疗前,2组血清CA125、CEA、SCC水平差异均无统计学意义(P>0.05);治疗后,2 组血清CA125、CEA 和SCC 水平较治疗前均下降,且联合组的血清CA125、CEA 和SCC 水平低于化疗组(P<0.01),见表4。
2.4 2组患者治疗前后血清miR-21、sE-Cad水平比较 治疗前,2 组患者血清miR-21、sE-Cad 水平差异无统计学意义(P>0.05);治疗后,2 组血清miR-21、sE-Cad 水平较治疗前均下降,且联合组的血清miR-21、sE-Cad水平低于化疗组(P<0.05),见表5。2.5 2组患者治疗期间不良反应发生情况比较 治疗期间2 组患者均出现白细胞减少、中性粒细胞减少、血小板减少、肝功能受损、疲劳、胃肠道反应和肌肉关节痛等不良反应,联合组的反应性毛细血管增生症发生率高于化疗组(P<0.01),但主要为Ⅰ~Ⅱ级,所有不良反应经减少药物剂量、对症支持治疗后均得到控制,见表6。
3 讨论
食管癌一直是威胁我国居民健康的主要恶性肿瘤之一,患者5年生存率不到10%,中位生存期仅为7~12个月[15]。对于早期食管癌,临床可通过手术切除、内镜治疗等方式取得良好疗效,但中晚期食管癌患者多已失去最佳手术时机,且单纯化疗的总体获益率及生存率较低,临床更推荐联合化疗方案。卡瑞利珠单抗是一种人源化免疫球蛋白G4 型单克隆抗体,其作为新兴的免疫治疗方案,可阻断PD-1 信号通路,改善肿瘤免疫微环境,通过增强内源性抗肿瘤免疫效应而发挥作用。已有研究表明,食管动脉化疗栓塞联合卡瑞利珠单抗治疗中晚期食管癌短期疗效明确[16],但对于无法接受食管动脉化疗栓塞或不能耐受放化疗的患者,卡瑞利珠单抗联合化疗方案是否能使患者进一步获益尚无定论。

Tab.2 Comparison of general data between the 2 groups表2 2组患者一般资料比较 [例(%)]

Tab.3 Comparison of overall curative effect between the 2 groups表3 2组患者总体疗效比较 [例(%)]
Tab.4 Comparison of serum tumor marker levels before and after treatment between the 2 groups表4 2组患者治疗前后血清肿瘤标志物水平比较 (±s)

Tab.4 Comparison of serum tumor marker levels before and after treatment between the 2 groups表4 2组患者治疗前后血清肿瘤标志物水平比较 (±s)
**P<0.01。
Tab.5 Comparison of serum miR-21 and sE-Cad levels before and after treatment between the 2 groups表5 2组患者治疗前后血清miR-21、sE-Cad水平比较 (±s)

Tab.5 Comparison of serum miR-21 and sE-Cad levels before and after treatment between the 2 groups表5 2组患者治疗前后血清miR-21、sE-Cad水平比较 (±s)
**P<0.01。
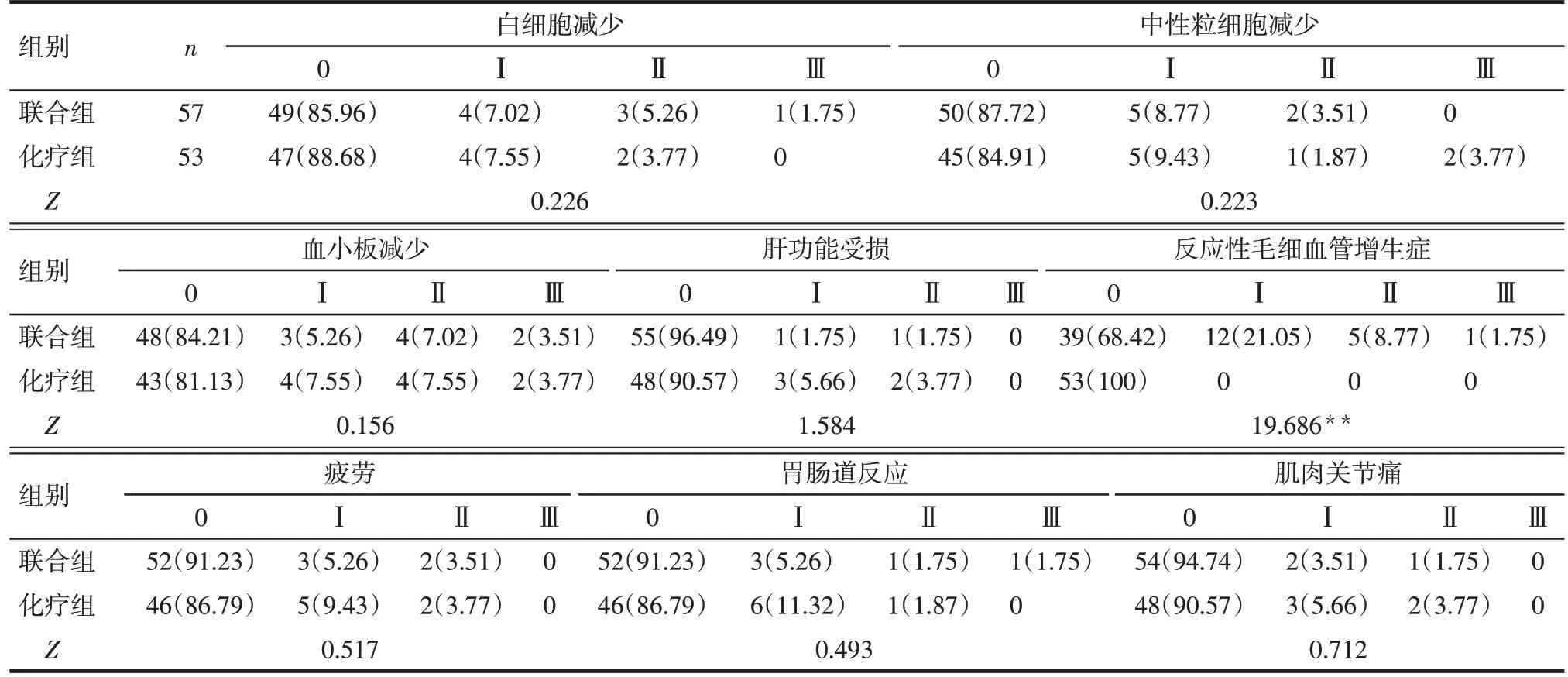
Tab.6 Comparison of adverse reactions during treatment between the 2 groups表6 2组患者治疗期间不良反应发生情况比较 [例(%)]
既往研究显示,卡瑞利珠单抗可靶向结合B 淋巴细胞、T淋巴细胞、自然杀伤细胞等细胞表面表达的PD-1,阻断其与恶性肿瘤细胞、肿瘤浸润性淋巴细胞等表面表达的PD-L1 之间的相互作用,在解除T细胞免疫抑制作用的同时,进一步诱导T淋巴细胞活化,增强机体免疫系统的抗肿瘤能力[17]。此外,应用免疫检查点抑制剂后,肿瘤细胞受到T细胞攻击,对化疗药物的敏感性增强,可与化疗发挥协同抗肿瘤作用,且更加持久有效[18]。药物动力学研究还发现,卡瑞利珠单抗能够发挥持久的抗肿瘤效果,在第1 个周期注射给药后其PD-1 受体平均占有率为81%~88%[19]。尽管免疫治疗延长了患者的生存期,但其相关不良反应也会降低患者的生活质量。本研究显示,联合组晚期食管癌的ORR、DCR 均高于单纯化疗组,且治疗后联合组的血清肿瘤标志物水平低于化疗组;2组患者均出现一定不良反应,联合组与卡瑞利珠单抗相关的毒性反应为反应性毛细血管增生症,发生率偏高,但主要为Ⅰ~Ⅱ级;2组其他不良反应发生率无明显差异,提示卡瑞利珠单抗联合化疗患者总体疗效和耐受性良好,不良反应可控。一项有关卡瑞利珠单抗联合白蛋白紫杉醇/洛铂新辅助治疗局部晚期食管癌的Ⅱ期临床观察研究亦证实,卡瑞利珠单抗联合化疗方案作为术前新辅助治疗模式可提高患者ORR,缓解主要病理反应,且不良反应轻微,安全可控[20]。
肿瘤分子生物学研究发现,PTEN/PI3K/AKT 信号通路与肿瘤的发生、发展关系密切,而miR-21 能对该信号通路起重要调节作用,影响恶性肿瘤细胞的生物学行为,并参与肿瘤细胞的增殖和迁移过程[10]。姚丽华等[21]研究认为,miR-21在食管癌患者血清中高表达,对食管癌的诊断具有一定价值。sECad 是一种细胞黏附糖蛋白,是介导细胞内信号传导及调控组织生长发育的重要蛋白,其血清水平变化可反映肿瘤细胞侵袭和转移能力,被认为是评估肿瘤患者预后结局的重要血清标志物[11]。本研究发现,治疗后联合组的血清miR-21、sE-Cad 水平低于化疗组,提示卡瑞利珠单抗联合化疗方案治疗可下调miR-21、sE-Cad在中晚期食管癌患者血清中的表达。miR-21 可通过激活PTEN/PI3K/AKT 信号通路促进肿瘤细胞的增殖和迁移,并抑制细胞凋亡,当miR-21 在食管癌组织中被上调时,血清miR-21 水平升高;而肿瘤细胞间黏附结构的破坏会导致sECad 释放水平显著增加,使食管癌患者的血清sECad 水平显著高于正常人群[22]。另有研究结果表明,化疗药物的应用能抑制肿瘤细胞侵袭转移能力,使患者血清miR-21、sE-Cad 水平下降,而卡瑞利珠单抗的联合应用能进一步增强对肿瘤细胞侵袭转移能力的抑制,使miR-21、sE-Cad 表达下调[23]。因此,笔者推测下调miR-21、sE-Cad 表达可能是卡瑞利珠单抗提高化疗临床疗效的重要机制。
综上所述,卡瑞利珠单抗联合化疗方案治疗中晚期食管癌近期疗效良好,可有效降低肿瘤标志物水平,下调miR-21、sE-Cad在血清中的表达,且总体耐受性良好,不良反应可控。

