血小板淋巴细胞比值、中性粒淋巴细胞比值与胆源性急性胰腺炎病人预后的关系
黄 俊,曹 堃,孙 勇
胆源性急性胰腺炎(biliogenic acute pancreatitis,BAP)的发生涉及消化酶的作用、微循环的改变、胰管屏障的破坏等病理生理学过程,临床结局差异较大,多数病人可能仅有腹胀、腹痛等不适,但部分症状严重者往往会发展至多器官衰竭甚至死亡[1]。因此,临床上寻找能够预测BAP预后的标志物,从而早期对预后较差的病人实施必要的干预,显得十分重要。血小板淋巴细胞比值(platelet to lymphocyte ratio,PLR)和中性粒淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)是临床上通过血常规即可获取的免疫炎症标志物,现有的研究[2-5]证据表明,二者与胃癌、肝癌、膀胱癌等肿瘤预后密切相关。然而二者与BAP相关研究较少,本研究探讨PLR、NLR与BAP病人预后之间的关系,以期为临床中BAP的诊治提供帮助。
1 资料与方法
1.1 研究对象 选取2015年1月至2020年1月在我院首诊的338例BAP病人。其中急性胰腺炎诊断至少满足以下3条中的2条:(1)急性胰腺炎的特征性腹痛特征;(2)血清淀粉酶和/或脂肪酶大于正常值3倍以上;(3)符合急性胰腺炎的影像学特征性表现。乙醇、高脂血症、自身免疫等其他原因引起胰腺炎除外;复发性胰腺炎、慢性胰腺炎、合并创伤、肿瘤或肝功能衰竭除外;近期抗生素治疗、输血等影响血常规检查结果病例除外。其中男142例,女196例;年龄22~90岁;>60岁140例,≤60岁198例。所有研究通过电话、书信、邮件等方式随访100 d或至死亡日期。随访期间,存活317例,死亡21例。研究所有回顾性资料均获取于我院病案系统。所有研究对象发病24 h内接受血常规、生化、血清淀粉酶等常规检查并且档案资料保存完整。
1.2 研究方法 根据病人入院后的血常规结果计算PLR和NLR,同时分析年龄、性别、血清淀粉酶等临床病理参数与二者的关系。体质量指数(BMI)定义为体质量千克数(kg)除以身高米数平方(m2)。WHO将BMI≤18.5 kg/m2认定为体质量过轻,本研究统计过程中将BMI按>18.5 kg/m2和≤18.5 kg/m2转化为二分类变量。血细胞计数资料均来自于病人发病24 h内我院血常规检查。PLR=血小板计数/淋巴细胞计数,NLR=中性粒细胞计数/淋巴细胞计数。以病人随访生存状态为结局指标绘制PLR和NLR的受试者工作特征(receiver operating curve,ROC)曲线,选取约登指数最大时的值为截断值。根据截断值将病人分为高PLR/NLR组(PLR/NLR值>截断值)和低PLR/NLR组(PLR/NLR值≤截断值)。
1.3 统计学方法 采用χ2检验和Fisher′s确切概率法。ROC曲线取PLR和NLR的截断值,曲线下面积(AUC)的比较采用Z检验。应用Kaplan-Meier法和Cox多因素回归模型进行生存分析。
2 结果
2.1 PLR和NLR临界值的确定 以病人的随访期间病人生存状态为判定依据,PLR的最佳临界值为344.7,AUC为0.787;NLR的最佳临界值为17.8,AUC为0.655(见图1)。PLR和NLR 的AUC比较,PLR的诊断价值高于NLR,差异有统计学意义(Z=2.03,P<0.05) 。
2.2 PLR和NLR与BAP病人不同临床特征之间的关系 以PLR和NLR最佳临界值将病人分为PLR高组(PLR>344.7)165例和PLR低组(PLR≤344.7)173例,NLR高组(NLR>17.8)149例和NLR低组(NLR≤17.8)189例。PLR和NLR均与病人性别、年龄、体质量指数、高血压、糖尿病等临床参数无关(P>0.05)。但在高NLR组血清淀粉酶升高的病人比例高于低NLR组,差异有统计学意义(P<0.01)(见表1)。
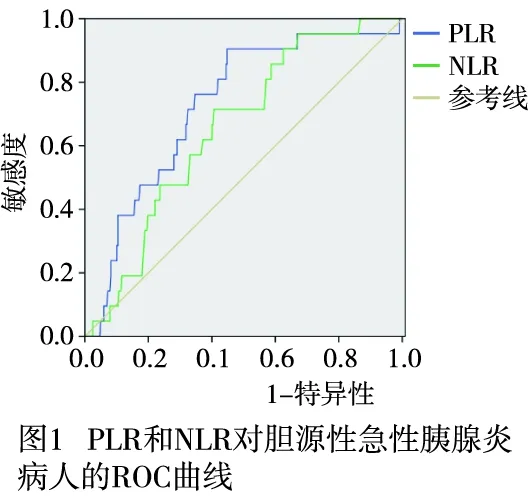
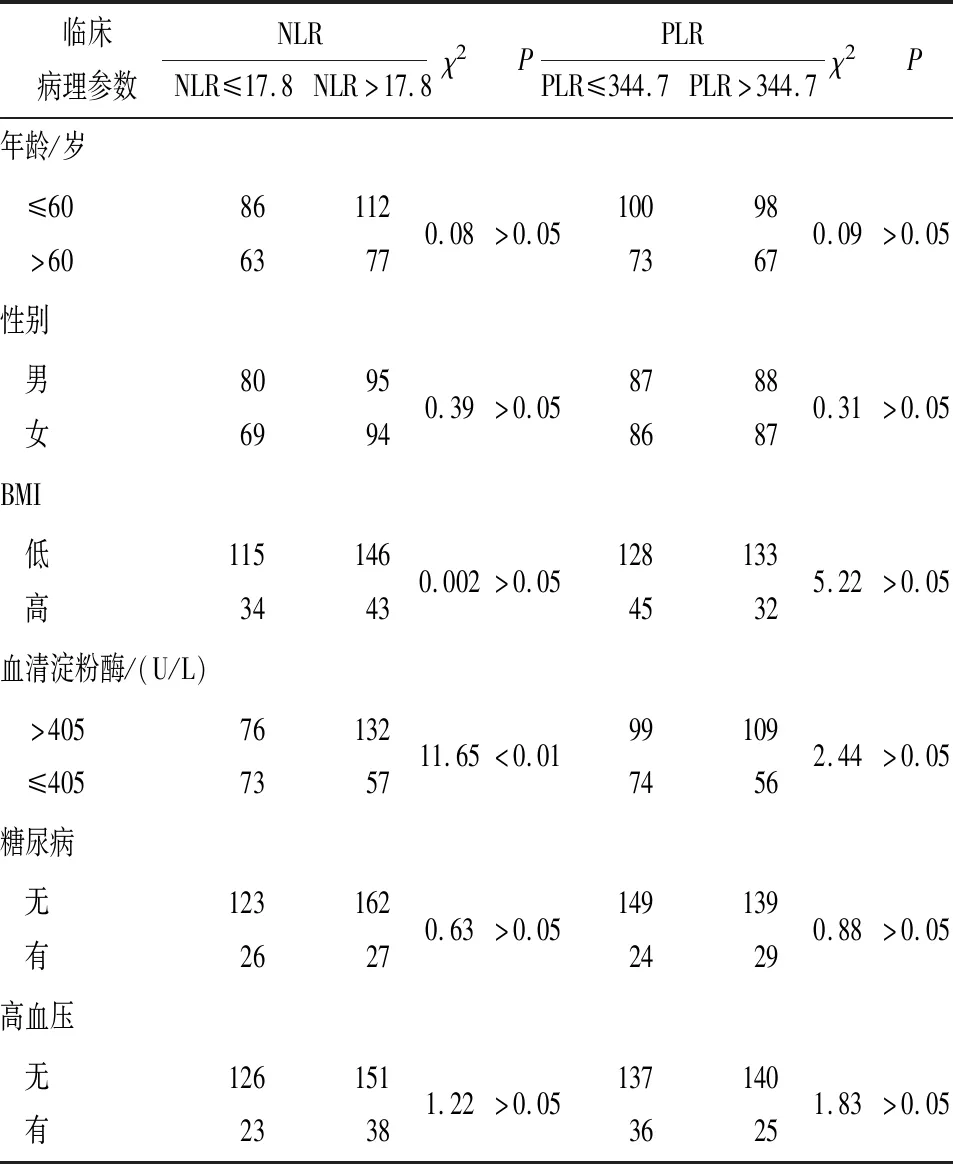
表1 PLR和NLR与BAP病人临床特征之间的关系(n)
2.3 PLR和NLR与BAP病人预后关系分析 高PLR组平均生存时间为93.43 d(95%CI:90.89~97.86),低于低PLR组平均生存时间99.43 d(95%CI:98.15~100.72),差异有统计学意义(χ2=8.062,P<0.01)(见图2)。高NLR组平均生存时间为94.16 d(95%CI:90.33~97.99.00),低于低NLR组平均生存时间98.96 d(95%CI:97.38~100.53),差异有统计学意义(χ2=6.876,P<0.01)(见图3)。Kaplan-Meier法分析结果提示PLR和NLR影响BAP病人预后。以100 d随访生存时间和生存状态(死亡=0,生存=1)作为因变量,以年龄(>60=0,≤60=1)、性别(男= 0,女=1 )、BMI(>18.5 kg/m2=0 ,≤18.5 kg/m2=1)和血清淀粉酶(>405=1,≤405=2)、NLR(低=0,高=1)和PLR(高=0,低=1)等临床特征为自变量进行 Cox等比例风险模型分析,结果表明PLR、NLR与病人预后有关系,其中低PLR病人死亡风险是高PLR病人死亡风险的3.551倍(95%CI:1.161~10.868);高NLR病人死亡风险是低NLR病人死亡风险的2.769倍(95%CI:1.039~7.397)(见表2)。
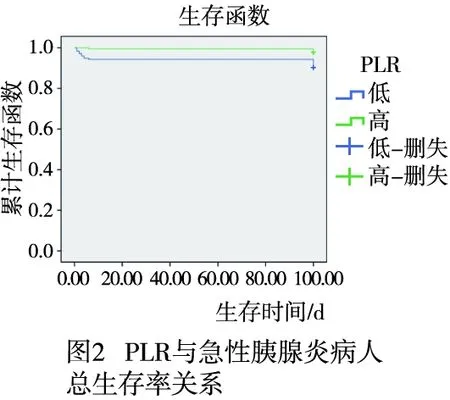
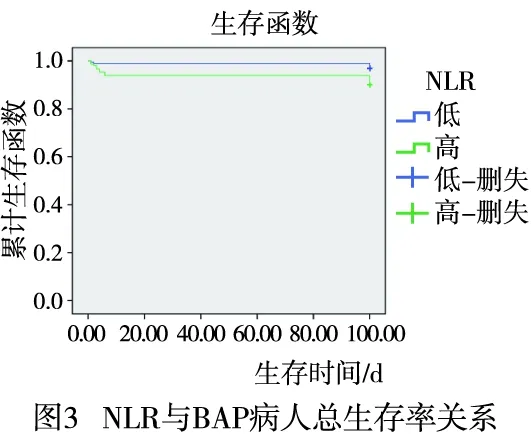
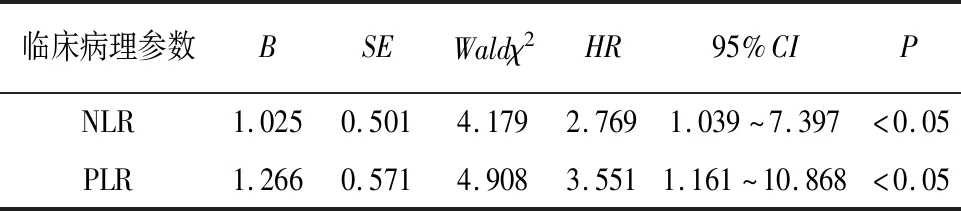
表2 BAP病人多因素生存分析
3 讨论
BAP是临床上最常见的急性胰腺炎类型,临床上寻找预测BAP病人预后的标志物,提前干预高风险病人的病程发展有着重要意义。中性粒细胞和淋巴细胞是白细胞的重要组成部分,在急性胰腺炎的病程进展中发挥着重要作用。急性胰腺炎发病过程中,血小板能够通过血小板活化因子、血小板微粒、趋化因子等因素参与和放大炎症反应,引起组织及器官损伤。本研究发现PLR和NLR与BAP病人生存相关,并且PLR预测BAP病人生存较NLR 更为准确。
AZAB等[6]最早将NLR应用于急性胰腺炎方面研究,研究结果表明当NLR<4.7时急性胰腺炎病人具有更低的ICU住院率和更短的住院时间。随后,国外学者[7]研究了NLR与急性胰腺炎死亡率的关系,但统计结果并没有明显差异。然而我国学者ZHANG等[8]研究表明,NLR≥11是急性胰腺炎预后的独立危险因素,并且提示更高的持续性器官衰竭发生率和更高的死亡率。NLR与BAP病人预后之间的关系报道较少,本文研究了NLR与BAP病人生存预后之间的关系,结果表明NLR是BAP预后的独立影响因素;当NLR>17.8时,死亡风险较高。目前,高NLR提示BAP病人死亡风险增加的具体原因尚不明确。有研究[9-10]表明,较低的中性粒细胞数值往往提示急性胰腺炎病人预后较好。最早有研究[11]表明淋巴细胞的数值对急性胰腺炎疾病严重程度有一定的评估价值。随后,TAKEYAMA等[12]发现重症急性胰腺炎病程中的免疫损伤能够引起淋巴细胞的坏死、减少,并且与急性胰腺炎并发症相关。因此,中性粒细胞计数增加或者淋巴细胞计数相对或者绝对减少(NLR升高)可能提示急性胰腺炎病人预后较差。本研究观察到其中高NLR组血淀粉酶升高3倍以上的比例明显高于低NLR组,可能是BAP病人早期就诊病例较多,淀粉酶早期升高明显,具有一定特异性,但当胰腺组织出现坏死后,部分病人淀粉酶水平与正常值无明显差异。
PLR作为临床常用的免疫炎症标志物,其与良恶性肿瘤、急性胰腺炎等疾病预后关系研究一直是热点问题[13-15]。WANG等[15]回顾性分析了110例高脂血症性急性胰腺炎病人的临床资料,研究了PLR、NLR和RDW与高脂血症性急性胰腺炎预后之间的关系,结果表明PLR不是高脂血症性急性胰腺炎预后的独立影响因素。CHO等[16]回顾性分析了134例结石性急性胰腺炎和109例酒精性急性胰腺炎资料,结果表明NLR和PLR与结石性急性胰腺炎的严重程度相关。ZHOU等[17]研究表明PLR能够预测急性胰腺炎程度和死亡率,但预测价值较红细胞分布宽度低。然而PLR与BAP病人生存预后的关系尚未见报道,本文研究了PLR与BAP病人存预后之间的关系,结果表明PLR是BAP生存预后的独立影响因素;当PLR>344.7时,死亡风险较高。同时,PLR预测价值较NLR高。本研究中高PLR组病人预后较差原因尚未可知,可能与血小板在急性胰腺炎发展过程中作用及淋巴细胞的减少有关。血小板作为外周血的有形成分,最初的研究多集中在维持血管壁完整性、止血、伤口愈合等方面,随着研究的深入,血小板与胰腺炎的作用机制被逐渐揭示。血小板能够通过产生血小板活化因子、血小板微粒等成分驱化炎症细胞聚集、浸润,放大炎症反应,引起肿瘤坏死因子、白细胞介素、黏附分子等炎症因子的大量释放,引起内皮细胞损伤,进一步造成组织和器官损害[18-19]。
本研究仍存在一定的局限性。首先此次研究为单中心、小样本的研究,可能因样本量问题造成统计学偏倚。其次,急性胰腺炎病程进展极为复杂,不同时间点外周血指标改变显著,单次抽血结果预测最终结局存在一定的偶然性,本研究为回顾性研究,未能做重复抽血结果的统计。未来仍需大样本、多中心、前瞻性、重复性的临床资料验证其可靠性。
综上所述,PLR和NLR是预测急性胰腺炎死亡率的潜在标志物,能够从血常规中获取,不增加病人经济负担,进一步验证后有在临床上有广泛推广使用的潜力。

