体外膜肺氧合支持下的经导管主动脉瓣置入术1例
马 晔,张亚军
(中日友好医院 手术麻醉科,北京 100029)
患者男性,81岁,因“反复晕厥2年,加重1d”入院。既往高血压、糖尿病、冠心病病史。入院心电图:V1、V2、V3导联ST段抬高,V5、V6 导联ST段压低。肌钙蛋白T(TnT)0.777ng/ml,肌红蛋白(Myo)124.6ng/ml,肌酸激酶同工酶(CK-MB)20.15ng/ml,脑钠肽前体(NT-proBNP)30531pg/ml。床旁心脏超声:左室壁节段性室壁运动异常,全心扩大,主动脉瓣重度狭窄并轻度返流,左室射血分数24%。考虑主动脉瓣重度狭窄合并ST 段抬高型心肌梗死,心衰,予抗板、降脂、控制心室率、利尿等相关治疗。择期冠脉造影显示:左冠脉主干中段以远狭窄50%;前降支近段狭窄70%~80%;回旋支近段狭窄25%~50%;右冠脉近段狭窄25%~50%,中段狭窄50%~80%,远段瘤样扩张、狭窄50%~70%。心衰有所控制、冠脉情况明确后请心外科会诊评估换瓣指征和可行性,转入心外科进一步完善术前准备。复查心电图:V1、V2、V3导联T波倒置,V5、V6导联ST段压低。TnT 0.055ng/ml,NT-proBNP 13224pg/ml。心脏超声:左室壁运动普遍减低,全心扩大(左房56mm,左室61mm,右房46mm,右室42mm),主动脉瓣钙化并狭窄(重度)、返流(轻度),左室收缩、舒张功能减低,左室射血分数33%。CT 血管造影评估主动脉及瓣膜情况、冠脉解剖结构、血管入路情况,拟全身麻醉下行股动脉入路经导管主动脉瓣置入术(transcatheter aortic valve implantation,TAVI)及经皮冠脉介入治疗(percutaneous coronary intervention,PCI)。
麻醉前评估:活动耐量:轻微体力活动后感明显气促。美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级:Ⅲ级。美国胸外科医师协会(The Society of Thoracic Surgeons,STS)评分:4.1%,欧洲心脏手术风险评分系统Ⅱ(European system for cardiac operative risk evaluation Ⅱ,Euro SCORE Ⅱ):4.78%。
手术及麻醉过程:患者入室后常规监护,开放静脉通路,安置体外除颤电极,桡动脉穿刺置管监测有创动脉血压,麻醉诱导行气管插管,过程顺利。超声引导下颈内静脉穿刺置管,放置,经食道超声心动图(transesophageal echocardiogram,TEE)评估瓣膜结构及心脏功能(图1,见封三)。首先处理冠脉病变,旋磨前降支病变并置入支架2枚。之后行TAVI手术,调整临时起搏器至180次/min进行主动脉瓣球囊扩张并造影,主动脉瓣球囊扩张后血压波动在60/40mmHg 左右,静脉推注去甲肾上腺素,血压回升。造影结果提示主动脉瓣扩张未达到预期效果,再次行主动脉瓣扩张。再次扩张后即刻出现血压急剧下降,有创动脉血压30/20mmHg。立即静推肾上腺素、同时外科医生开始胸外按压。短暂中断按压后快速放置主动脉瓣装置,主动脉瓣释放后血压波动在80~100/25~30mmHg,心率波动在95~130bpm。经TEE 查看瓣膜开合欠佳(图2,见封三)、探及瓣膜血流不满意,此时患者舒张压不能维持,立即进行股动静脉穿刺置管紧急建立静脉-动脉体外膜肺氧合(veno-arterial extracorporeal membrane oxygenation,VA-ECMO),为后续调整瓣膜位置争取时间。VA-ECMO成功建立后,患者血压波动在100~120/45~55mmHg。再次行主动脉瓣球囊扩张并调整瓣膜位置,经食道超声检查瓣膜开合良好(图3,见封三),未见明显返流及瓣周漏。同时进行纠酸、维持电解质水平等处理。在血管活性药物辅助下撤除VA-ECMO,术毕停麻醉药物,逐渐减停血管活性药物。患者循环稳定、意识清楚、呼吸参数满意,予拔除气管导管转至重症监护室进一步治疗。患者术后第2d 转至心外科病房。术后1 周复查心脏超声,结果提示:主动脉瓣瓣膜功能未见明显异常,主动脉瓣瓣周未见异常血流信号,左室壁运动普遍减低,全心扩大,二、三尖瓣返流(轻度),左室射血分数44%。术后第18d 出院,患者出院时神志清楚、睡眠饮食正常,予出院疗养、定期复查。
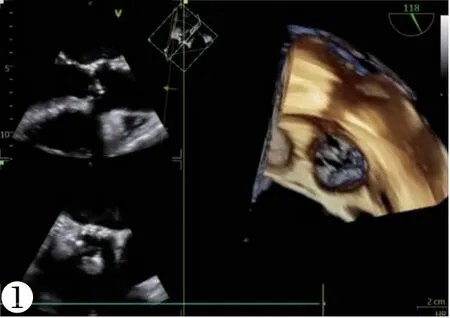
图1 术前TEE提示主动脉瓣钙化、开放受限。

图2 经导管主动脉瓣置入后TEE评估瓣膜开放欠佳。

图3 建立VA-ECMO,主动脉瓣球囊扩张并调整瓣膜位置后再次TEE评估瓣膜开放良好。
讨论
近年来,TAVI 手术为严重主动脉瓣狭窄的高危患者提供了更微创的治疗选择。但其属于复杂高危的介入手术,术中随时可能发生危及生命的并发症,术中的循环管理是麻醉医生面临的巨大挑战。
此病例患者术中出现循环崩溃的原因总结如下:首先,快速心室起搏时接近心脏停顿的过程造成舒张压降低,冠脉血流灌注减少,发生心肌缺血。其次,患者本身存在心功能不全,在球囊扩张主动脉瓣后出现严重的主动脉瓣返流,左室前负荷急剧增加,发生心功能不全急性加重。以上原因导致了患者循环崩溃,在心肺复苏、快速置入人工主动脉瓣后,TEE 查看主动脉瓣膜位置不佳,探及血流不满意,此时患者的舒张压仍不能维持,决定使用VA-ECMO 为患者临时提供心肺支持,首先维持患者血流动力学稳定,同时为后续治疗策略赢得宝贵时间,使患者完成TAVI手术并改善患者预后。
基于以上总结,良好的冠脉情况是TAVI 手术顺利进行的重要条件。既往研究表明行TAVI手术的冠心病患者总体死亡率较非冠心病患者显著增加且患者预后与冠脉病变严重程度相关。而冠心病患者可通过PCI 治疗减轻心肌缺血的负担,最新指南提出:TAVI 患者合并近段冠脉狭窄>70%应考虑行PCI 治疗(Ⅱa)[1]。但目前PCI 治疗的策略仍存在争议。研究显示,对严重冠脉病变的患者进行部分冠脉血运重建,其残余SYNTAX 评分低(<8)的患者其1年死亡率更低[2]。另有研究显示,完全冠脉血运重建与部分冠脉血运重建患者的TAVI 术后5年生存率无统计学差异[3]。此外,PCI治疗的时机也尚无定论,其可在TAVI手术前、手术同时或手术后进行。近期一项横断面研究提出:3种PCI 治疗时机对于TAVI 患者术后2年主要心脏及脑血管事件风险无统计学差异[4]。该研究同时提出,TAVI 同期行PCI 治疗并不增加急性肾损伤(acute kidney injury,AKI)发生率、血管并发症及危及生命的出血,而对于AKI及出血高风险的患者,分期手术可能更加合适。因此,对于拟行TAVI 手术且合并冠心病的患者,进行PCI 治疗是必要的,具体应结合患者病情制定个体化治疗策略。
此病例在患者血流动力学不稳定期间及时建立VAECMO,使手术成功进行、患者顺利出院,充分体现了机械循环支持的重要性。拟行TAVI手术的患者多合并严重的共存疾病、心肺储备功能差,术中常常存在危及生命的并发症。常见的并发症包括主动脉瓣返流、冠状动脉闭塞、心律失常、瓣膜定位偏差、脑卒中、急性肾损伤、血管及出血并发症、感染性心内膜炎、血管内溶血等,少见并发症包括瓣环断裂、心室穿孔、主动脉夹层甚至死亡[5]。研究显示,在2012~2015年行TAVI 手术的60985 例患者中,有2.8%的患者在住院期间接受了机械循环支持[6]。机械循环支持包括建立体外循环、主动脉内球囊反搏、VA-ECMO等。其中,VA-ECMO可通过血管穿刺快速建立、仪器设备使用便捷,使之成为有效的复苏工具。VA-ECMO 除了在术中出现危及生命的严重并发症时紧急应用外,可预防应用于高危TAVI患者,为手术安全、顺利实施保驾护航。一篇综述对2012年~2017年的14项关于TAVI手术使用VAECMO 的研究结果进行整理分析[7],总结提出:5115 例TAVI患者中有2%需要使用VA-ECMO,其中22例预防应用、66 例紧急应用,使用VA-ECMO 患者住院期间生存率为73%,其中预防应用组为100%、紧急应用组为61%。总结预防放置VA-ECMO 的指征包括以下7点:(1)需要住院治疗的心衰并且在TAVI手术处于前稳定状态;(2)术前评估为中/重度左和/或右室衰竭;(3)术前由于血流动力学不稳定需要进行主动脉瓣球囊扩张以改善心功能;(4)中心静脉压/肺毛细血管楔压>20mmHg,平均肺动脉压力>40mmHg,正性肌力药物不能改善的心指数<2.0;(5)测试起搏器时进行快速起搏后心率恢复缓慢;(6)全身麻醉后需要大剂量血管活性药物支持;(7)同时进行高风险的经皮冠脉介入治疗。
对此病例进行反思,患者合并近期ST 段抬高型心梗、心衰,TAVI 同期行PCI 治疗,也许预防应用VA-ECMO 能够避免血流动力学剧烈波动,使患者预后更好。目前TAVI患者预防使用VA-ECMO 的适应证尚无统一意见,仍需要更多的临床研究数据支持。

